Effect of Different Mechanical Stimulation on the TGF-β/Smad Pathway and Bone Formation in Type 2 Diabetes Mellitic Mice
-
摘要:目的 探究不同力学刺激对T2DM小鼠骨中TGF-β/Smad途径相关分子表达及骨形成的影响。方法 通过6周高脂膳食和注射STZ进行T2DM小鼠造模,2周后随机分为T2DM对照组(TC)、T2DM游泳组(TS)和T2DM下坡跑组(TD),另设正常对照组(ZC)。利用8周游泳和下坡跑对TS和TD组小鼠进行干预。利用RT-PCR等技术方法对细胞因子mRNA和蛋白表达、OB骨形成能力、股骨BMD等进行检测。结果 与ZC组相比,TC组TGF-β、Smad2/3/4、Runx2和Osx的mRNA表达及p-Smad2/3和Smad4蛋白表达均显著下调(P < 0.05或P < 0.01),OB和颅骨骨形成能力、松质骨和皮质骨BMD及股骨形态大小均显著下降(P < 0.05或P < 0.01)。与TC组相比,TS组TGF-β和Osx mRNA及p-Smad2/3蛋白表达均显著上调(P < 0.05或P < 0.01),OB和颅骨骨形成能力显著增强,股骨湿重(P < 0.01)显著增加;TD组TGF-β、Smad2、Runx2和Osx mRNA及p-Smad2/3和Smad4蛋白表达显著上调(P < 0.05或P < 0.01),OB和颅骨骨形成能力显著增强,松质骨BMD、股骨湿重、股骨远端冠状轴和股骨远端矢状轴宽度显著升高(P < 0.01);与TS组相比,TD组Smad2和Osx mRNA及p-Smad2/3和Smad4蛋白表达上调(P < 0.05),OB和颅骨骨形成能力增强,股骨远端矢状轴宽度(P < 0.05)显著增加。结论 下坡跑对T2DM小鼠骨产生的直接作用力通过激活TGF-β/Smad途径促进骨形成,增加BMD,改善骨湿重和形态大小,且其效果优于游泳产生的间接作用力。Abstract:Objective to explore the effect of different mechanical stimulation on TGF-β/Smad pathway and bone formation in type 2 diabetes mellitic mice.Method T2DM mice, built by high-fat diet and injection STZ, were randomly divided into T2DM control group (T2DM), T2DM swimming group (TS) and T2DM downhill group (TD), and also normal control group.The mice of TS and TD group were respectively treated with 8 weeks of swimming and downhill running.RT-PCR was used to detect the mRNA expression of related factors in the right femur.Western-blotting was used to detect the expression of related factor proteins in the right tibia.BMSCs were cultured and induced to differentiate into OB.Alizarin Red staining was used to stain OB.The skull was stained with Alizarin Red dye.Left femur BMD was detected by Micro-CT.The wet weight and bone shape of right femur were detected by electronic scale and vernier caliper.Results Compared with ZC group, the mRNA expression of TGF-β, Smad2, Smad3, Smad4, Runx2 and Osx and the protein expression of p-Smad2, p-Smad3 and Smad4 in TC group were significantly decreased (P < 0.05 or P < 0.01).The bone formation capacity of OB and skull, bone mineral density of trabecular and cortical and also the morphological size of femur were significantly decreased.Compared with TC group, the mRNA expression of TGF-β, Osx and the protein expression of p-Smad2 and p-Smad3 were significantly up-regulated in TS group (P < 0.05 or P < 0.01).The osteoblastic ability of OB and skull was significantly increased (P < 0.05 or P < 0.01);the wet weight of femur was improved (P < 0.01).The mRNA expression of TGF-β, Smad2, Runx2 and Osx and protein expression of p-Smad2, p-Smad3 and Smad4 were significantly up-regulated in TD group (P < 0.05 or P < 0.01).The osteoblastic capacity of OB and skull, BMD of trabecular, wet weight of the femur, the width of the distal coronal axis of the femur and the sagittal axis of the distal femur were significantly increased (P < 0.01).Compared with TS group, the mRNA expression of Smad2 and Osx and protein expression of p-Smad2, p-Smad3 and Smad4 of TD group were improved (P < 0.05).The osteoblastic ability of OB and skull was enhanced and the width of sagittal axis of femur was significantly increased (P < 0.05).Conclusion Bone formation in T2DM mice was inhibited.The direct effect of downhill running on bone formation in T2DM mice was improved by activating TGF-β/Smad pathway, promoting bone formation, increasing BMD, and improving bone wet weight and shape, and its effect was superior to the indirect force generated by swimming.
-
Ⅱ型糖尿病(type 2 diabetes mellitus, T2DM)是一种内分泌代谢疾病,其发病与胰岛素抵抗、胰岛β细胞功能受损有关[1]。T2DM抑制成骨细胞(osteoblast, OB)分化产生及骨形成[2]。在生命医学领域内,探究T2DM抑制OB分化产生和骨形成分子调控机制的相关研究较多,但其信号调控网络仍不完善。转化生长因子(transforming growth factor-β, TGF-β) /Smad是调控骨形成的重要途径,该途径被激活后可促进T2DM小鼠OB分化产生及骨形成,改善骨量和骨形态结构[3]。运动是改善骨代谢的重要手段,但不同方式的运动对骨产生的力学刺激方式(分为直接作用力和间接作用力,即地面对骨的反作用力和肌肉对骨的牵拉力)存在较大差异。研究发现,直接作用力促进骨形成的作用效果显著优于间接作用力[4]。虽然有关运动改善T2DM骨代谢的研究较多[5-7],但相关研究主要集中在骨密度、骨生物力学等骨表型指标上,有关不同力学刺激影响T2DM小鼠骨中TGF-β/Smad信号途径相关分子表达及骨形成的研究尚未见报道。本文利用游泳和下坡跑模拟对骨产生的间接作用力和直接作用力,对T2DM小鼠进行运动干预;探究T2DM小鼠骨中TGF-β/Smad途径中相关分子表达和骨形成的变化以及不同力学刺激对TGF-β/Smad途径中相关分子表达和骨形成的影响。
1. 研究材料与方法
1.1 实验动物造模及分组
40只4周龄的C57BL/6雄性小鼠购于上海西普尔-必凯公司(生产证号:SYXX(沪)2015-0011),初始体质量为(19±0.24) g,适应性喂养1周后,随机分为正常对照组(ZC,10只)和T2DM造模组(30只)。T2DM造模组小鼠6周高脂膳食(繁殖鼠料质量分数为54.6%、猪油质量分数为16.9%、蔗糖质量分数为14.0%、酪蛋白质量分数为10.2%、预混料质量分数为2.1%、麦芽糊精质量分数为2.2%,购自上海斯莱克公司)喂养结束后空腹12 h,然后一次性注射80 mg/kg链脲佐菌素(Streptozotocin,STZ),TC组小鼠注射柠檬酸-柠檬酸钠溶液。STZ注射结束2周后,小鼠空腹12 h后检测其血糖浓度,凡血糖浓度≥8 mmol/L的为T2DM小鼠[8],27只造模成功并随机分为T2DM对照组(TC,n=9)、T2DM游泳组(TS,n=9)和T2DM下坡跑组(TD,n=9)。正常小鼠喂食普通饲料,T2DM小鼠继续喂食高脂膳食,均自由饮水,昼夜比为1:1(动物伦理编号:M20150311)。
1.2 实验动物训练方案
利用游泳和下坡跑分别对TS组和TD组小鼠进行训练,方案如下。游泳:将小鼠放于42 cm(长)×40 cm(宽)×36 cm(深)的容器中进行训练,50 min/d,共计8周。第1周为适应性训练,前2天每天训练30 min,第3、第4天每天训练40 min,第5、第6天每天训练50 min,第2周开始进行正常训练。下坡跑:速率为0.8 km/h,持续时间为50 min,坡度为-9°,6 d/周,共计8周。第1周为适应性训练,前2天每天训练30 min,第3、第4天每天训练40 min,第5、第6天每天训练50 min,第2周开始进行正常训练。
1.3 实验动物取材
取小鼠左后肢(去除肌肉等软组织),以备Micro CT检测股骨远端骨密度(bone mineral density, BMD);取小鼠右侧后肢骨用于股骨湿重和骨形态大小、相关细胞因子mRNA(股骨)和蛋白(胫骨)表达检测;取骨髓间充质干细胞(bone marrow mechel stem cell, BMSCs)进行细胞原代培养并诱导其向OB分化,利用Alizarin Red染液对其骨形成能力进行检测;取颅骨以备进行Alizarin Red染色。
1.4 指标检测
1.4.1 骨中相关细胞因子mRNA表达的检测
取右侧股骨,提取RNA并将其反转为cDNA。按定量试剂盒标准步骤对TGF-β/Smad信号途径及其下游靶基因mRNA表达进行检测。引物序列利用Primer premer软件进行设计,并由上海生工生物工程有限公司合成(表 1)。
表 1 引物序列一览Table 1. List of primer sequencesPrimer名称 序列(5’ to 3’) 碱基数 Smad2-Forward 5’-CTGTGACGCATGGAAGGTCT-3’ 27 Smad2-Reverse 5’-CCACGTAGTAGACGATGGGC-3’ 26 Smad3-Forward 5’-CAGCGAGTTGGGGAGACATT-3’ 27 Smad3-Reverse 5’-TGTAAGTTCCACGGCTGCAT-3’ 26 Smad4-Forward 5’-CGATGGAATTTTACATACG-3’ 24 Smad4-Reverse 5 ’-CGCCTAAGTTGCTAGGTGG-3 ’ 24 β-actin-Forward 5’-ACCCAGAAGACTGTGGATGG-3’ 26 β-actin -Reverse 5’-TTCAGCTCAGGGATGACCTT-3’ 26 Osx-Forward 5’-GTTCACCTGTCTGCTCTGCTC-3’ 20 Osx-Reverse 5’-AGCTCCTTAGGGCCACTTGG-3’ 20 Runx2-Forward 5’-GTCCTATGACCAGTCTTACC-3’ 20 Runx2-Reverse 5’-GATGAAATGCCTGGGAACTG-3’ 20 TGF-β1-Forward 5’-AGGGCTACCATGCCAACTTC-3’ 26 TGF-β1-Reverse 5’-CCACGTAGTAGACGATGGGC-3’ 26 1.4.2 骨中相关蛋白表达的检测
取右侧胫骨,研磨后提取骨中蛋白,按二辛可宁酸(Bicinchoninic acid,BCA)法检测样本的蛋白浓度,结束后利用PBS将所有样本的蛋白水平调整到同一水平;然后进行变性、电泳、转膜处理,结束后利用丽春红进行染色,并按目的条带相对分子质量的大小对聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜进行裁剪,经磷酸盐缓冲液(Phosphate buffer,PBS)清洗后用质量分数为5%的脱脂奶粉封闭条带1~2 h,利用已稀释好的Ⅰ抗(按1:1 000的比例进行稀释)4 ℃孵育过夜;然后进行TBST清洗,并利用Ⅱ抗于室温孵育2 h,TBST洗膜;最后,利用Alpha凝胶成像系统对PVDF膜进行显影拍照,利用Fluorchem FC2-WB软件进行数据分析。
1.4.3 BMSCs分化产生OB的骨形成能力检测
小鼠断颈椎处死后于体积分数为75%的酒精中灭菌,利用剪刀、镊子和纱布将小鼠后肢骨上软组织清除干净,然后转至无菌台中操作。在体积分数为75%的酒精中浸泡2~3 min,利用已灭菌的PBS清洗2遍。利用已灭菌剪刀剪除股骨和胫骨两端,暴露骨髓腔,用10 mL注射器吸10 mL培养基并配以1 mL注射器的针头,将骨髓冲到50 mL离心管中。完毕后,制备单细胞悬液。取1.5 mL EP管,将适量单细胞悬液加至1.5 mL EP管中,并加入红细胞裂解液,静止5 min后利用血细胞计数板进行计数。结束后,按50万个/孔接于24孔板中。置于培养箱中,2~3 d换1次液(视细胞的生长状况而定),6 d后向培养基中加入维生素C(1000×)和β-甘油磷酸(100X)诱导BMSCs向OB分化,2~3 d换1次液,在分化的第14天,利用体积分数为4%的PFA固定OB,然后采用Alizarin Red染液染色,最后利用相机拍照。
1.4.4 颅骨骨形成能力的检测
颅骨经PBS清洗后,在体积分数为4%的多聚甲醛中于4 ℃下固定24 h。结束后,分别用体积分数为0.1%的Triton-X100和PBST于4 ℃下透化24 h,结束后利用Alizarin Red染液进行染色,约30 min。染色结束,利用相机拍照,并利用Photoshop软件截取人字缝位置,观察骨形成能力的变化。
1.4.5 BMD检测
取右侧股骨,利用体积分数为4%的PFA固定24 h,然后用Skyscan Micro-CT系统(型号: 1076)按每帧18 μm的规格对股骨远端进行扫描。结束后,利用CT An软件获取BMD数据。
1.4.6 股骨湿重和骨形态大小的检测
取右侧股骨并利用电子称对股骨湿重进行称量。利用游标卡尺对股骨长度、远端矢/冠状轴宽度、中间矢/冠状轴宽度、近端矢/冠状轴宽度等骨形态大小指标进行测量。
1.5 数据统计
利用Excel、GraphPad Prism 5和SPSS 18.0对实验检测的数据进行统计、分析(ZC组和TC组进行独立样本t检验,TC组、TS组和TD组进行单因素方差分析),P<0.05和P<0.01分别表示差异具有显著性和差异具有非常显著性。
2. 研究结果
2.1 不同力学刺激对T2DM小鼠骨中相关因子mRNA表达的影响
由表 2可知:与ZC组相比,TC组TGF-β(P<0.01)、Smad2(P<0.05)、Smad3(P<0.05)、Smad4(P<0.01)、Runx2(P<0.05)和Osx(P<0.01)mRNA表达显著下调。与TC组相比,TS组TGF-β(P<0.05)和Osx(P<0.01)mRNA表达显著上调;TD组TGF-β(P<0.05)、Smad2(P<0.05)、Runx2(P<0.01)和Osx(P<0.01)mRNA表达显著上调。与TS组相比,TD组Smad2(P<0.05)和Osx(P<0.05)mRNA表达显著上调。
表 2 不同力学刺激对相关因子mRNA表达的影响Table 2. Effects of different mechanical stimulation on factormRNA expressionmean±SD, n=6 力学刺激 ZC组 TC组 TS组 TD组 TGF-β 0.46±0.26 0.11±0.02** 0.15±0.03★ 0.20±0.07★ Smad2 3.57±1.84 1.77±0.23* 1.73±0.35 2.32±0.45★● Smad3 12.99±3.06 8.21±2.16* 8.56±2.16 9.48±1.05 Smad4 4.78±0.66 1.92±0.97** 2.70±0.69 2.73±0.49 Runx2 2.73±1.12 1.25±0.12* 1.62±0.58 2.13±0.57★★ Osx 10.69±1.95 5.69±1.07** 8.19±0.56★★ 9.71±1.32★★● 注:与ZC组相比,*表示P<0.05,**表示P<0.01;与TC组相比,★表示P<0.05,★★表示P<0.01;与TS组相比,●表示P<0.05;表 3~表 5同此 2.2 不同力学刺激对T2DM小鼠骨中细胞因子蛋白表达的影响
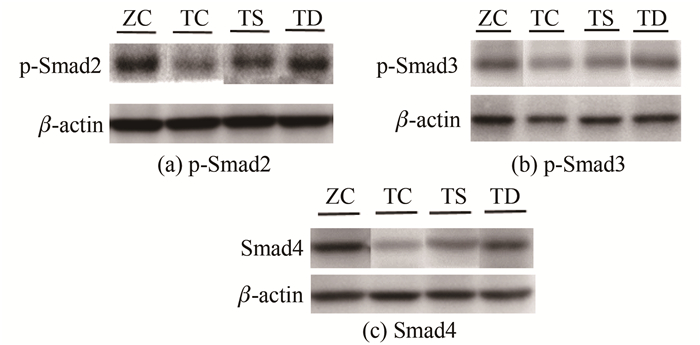
由图 1和表 3可知:与ZC组相比,TC组p-Smad2(P<0.01)、p-Smad3(P<0.05)和Smad4(P<0.05)蛋白表达显著下调;与TC组相比,TS组p-Smad2(P<0.01)和p-Smad3(P<0.05)蛋白表达上调,TD组p-Smad2(P<0.05)、p-Smad3(P<0.05)和Smad4(P<0.05)蛋白表达显著上调;与TS组相比,TD组p-Smad2(P<0.05)、p-Smad3(P<0.05)和Smad4(P<0.05)蛋白表达亦显著上调。
表 3 不同力学刺激对相关因子蛋白表达的影响Table 3. Effect of different mechanical stimulations on factorprotein expressionmean±SD, n=6 力学刺激 ZC组 TC组 TS组 TD组 p-Smad2 1.25±0.28 0.71±0.15** 0.96±0.15★ 0.95±0.16★● p-Smad3 0.95±0.21 0.49±0.12* 0.67±0.12★ 0.69±0.13★● Smad4 1.46±0.47 0.83±0.31* 1.11±0.21 1.43±0.36★● 2.3 不同力学刺激对T2DM小鼠OB和颅骨成骨能力的影响
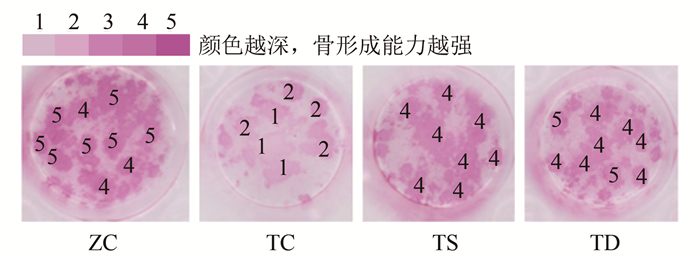
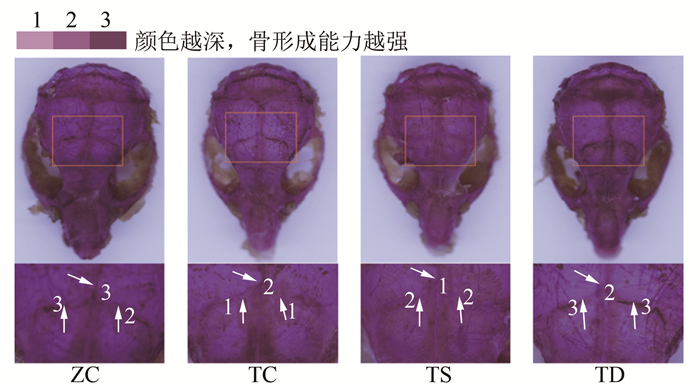
由图 2~图 3可见:与ZC组相比,TC组OB和颅骨的骨形成能力下降;与TC组相比,TS组OB的骨形成能力增强,TD组OB和颅骨的骨形成能力增强;与TS组相比,TD组OB和颅骨的骨形成能力增强。
2.4 不同力学刺激对T2DM小鼠股骨BMD的影响
由表 4可知:与ZC组相比,TC组松质骨BMD(P<0.01)和皮质骨BMD(P<0.01)显著下降;与TC组相比,TD组松质骨BMD(P<0.01)显著升高。
表 4 不同力学刺激对股骨BMD的影响Table 4. Effect of different mechanical stimulations onfemur's BMDmean±SD, n=6 项目 ZC组 TC组 TS组 TD组 松质骨 0.37 ±0.01 0.22 ±0.02** 0.26±0.04 0.33±0.02★★ 皮质骨 1.77 ±0.01 1.72 ±0.01** 1.74±0.03 1.75±0.02 2.5 不同力学刺激对T2DM小鼠股骨湿重和骨形态的影响
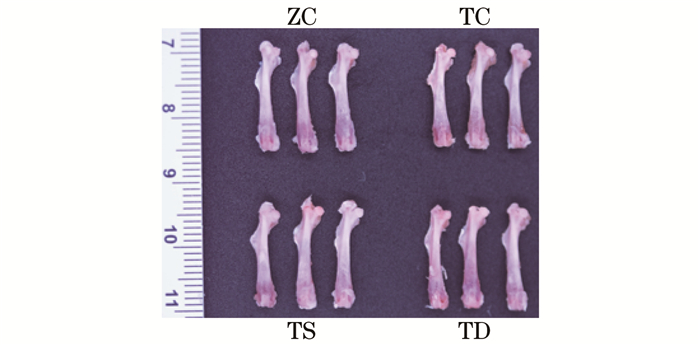
由图 4和表 5可知:与ZC组小鼠相比,TC组股骨湿重(P<0.05)、股骨长度(P<0.05)、远端矢状面宽度(P<0.05)和远端冠状面宽度(P<0.01)均显著下降;与TC组相比,TS组股骨湿重(P<0.01)显著增加,TD组股骨湿重(P<0.01)、远端冠状轴宽度(P<0.01)和远端矢状轴宽度(P<0.01)均显著升高;与TS组相比,TD组远端矢状轴宽度(P<0.05)显著增加。
表 5 不同力学刺激对股骨湿重和骨形态大小的影响Table 5. Effects of different mechanical stimulations on boneweight and size of femurmean±SD, n=6 项目 ZC组 TC组 TS组 TD组 股骨湿重/mg 81.67±8.19 70.67±3.78* 82.17±3.65★★ 85.5±3.45★★ 股骨长度/mm 16.89±0.51 16.22±0.25* 16.27±0.22 16.58±0.56 远端矢状轴宽度/mm 1.85±0.17 1.62±0.12* 1.74±0.16 1.97±0.11★★● 远端冠状轴宽度/mm 2.82±0.13 2.52±0.14** 2.61±0.21 2.75±0.08★★ 中间矢状轴宽度/mm 1.52±0.14 1.46±0.08 1.44±0.77 1.48±0.08★★ 中间冠状轴宽度/mm 2.35±0.31 2.21±0.38 2.09±0.08 2.04±0.11 近端矢状轴宽度/mm 1.81±0.09 1.71±0.19 1.92±0.23 1.84±0.18 近端冠状轴宽度/mm 2.32±0.12 2.26±0.11 2.28±0.32 2.33±0.18 3. 讨论
3.1 不同力学刺激对T2DM小鼠骨中TGF-β/Smad途径相关分子表达的影响
骨形成具有增加骨量、改善骨组织形态结构等作用[9]。TGF-β/Smads途径中的多肽因子——TGF-β,通过与膜上丝氨酸/苏氨酸激酶受体(transforming growth factor-βreceptor Ⅱ, TβR-Ⅱ)结合并将其激活,然后活化TβR-Ⅰ,进而磷酸化胞内Co-Smads(Smad2/3)。其与Smad4结合形成磷酸化信号传导复合体后迅速入核,调控靶蛋白(Runx2、Osterix(Osx)等)表达,促进OB分化产生和骨形成,改善骨量和骨形态结构[10-11]。T2DM会抑制OB分化产生及骨形成,研究发现,TGF-β/Smads途径在此过程中具有重要的调控作用[3]。Ghiraldini等[12]和Ehnert等[13]证实,T2DM病人骨折或骨折后修复延迟与骨中TGF-β表达下调密切有关。另有研究证实,T2DM大鼠骨量下降与骨中TGF-β/Smads途径被抑制有关[14]。与ZC组相比,TC组TGF-β1、Smad2/3/4、Runx2和Osx mRNA及p-Smad2、p-Smad3和Smad4蛋白表达均显著下调。说明T2DM小鼠骨中TGF-β/Smad途径及其靶基因表达被显著抑制,这与前人的研究结果一致。这与T2DM小鼠机体内胰岛素浓度降低,胰岛素样生长因子(insulin-like growth factor, IGF-1)表达下调进而抑制骨中TGF-β/Smad信号途径表达有关[15]。
运动作为促骨形成的有效方式,在改善T2DM人或动物骨量、骨组织形态结构等指标上的作用已被证实[5-7]。有关TGF-β/Smad信号途径介导T2DM小鼠骨形成运动适应的相关研究尚鲜有报道。在本文中,TS组TGF-β1和Osx的mRNA及p-Smad2和p-Smad3的蛋白表达上调,TD组TGF-β1、Smad2、Runx2和Osx mRNA表达及p-Smad2、p-Smad3和Smad4蛋白表达上调;与TS组相比,TD组Smad2和Osx的mRNA表达及p-Smad2、p-Smad3和Smad4蛋白表达亦上调。这表明,下坡跑可显著激活T2DM小鼠骨中TGF-β/Smad信号途径,且其效果优于游泳。分析以上结果的差异,与2种运动方式对骨产生的力学刺激方式不同密切相关[4]。下坡跑对T2DM小鼠骨产生的直接作用力可激活IGF-1表达,其表达上调可激活TGF-β/Smad信号途径[16]。直接作用力亦可通过上调E-选择素配体1(E-selectin ligand 1, ESL-1)表达进而激活TGF-β/Smad途径及其靶基因Runx2、Osx等[17]。当MKP2/3表达下调后[18],其基因序列上苏氨酸和酪氨酸的脱磷酸化会活化Smad3,进而激活TGF-β/Smad途径及Runx2和Osx表达[19]。有研究发现,直接的作用力亦可通过上调T2DM小鼠骨中miR-34a[20]和miR-27b[21]表达来激活TGF-β/Smad途径及其靶基因。
3.2 不同力学刺激对T2DM小鼠骨形成能力的影响
OB由BMSCs分化产生,其能力增强后可改善BMD和骨组织形态结构[22]。T2DM可以抑制OB分化产生及骨形成,但目前这方面的相关研究较少。Park等[23]和徐飞等[24]的研究均证实,T2DM小鼠分化产生的OB数量及骨形成下降。与ZC组相比,TC组OB骨形成能力下降,且颅骨骨形成能力亦显著下降。这说明T2DM会抑制小鼠骨形成能力,这与前人的研究结果一致。分析其原因,这与T2DM小鼠骨中TGF-β/Smads通路被抑制有关[10]。T2DM小鼠骨中BMP-2、BMP-4和BMP-7[25-26]表达下调及金属转运蛋白1(metal transfer protein 1, DMT1)、过氧化物酶体增殖激活物受体γ辅激活因子1(peroxidase body growth activated receptor gamma auxiliary 1, PGC-1α)等的表达变化[27]亦会抑制OB和颅骨骨形成能力密切相关。
运动可改善T2DM骨代谢,但有关不同力学刺激影响T2DM小鼠骨形成能力的相关研究尚鲜有报道。与TC组相比,TS组和TD组OB和颅骨骨形成能力均升高;与TS组相比,TD组OB和颅骨骨形成能力亦高。说明8周运动显著提高了T2DM小鼠OB和颅骨骨形成能力,且下坡跑的作用效果优于游泳。这与游泳和下坡跑对T2DM小鼠骨产生的力学刺激方式密切相关[4]。下坡跑对T2DM小鼠骨产生的直接作用力通过激活TGF-β/Smads的途径及其下游靶基因Runx2和Osx表达,促进成骨前体细胞向OB分化,增加骨形成能力[28];并且,IGFs和BMP-2表达上调,Smad1/5/8磷酸化后与Smad4形成磷酸化基团入核激活下游靶基因Runx2和Osx表达,促进OB分化产生及骨形成能力[29-31]。直接作用力增强T2DM小鼠骨形成能力与脂肪细胞分泌减少的脂肪酸(FFAs)抑制ROS-ERK/P38途径,进而上调Runx2、ColA1和骨钙素等的表达有关[32]。
3.3 不同力学刺激对T2DM小鼠股骨BMD的影响
BMD是评价骨代谢的最经典指标[33],T2DM会使其显著下降[34],这方面的相关研究较多,在此不再赘述。与ZC组相比,TC组小鼠股骨松质骨和皮质骨BMD均显著下降。分析其原因可知,这与T2DM小鼠骨中TGF-β/Smad途径被抑制后骨形成能力下降,骨中Ⅰ型胶原蛋白、骨钙蛋白等有机质合成减少,钙、磷等矿物质出现沉积障碍有关[35]。运动可显著增加T2DM小鼠的BMD。Thongchote等[36]的研究发现,60 min/d、5 d/周、12周的自主跑轮运动可以显著提高T2DM小鼠股骨BMD。Frajacomo等[37]的研究也发现,与游泳组相比,抗阻训练显著提高了雄性T2DM小鼠股骨BMD。在本文中,TS组松质骨和皮质骨BMD变化不显著,说明游泳对改善T2DM小鼠BMD的作用不明显。而TD组松质骨BMD显著升高,皮质骨BMD变化不明显,说明下坡跑可以促进T2DM小鼠松质骨BMD提高,而对皮质骨作用不显著。这与运动对骨的作用影响最先表现在松质骨上有关。分析不同运动对T2DM小鼠BMD的结果差异可知,下坡跑对T2DM小鼠骨产生的直接作用力可激活TGF-β/Smad途径和BMPs/Smad途径,从而提高OB的骨形成能力,使得分泌产生的Ⅰ型胶原蛋白、骨钙蛋白(steocalcin, OCN)、骨桥蛋白(bone sialoprotein, BSP)等为钙、磷等无机质沉积提供场所,使得BMD显著增加[38-40]。直接作用力还可通过激活T2DM小鼠骨中Wnt/β-catenin信号途径[41]、抑制破骨细胞(osteoclast, OC)分化产生及其骨吸收功能[42]使BMD增加。
3.4 不同力学刺激对T2DM小鼠股骨湿重和骨形态的影响
骨湿重和骨形态大小是宏观上评价骨代谢的重要指标,T2DM骨代谢紊乱会导致骨湿重和骨形态大小显著下降[43-45]。在本文中,TC组小鼠股骨长度和湿重均显著下降,这与前人的研究结果一致,这说明T2DM会导致小鼠骨湿重和骨形态大小显著下降。这与本文中T2DM小鼠骨形成能力下降后松质骨和皮质骨BMD下降有关[46]。运动可提高骨湿重和骨形态大小,但有关其作用于T2DM小鼠的相关研究较少。在本文中,与TC组相比,TS组股骨湿重显著增加,TD组湿重、中间矢状轴宽度、远端冠状轴宽度和远端矢状轴宽度均显著升高,说明下坡跑和游泳均可显著提高股骨湿重,这是因为游泳和下坡跑均可促进T2DM小鼠骨形成,提高BMD并增加骨湿重[47]。下坡跑改善T2DM小鼠骨湿重和骨形态大小的作用优于游泳,这与直接作用力激活TGF-β/Smad途径,促进OB合成分泌Col1、OCN等有机质,利于钙、磷等矿物质沉积有关[38]。直接作用力亦可通过抑制T2DM小鼠骨中Sclerostin和Dkk1表达、激活Wnt/β-catenin途径、促进OB分化产生及骨形成能力等途径使骨湿重和骨形态大小增加[48]。
4. 结论
T2DM小鼠骨形成被显著抑制,而下坡跑对T2DM小鼠骨产生的直接作用力可通过激活TGF-β/Smad途径来提高骨形成能力,增加BMD,改善骨湿重和形态结构,且其效果优于游泳产生的间接作用力。
-
表 1 引物序列一览
Table 1 List of primer sequences
Primer名称 序列(5’ to 3’) 碱基数 Smad2-Forward 5’-CTGTGACGCATGGAAGGTCT-3’ 27 Smad2-Reverse 5’-CCACGTAGTAGACGATGGGC-3’ 26 Smad3-Forward 5’-CAGCGAGTTGGGGAGACATT-3’ 27 Smad3-Reverse 5’-TGTAAGTTCCACGGCTGCAT-3’ 26 Smad4-Forward 5’-CGATGGAATTTTACATACG-3’ 24 Smad4-Reverse 5 ’-CGCCTAAGTTGCTAGGTGG-3 ’ 24 β-actin-Forward 5’-ACCCAGAAGACTGTGGATGG-3’ 26 β-actin -Reverse 5’-TTCAGCTCAGGGATGACCTT-3’ 26 Osx-Forward 5’-GTTCACCTGTCTGCTCTGCTC-3’ 20 Osx-Reverse 5’-AGCTCCTTAGGGCCACTTGG-3’ 20 Runx2-Forward 5’-GTCCTATGACCAGTCTTACC-3’ 20 Runx2-Reverse 5’-GATGAAATGCCTGGGAACTG-3’ 20 TGF-β1-Forward 5’-AGGGCTACCATGCCAACTTC-3’ 26 TGF-β1-Reverse 5’-CCACGTAGTAGACGATGGGC-3’ 26 表 2 不同力学刺激对相关因子mRNA表达的影响
Table 2 Effects of different mechanical stimulation on factormRNA expression
mean±SD, n=6 力学刺激 ZC组 TC组 TS组 TD组 TGF-β 0.46±0.26 0.11±0.02** 0.15±0.03★ 0.20±0.07★ Smad2 3.57±1.84 1.77±0.23* 1.73±0.35 2.32±0.45★● Smad3 12.99±3.06 8.21±2.16* 8.56±2.16 9.48±1.05 Smad4 4.78±0.66 1.92±0.97** 2.70±0.69 2.73±0.49 Runx2 2.73±1.12 1.25±0.12* 1.62±0.58 2.13±0.57★★ Osx 10.69±1.95 5.69±1.07** 8.19±0.56★★ 9.71±1.32★★● 注:与ZC组相比,*表示P<0.05,**表示P<0.01;与TC组相比,★表示P<0.05,★★表示P<0.01;与TS组相比,●表示P<0.05;表 3~表 5同此 表 3 不同力学刺激对相关因子蛋白表达的影响
Table 3 Effect of different mechanical stimulations on factorprotein expression
mean±SD, n=6 力学刺激 ZC组 TC组 TS组 TD组 p-Smad2 1.25±0.28 0.71±0.15** 0.96±0.15★ 0.95±0.16★● p-Smad3 0.95±0.21 0.49±0.12* 0.67±0.12★ 0.69±0.13★● Smad4 1.46±0.47 0.83±0.31* 1.11±0.21 1.43±0.36★● 表 4 不同力学刺激对股骨BMD的影响
Table 4 Effect of different mechanical stimulations onfemur's BMD
mean±SD, n=6 项目 ZC组 TC组 TS组 TD组 松质骨 0.37 ±0.01 0.22 ±0.02** 0.26±0.04 0.33±0.02★★ 皮质骨 1.77 ±0.01 1.72 ±0.01** 1.74±0.03 1.75±0.02 表 5 不同力学刺激对股骨湿重和骨形态大小的影响
Table 5 Effects of different mechanical stimulations on boneweight and size of femur
mean±SD, n=6 项目 ZC组 TC组 TS组 TD组 股骨湿重/mg 81.67±8.19 70.67±3.78* 82.17±3.65★★ 85.5±3.45★★ 股骨长度/mm 16.89±0.51 16.22±0.25* 16.27±0.22 16.58±0.56 远端矢状轴宽度/mm 1.85±0.17 1.62±0.12* 1.74±0.16 1.97±0.11★★● 远端冠状轴宽度/mm 2.82±0.13 2.52±0.14** 2.61±0.21 2.75±0.08★★ 中间矢状轴宽度/mm 1.52±0.14 1.46±0.08 1.44±0.77 1.48±0.08★★ 中间冠状轴宽度/mm 2.35±0.31 2.21±0.38 2.09±0.08 2.04±0.11 近端矢状轴宽度/mm 1.81±0.09 1.71±0.19 1.92±0.23 1.84±0.18 近端冠状轴宽度/mm 2.32±0.12 2.26±0.11 2.28±0.32 2.33±0.18 -
[1] OLIVEIRA J M, REBUFFAT S A, GASA R, et al.Targeting type 2 diabetes:Lessons from a knockout model of insulin receptor substrate 2[J].Canadian Journal of Physiology & Pharmacology, 2014, 92(8):613-620 http://cn.bing.com/academic/profile?id=104cdaacca79fca9d4b878a117c4c7e3&encoded=0&v=paper_preview&mkt=zh-cn
[2] 黄冬梅, 陆付耳.胰岛素信号转导障碍与胰岛素抵抗的形成[J].生理科学进展, 2003, 34(3):212-216 http://www.cqvip.com/QK/90119X/200303/8529133.html [3] FREUDE T, BRAUN K F, HAUG A, et al.Hyperinsulinemia reduces osteoblast activity in vitro via upregulation of TGF-β[J].Journal of Molecular Medicine, 2012, 90(11):1257-1266 doi: 10.1007/s00109-012-0948-2
[4] 陈祥和, 李世昌, 严伟良, 等.不同方式运动对生长期雄性小鼠骨形成和骨吸收代谢影响的研究[J].西安体育学院学报, 2015, 32(2):205-211 http://www.cnki.com.cn/Article/CJFDTotal-XATY201502015.htm [5] GUSHIKEN M, KOMIYA I, UEDA S, et al.Heel bone strength is related to lifestyle factors in Okinawan men with type 2 diabetes mellitus[J].Journal of Diabetes Investigation, 2015, 6(2):150-157 doi: 10.1111/jdi.2015.6.issue-2
[6] BELLO M, SOUSA M C, NETO G, et al.The effect of a long-term, community-based exercise program on bone mineral density in post-menopausal women with pre-diabetes and type 2 diabetes[J].Journal of Human Kinetics, 2014, 43(13):43-48 http://cn.bing.com/academic/profile?id=b5eddaf0ffd728a2bf1f9888c34c78e8&encoded=0&v=paper_preview&mkt=zh-cn
[7] 赵剑. 有氧运动对2型糖尿病大鼠骨密度和骨生物力学指标的影响[D]. 上海: 上海体育学院, 2010: 15 [8] KANAZAWA I, YAMAGUCHI T, YAMAUCHI M, et al.Serum undercarboxylated osteocalcin was inversely associated with plasma glucose level and fat mass in type 2 diabetes mellitus[J].Osteoporosis International, 2011, 22(1):187-194 doi: 10.1007/s00198-010-1184-7
[9] ARYAL A C S, MIYAI K, IZU Y, et al.Nck influences preosteoblastic/osteoblastic migration and bone mass[J].Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(50):15432-15437 doi: 10.1073/pnas.1518253112
[10] SHI Y, MASSAGUE J.Mechanisms of TGF-beta signaling from cell membrane to the nucleus[J].Cell, 2003, 113(6):685-700 doi: 10.1016/S0092-8674(03)00432-X
[11] YASUI T, KADONO Y, NAKAMURA M, et al.Regulation of RANKL-induced osteoclastogenesis by TGF-beta through molecular interaction between Smad3 and Traf6[J].Journal of Bone & Mineral Research, 2011, 26(7):1447-1456 http://cn.bing.com/academic/profile?id=7ec13ed5abdb7f7f7b3da22b3d78331a&encoded=0&v=paper_preview&mkt=zh-cn
[12] GHIRALDINI B, CONTE A, CASARIN RC, et al.Influence of glycemic controlon perimplant bone healing:12-month outcomes of local release of bone-related factors and implant stabilization in type 2 diabetics[J].Clinical Implant Dentistry & Related Research, 2016, 18(4):801-809
[13] EHNERT S, FREUDE T, IHLE C, et al.Factors circulating in the blood of type 2 diabetes mellitus patients affect osteoblast maturation-description of a novel in vitro model[J].Experimental Cell Research, 2015, 332(2):247-258 doi: 10.1016/j.yexcr.2014.12.011
[14] PACIOS S, KANG J, GALICIA J, et al.Diabetes aggravates periodontitis by limiting repair through enhanced inflammation[J].FASEB Journal, 2012, 26(4):1423-1430 doi: 10.1096/fj.11-196279
[15] CASELLI A, OLSON TS, OTSURU S, et al.IGF-1-mediated osteoblastic niche expansion enhances long-term hematopoietic stem cell engraftment after murine bone marrow transplantation[J].Stem Cells, 2013, 31(10):2193-2204 doi: 10.1002/stem.1463
[16] 宋会平. 血液成分与骨组织的内在联系及组织工程学评价[D]. 广州: 南方医科大学, 2008: 36 [17] YANG T, GRAFE I, BAE Y, et al.E-selectin ligand 1 regulates bone remodeling by limiting bioactive TGF-β in the bone microenvironment[J].Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(18):7336-7341 doi: 10.1073/pnas.1219748110
[18] SHEN K, KENG YF, WU L, et al.Acquisition of a specific and potent PTP1B inhibitor from a novel combinatorial library and screening procedure[J].Journal of Biological Chemistry, 2001, 276(50):47311-47319 doi: 10.1074/jbc.M106568200
[19] 李文龙, 王晨辉, 魏传宇, 等.MKP2和MKP3抑制TGF-beta/Smad转录活性[J].科学技术与工程, 2010, 10(13):1671-1674 http://mall.cnki.net/magazine/Article/KXJS201013007.htm [20] LAVERY C A, KUROWSKA-STOLARSKA M, HOLMES W M, et al.MiR-34a-/- mice are susceptible to diet-induced obesity[J].Obesity, 2016, 24(8):1741-1751 doi: 10.1002/oby.21561
[21] WANG J M, TAO J, CHEN D D, et al.MicroRNA miR-27b rescues bone marrow-derived angiogenic cell function and accelerates wound healing in type 2 diabetes Mellitus[J].Arteriosclerosis, Thrombosis, and Vascular Biology, 2014, 34(1):99-109 doi: 10.1161/ATVBAHA.113.302104
[22] YOU L, PAN L, CHEN L, et al.MiR-27a is essential for the shift from osteogenic differentiation to adipogenic differentiation of mesenchymal stem cells in postmenopausal osteoporosis[J].Cellular Physiology and Biochemistry, 2016, 39(1):253-265 doi: 10.1159/000445621
[23] PARK J S, BAE S J, CHOI S W, et al.A novel 11beta-HSD1 inhibitor improves diabesity and osteoblast differentiation[J].Journal of Molecular Endocrinology, 2014, 52(2):191-202 doi: 10.1530/JME-13-0177
[24] 徐飞, 董永辉, 黄鑫, 等.2型糖尿病对小鼠骨代谢的影响[J].中国骨质疏松杂志, 2014, 20(3):238-241 http://mall.cnki.net/magazine/Article/YXZS200405013.htm [25] ZHANG M, SARA J D, WANG F L, et al.Increased plasma BMP-2 levels are associated with atherosclerosis burden and coronary calcification in type 2 diabetic patients[J].Cardiovascular Diabetology, 2015, 14(7):59-64 http://cn.bing.com/academic/profile?id=eb5eeb63a9034576a3b24e2dd650d568&encoded=0&v=paper_preview&mkt=zh-cn
[26] YOUN J Y, ZHOU J, CAI H.Bone morphogenic protein 4 mediates NOX1-dependent eNOS uncoupling, endothelial dysfunction, and COX2 induction in type 2 diabetes mellitus[J].Molecular Endocrinology, 2015, 29(8):1123-1133 doi: 10.1210/ME.2014-1313
[27] YU N, ZHANG Y Y, NIU X Y, et al.Evaluation of shear wave velocity and human bone morphogenetic protein-7 for the diagnosis of diabetic kidney disease[J].PLoS One, 2015, 10(3):e119713 http://cn.bing.com/academic/profile?id=75ced3f0a1e594931a5b7529220a3acc&encoded=0&v=paper_preview&mkt=zh-cn
[28] OHATA Y, OZONO K.Bone and stem cells.The mechanism of osteogenic differentiation from mesenchymal stem cell[J].Clinical Calcium, 2014, 24(4):501-508
[29] 曾伟光, 邝建, 陈亮, 等.2型糖尿病成骨细胞功能与血清IGFs水平的关系[J].广东医学, 2001, 22(12):1131-1132 doi: 10.3969/j.issn.1001-9448.2001.12.020 [30] FU C, ZHANG X, YE F, et al.High insulin levels in KK-Ay diabetic mice cause increased cortical bone mass and impaired trabecular micro-structure[J].International Journal of Molecular Sciences, 2015, 16(4):8213-8226 http://cn.bing.com/academic/profile?id=01b414f650bc4e53a76dbb99d56479f9&encoded=0&v=paper_preview&mkt=zh-cn
[31] LI J, ZHANG Y, ZHAO Q, et al.MicroRNA-10a influences osteoblast differentiation and angiogenesis by regulating beta-catenin expression[J].Cell Physiology & Biochemistry, 2015, 37(6):2194-2208 http://cn.bing.com/academic/profile?id=1b6decd9b1bd62e1a9319281666b2256&encoded=0&v=paper_preview&mkt=zh-cn
[32] DONG X, BI L, HE S, et al.FFAs-ROS-ERK/P38 pathway plays a key role in adipocyte lipotoxicity on osteoblasts in co-culture[J].Biochimie, 2014, 101(12):123-131 http://cn.bing.com/academic/profile?id=86a4dc5e3d88bac10219c5fbf8e911cb&encoded=0&v=paper_preview&mkt=zh-cn
[33] LI J, HE W, LIAO B, et al.FFA-ROS-P53-mediated mitochondrial apoptosis contributes to reduction of osteoblastogenesis and bone mass in type 2 diabetes mellitus[J].Scientific Reports, 2015, 31(5):127-135 http://cn.bing.com/academic/profile?id=3abc66c57faa9d33c635b72560748e47&encoded=0&v=paper_preview&mkt=zh-cn
[34] YAMAGUCHI T.Bone fragility in type 2 diabetes mellitus[J].World Journal of Orthopedics, 2010, 1(1):3-9 doi: 10.5312/wjo.v1.i1.3
[35] SHARP L A, LEE Y W, GOLDSTEIN A S.Effect of low-frequency pulsatile flow on expression of osteoblastic genes by bone marrow stromal cells[J].Annals of Biomedical Engineering, 2009, 37(3):445-453 doi: 10.1007/s10439-008-9632-7
[36] THONGCHOTE K, SVASTI S, TEERAPORNPUNTAKIT J, et al.Running exercise alleviates trabecular bone loss and osteopenia in hemizygous beta-globin knockout thalassemic mice[J].American Journal of Physiology Endocrinology & Metabolism, 2014, 306(12):1406-1417 https://www.researchgate.net/publication/262000837_Running_exercise_alleviates_trabecular_bone_loss_and_osteopenia_in_hemizygous_-globin_knockout_thalassemic_mice
[37] FRAJACOMO F T, FALCAI M J, FERNANDES C R, et al.Biomechanical adaptations of mice cortical bone submitted to three different exercise modalities[J].Acta Ortopedica Brasileira, 2013, 21(6):328-332 doi: 10.1590/S1413-78522013000600006
[38] LANDIM B T, BRITO V G, do AMARAL C C, et al.Osteogenic markers are reduced in bone-marrow mesenchymal and femoral bone of young spontaneously hypertensive rats[J].Life Sciences, 2016, 146(12):174-183 http://cn.bing.com/academic/profile?id=d76ea12c6dff449ff2b421feb1f15ba8&encoded=0&v=paper_preview&mkt=zh-cn
[39] 陈祥和, 李世昌, 孙朋, 等.下坡跑对生长期去卵巢小鼠骨BMP-2、Smad1/5和Runx2表达的影响[J].中国运动医学杂志, 2013, 32(7):609-614. http://cdmd.cnki.com.cn/Article/CDMD-10269-2009187235.htm [40] LI H, JIANG L S, DAI L Y.High glucose potentiates collagen synthesis and bone morphogenetic protein-2-induced early osteoblast gene expression in rat spinal ligament cells[J].Endocrinology, 2010, 151(1):63-74 doi: 10.1210/en.2009-0833
[41] 杨念恩. 不同方式运动对生长期小鼠骨合成代谢和Wnt信号通路的影响[D]. 上海: 华东师范大学, 2014: 25 [42] 陈祥和, 李世昌, 孙朋, 等.下坡跑对生长期雌性去卵巢小鼠成骨细胞分化和骨形成的影响[J].中国运动医学杂志, 2014, 33(2):130-134 http://www.cnki.com.cn/Article/CJFDTotal-YDYX201402007.htm [43] NAKAI M, COOK L, PYTER LM, et al.Dietary soy protein and isoflavones have no significant effect on bone and a potentially negative effect on the uterus of sexually mature intact Sprague-Dawley female rats[J].Menopause, 2005, 12(3):291-298 doi: 10.1097/01.GME.0000146109.50235.DO
[44] CAMERINO C, ZAYFOON M, RYMASZEWSKI M, et al.Central depletion of brain-derived neurotrophic factor in mice results in high bone mass and metabolic phenotype[J].Endocrinology, 2012, 153(11):5394-5405 doi: 10.1210/en.2012-1378
[45] BURKEMPER K M, GARRIS D R.Influences of obese (ob/ob) and diabetes (db/db)genotype mutations on lumber vertebral radiological and morphometric indices:Skeletal deformation associated with dysregulated systemic glucometabolism[J].BMC Musculoskeletal Disorders, 2006, 7(5):10-16 doi: 10.1186/1743-0003-7-3
[46] HAFEZ A, SQUIRES R, PEDRACINI A, et al.Col1α1 regulates bone microarchitecture during embryonic development[J].Journal of Developmental Biology, 2015, 3(4):158-176. doi: 10.3390/jdb3040158
[47] RUBIN M R.Bone cells and bone turnover in diabetes mellitus[J].Current Osteoporosis Reports, 2015, 13(3):186-191 doi: 10.1007/s11914-015-0265-0
[48] 吴学伦. 2型糖尿病患者血清Sclerostin和Dkk1水平与骨密度相关性研究[D]. 石家庄: 河北医科大学, 2014: 65 -
期刊类型引用(6)
1. 陈祥和,刘波,陆鹏程,孙朋,李世昌. 不同力学刺激抑制T2DM小鼠OC分化及骨吸收作用机制的比较研究. 天津体育学院学报. 2024(03): 366-372 .  百度学术
百度学术
2. 刘国辉,王帅,李宁,高瞻乐,刘思妤,周继和. 我国运动生物力学研究热点与影响力变化——基于2000—2020年体育类核心期刊文献数据. 上海体育学院学报. 2023(04): 71-82 .  百度学术
百度学术
3. 刘玉琳. 下坡行走对慢性阻塞性肺病稳定期患者心肺功能、运动能力和骨密度的影响. 四川体育科学. 2022(03): 30-34 .  百度学术
百度学术
4. 陈祥和,陆鹏程,刘波,孙朋,孙开宏. 不同力学刺激方式对T2DM小鼠骨中Notch途径及骨形成代谢的影响. 北京体育大学学报. 2021(02): 80-89 .  百度学术
百度学术
5. 张路遥. 能量代谢分子SIRT1在运动改善2型糖尿病骨代谢中的作用机制. 中国组织工程研究. 2020(02): 276-281 .  百度学术
百度学术
6. 王振,杜异凡,袁赞安,邝欢欢,位付涛. miR-146a调控TGF-β/SMAD2信号通路对膝关节韧带损伤的影响. 局解手术学杂志. 2020(12): 953-958 .  百度学术
百度学术
其他类型引用(4)




 下载:
下载: