Effects of Physical Activity on Vitamin D: A Systematic Review and Meta-analysis of Observational and Experimental Studies
-
摘要:目的 系统梳理身体活动对血液循环维生素D水平影响的观察性研究和实验性研究,为身体活动调节微量营养素代谢提供理论依据。方法 检索自数据库建立至2020年11月30日PubMed、Embase、Cochrane Library、中国知网等数据库中的观察性研究和实验性研究。根据纳入和排除标准筛选文献,并进行meta分析和系统综述。结果 共纳入74篇文献,包括51篇观察性研究和23篇实验性研究。观察性研究meta分析结果显示,较高的身体活动水平与较低的维生素D缺乏风险显著相关。亚组分析结果表明:室外身体活动会显著降低维生素D缺乏风险,但室内身体活动无该效应;较高强度的身体活动与较低的维生素D缺乏风险显著相关,但低强度身体活动与之无相关性;不同季节身体活动均与较低的维生素D缺乏风险显著相关。实验性研究结果表明,急性运动和长期运动训练均可显著提高血液循环25-羟维生素D [25(OH)D]水平;亚组分析结果显示,耐力训练和抗阻联合耐力训练均能显著提高血清25(OH)D水平,但抗阻训练并无显著性效应。结论 身体活动水平与血液循环维生素D水平之间呈显著正相关,且运动干预对血液循环维生素D营养状态具有有益作用。
-
关键词:
- 运动 /
- 身体活动 /
- 25-羟维生素D[25(OH) D] /
- meta分析
Abstract:Objective To make a systematic review with meta-analysis on the effects of physical activity/exercise on vitamin D, and provide a theoretical evidence of regulating the micro-nutrients based on the observational and experimental studies.Methods Databases such as PubMed, Embase, Cochrane Library, and CNKI were searched for observational studies and experimental studies as of November 30, 2020. Literatures were screened according to the inclusion and exclusion criteria, and were systematically reviewed with meta-analysis.Results 74 studies were eligible, including 51 observational studies and 23 experimental studies. The result of observational studies showed that there was a significant positive correlation between total physical activity and 25(OH) D level. Subgroup analysis showed that outdoor physical activity could significantly reduce the risk of vitamin D deficiency, but not for indoor physical activity; physical activity with high intensity could reduce the risk of vitamin D deficiency, but not for low physical activity; physical activity in different seasons could significantly reduce the risk of vitamin D deficiency. The result of experimental studies reports both acute exercise intervention and chronic exercise intervention could improve serum 25(OH) D level. Subgroup analysis showed that endurance training and endurance combined with resistance training could increase serum 25(OH) D level, but not for resistance training.Conclusion There is a significant positive correlation between physical activity and serum vitamin D level, and exercise intervention has a beneficial effect on the nutritional status of circulating vitamin D.-
Keywords:
- exercise /
- physical activity /
- 25 (OH) D /
- meta-analysis
-
近年来,随着对维生素D相关研究的不断深入,在越来越多的身体组织中发现了维生素D受体的存在。研究[1-3]表明,维生素D的生物学作用已超出传统范围,在细胞增殖和分化、内分泌及免疫功能调节、抗肿瘤治疗、能量代谢、氧化应激和体适能维持与提高等方面都起着重要作用。
人体90%以上的维生素D依靠皮肤在紫外线的照射下合成[4-5],一般认为阳光暴露即可满足人体对维生素D的需求,但调查研究[6-7]发现,维生素D缺乏已成为一个普遍存在的全球公共卫生问题。即使是阳光充足的印度[8]、沙特阿拉伯[9]和巴西[10]等国家,由于饮食、文化等因素的影响,人们也存在维生素D缺乏现象。维生素D缺乏与多种慢性非传染性疾病[11]和系统功能紊乱,如2型糖尿病[1]、胰岛素抵抗[12]、代谢综合征[13]、心血管疾病风险[3, 14]等密切相关。因此,维持良好的维生素D营养状态对人体健康具有重要意义。
近年调查研究发现,身体活动不足或运动缺乏不仅是导致慢性非传染性疾病发病和死亡的重要危险因素[15],也是维生素D缺乏的一个重要危险因素[16]。多项观察性研究发现,身体活动水平与维生素D水平呈正相关[17-18],且有学者指出,身体活动防治冠心病等慢性非传染性疾病的部分原因正是由于其提高了维生素D水平[17]。但一些学者推测,身体活动影响维生素D水平的原因是进行身体活动的同时间接增加了阳光暴露。目前有多项研究探讨了在排除阳光暴露等混杂因素后,身体活动水平与血液循环维生素D水平之间的关系,但各研究结果并不一致,有的认为校正阳光暴露因素后,身体活动水平与血液循环维生素D水平之间仍然存在正相关关系[19];但也有研究[20]发现,校正阳光暴露因素后身体活动水平与血液循环维生素D水平无关。相关的实验性研究[21-24]也没有得出一致性结论。
本文从观察性研究和实验性研究2个方面进行系统综述和meta分析,探讨身体活动对血液循环维生素D水平的影响,厘清在不同场所、强度、季节条件下身体活动与血液循环维生素D水平之间的关系,以期为运动调节微量营养素代谢提供科学依据,为改善维生素D缺乏的运动营养干预决策提供参考。
1. 研究方法
1.1 文献来源与检索
本文遵循系统评价和meta分析优先报告条目(Preferred Reporting Items for Systematic Reviews and Meta-Analyses,PRISMA)标准[25],并在PROSPERO平台注册(注册号:CRD42020187163)。在PubMed(Mesh词和自由词)、Embase(Mesh词和自由词)、Cochrane Library(主题词)、中国知网(主题词+同义词扩展)、维普网(主题词+同义词扩展)和万方数据知识服务平台(主题词+同义词扩展)数据库检索探究身体活动与维生素D关系的观察性研究和探究运动干预对维生素D影响的实验性研究。检索时间范围为数据库建立至2020年11月30日。25-羟维生素D[25-hydroxyvitamin D,25(OH)D]是维生素D在人体血液循环中含量最多且最稳定的一种形式,血清25(OH)D水平被用于评价人体的维生素D营养状态,因此,本文将血液循环中25(OH)D3、25(OH)D2、25(OH)D水平作为实验性研究的结局指标,将身体活动与其相关性指标作为观察性研究的结局指标。检索到的文献依次通过查重及标题、摘要筛选,然后提取全文进行评估,最后追踪筛查出的文献的参考文献以补充电子文献库检索的遗漏。
1.2 文献筛选
先由2名研究者根据文献纳入和排除标准对文献进行独立筛选,并进行比对,如遇分歧,征询第3名研究者的意见。纳入标准:①实验性研究,干预方式为运动,结局指标为血液循环25(OH)D水平;观察性研究,以身体活动为自变量、25(OH)D为因变量探究身体活动与血液循环25(OH)D水平之间的关系。②研究对象为人体的研究。③英文或中文文献。排除标准:①实验性研究,运动干预措施不详,缺乏对照组;观察性研究,相同数据来源的重复分析研究、病例研究和病例对照研究。②数据不完整、质量不高的研究。
1.3 数据提取和质量评估
由1名研究者按照拟定方案对纳入的研究进行数据提取,并进行质量评分,然后由另1名研究者进行复核。对于观察性研究,提取的基本信息包括第一作者、发表年份、地区、数据来源、人群特点、身体活动测量方式、统计学方法、混杂因素和关联系数/效应大小。对于实验性研究,提取的基本资料包括第一作者、发表年份、研究设计、研究对象(性别、年龄等)、样本量、干预措施、干预周期和结局指标。根据Kmet等[26]制定的研究质量评价清单,采用评分的方式[“是”=2,“部分”=1,“否”=0(不适用);总分=“是”数量×2+“部分”数量/(28-“不适用”数量×2)×100]对所纳入的文献进行质量评价。
1.4 统计学分析
如果2篇文献来源于同一项干预研究或横断面研究,纳入质量最高的1篇文献。若文献数量达不到meta分析要求(如提取不到相关数据,相关研究数量较少),则仅进行系统综述。对观察性研究,从探讨身体活动与血液循环维生素D水平之间关系的角度进行系统综述和meta分析;对实验性研究,从急性运动干预研究和长期运动干预研究2个方面分别进行系统综述和meta分析。在观察性研究中,采用四格表将身体活动不足与维生素D缺乏和身体活动充足与维生素D充足的比值比(Odds Ratio,OR)转换为身体活动充足与维生素D缺乏的OR,应用Woolf法计算OR的95%置信区间(95% Confidence Interval,95%CI)[27]。Woolf法计算方式为:
$$ \text { OR } 95 \% \mathrm{CI}=\mathrm{ORe}^{\pm 1.96 \sqrt{\frac{1}{a}+\frac{1}{b}+\frac{1}{c}+\frac{1}{d}}} $$ (1) 其中:OR表示比值比;95%CI表示95%置信区间,e表示自然对数的底数;a表示暴露病例数,b表示非暴露病例数,c表示暴露对照例数,d表示非暴露对照例数。
采用STATA 14软件进行meta分析。各研究具有同质性时使用固定效应模型;具有异质性(I2 > 50%,P < 0.10)时通过meta回归、亚组分析、敏感性分析及发表偏倚判断异质性来源,找不到异质性的明确原因时采用随机效应模型。基于Egger检验评价研究的发表偏倚风险,若截距线段横跨0点线则发表偏倚风险较低,若不与0点线相交则具有明显的发表偏倚风险[28]。通过影响分析检测meta分析的敏感性,即通过逐个剔除纳入的研究对剩余的研究重新进行meta分析,并把新的合并效应量与总的合并效应量进行比较,查看剔除前后结果有无变化。
2. 结果
2.1 文献检索及纳入结果
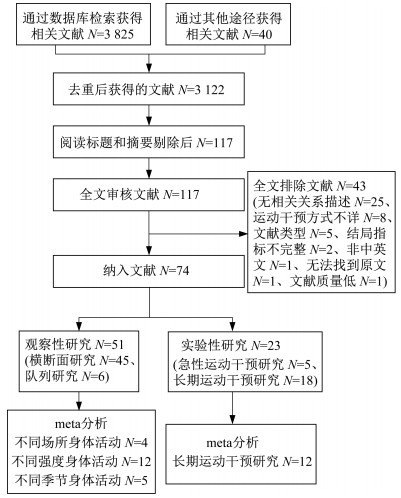
为防止漏检,英文文献检索使用主题词+自由词的方式,中文文献检索使用主题词+同义词扩展的方式,共检索到3 825篇文献,此外,追踪筛查出的文献的参考文献,获得相关文献40篇。利用EndNote X9文献管理软件进行查重,剔除重复文献706篇;通过阅读标题和摘要的方式剔除3 005篇;阅读全文剔除43篇。最终纳入74篇文献。文献筛选流程见图 1。
2.2 纳入文献的基本信息
观察性研究共51篇,其中包括45篇横断面研究、6篇队列研究;急性运动干预研究共5篇,受试者均为身体运动活跃的健康人群;长期运动干预研究共18篇,其中13篇为随机对照试验。
2.3 观察性研究:身体活动与血液循环维生素D水平的相关性
本文从身体活动的场所(室内、室外)、强度(低、中、高强度)和季节(冬春和夏秋)等角度探讨身体活动与血液循环维生素D水平/缺乏之间的关系。
2.3.1 不同场所身体活动与血液循环维生素D水平的关系
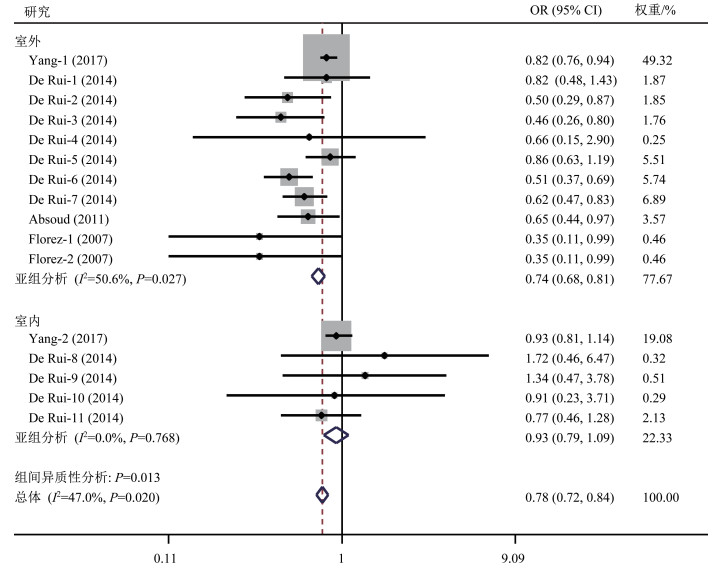
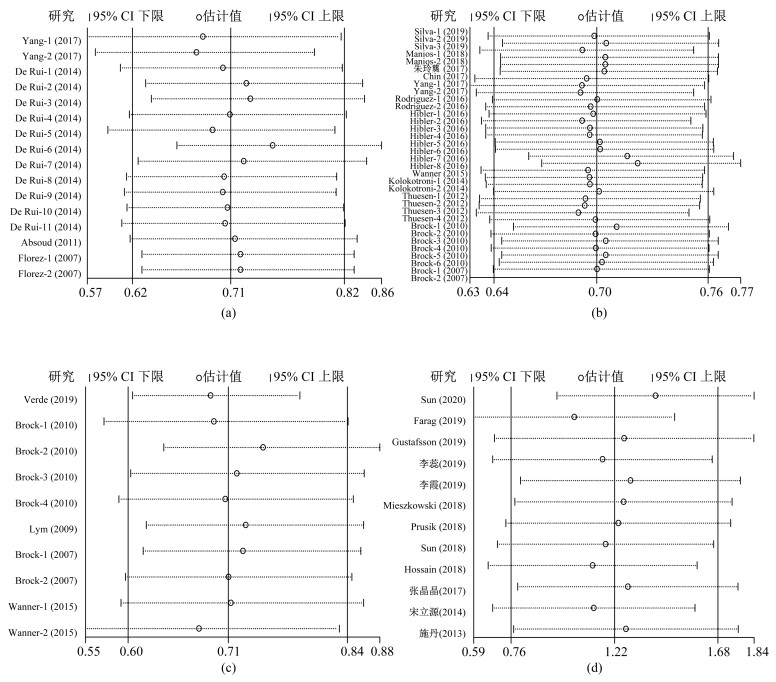
在针对身体活动与维生素D关系的调查研究中,明确区分活动场所的研究共10篇[18, 29-37],其中6篇[18, 29, 32, 34, 36-37]不符合meta分析纳入标准,仅对其进行系统综述,符合meta分析纳入标准的研究共4篇[30-31, 33, 35],均包括室外身体活动研究,其中2篇[30-31]同时包括室内身体活动研究。异质性检验结果显示,各研究间不存在异质性(I2=47.0%,P=0.020),因此采用固定效应模型分析。meta分析结果(图 2)显示,较高的身体活动水平与较低的维生素D缺乏风险显著相关(合并效应量OR=0.78,95%CI 0.72~0.84,P<0.001)。亚组分析结果显示,较高的室外身体活动与较低的维生素D缺乏风险显著相关(合并效应量OR=0.74,95%CI 0.68~0.81,P<0.001);但室内身体活动与维生素D缺乏风险无关(合并效应量OR=0.93,95%CI 0.79~1.09,P=0.361)。结果表明,总体身体活动和室外身体活动可以显著提高25(OH)D水平,降低维生素D缺乏风险,但室内身体活动并无该效应。
![]() 图 2 不同场所身体活动与维生素D缺乏风险关系的森林图注:各研究作者后的数字表示该研究中的亚组,其中Yang-1、Yang-2分别表示室外身体活动和室内身体活动亚组,De Rui-1、De Rui-2、De Rui-3、De Rui-4、De Rui-5、De Rui-6、De Rui-7、De Rui-8、De Rui-9、De Rui-10、De Rui-11分别表示男性室外快走、男性室外骑行、男性室外园艺、男性室外垂钓、女性室外快走、女性室外骑行、女性室外园艺、男性室内舞蹈、男性体育馆运动、女性室内舞蹈、女性体育馆运动亚组,Florez-1和Florez-1分别表示西班牙裔白人室外身体活动和非西班牙裔白人室外身体活动亚组;OR表示比值比,95%CI表示95%置信区间。Figure 2. Forest plot displaying the effect of physical activity in different venues on vitamin D
图 2 不同场所身体活动与维生素D缺乏风险关系的森林图注:各研究作者后的数字表示该研究中的亚组,其中Yang-1、Yang-2分别表示室外身体活动和室内身体活动亚组,De Rui-1、De Rui-2、De Rui-3、De Rui-4、De Rui-5、De Rui-6、De Rui-7、De Rui-8、De Rui-9、De Rui-10、De Rui-11分别表示男性室外快走、男性室外骑行、男性室外园艺、男性室外垂钓、女性室外快走、女性室外骑行、女性室外园艺、男性室内舞蹈、男性体育馆运动、女性室内舞蹈、女性体育馆运动亚组,Florez-1和Florez-1分别表示西班牙裔白人室外身体活动和非西班牙裔白人室外身体活动亚组;OR表示比值比,95%CI表示95%置信区间。Figure 2. Forest plot displaying the effect of physical activity in different venues on vitamin D在未纳入meta分析的不同场所身体活动对维生素D影响的研究中,钱素凤等[29]和Scragg等[18]发现,室外身体活动者血液循环25(OH)D水平显著高于室内身体活动者。Van Dam等[36]在校正季节等混杂因素后发现,室外身体活动每增加1 h/d,血液循环25(OH)D水平将增加1.8 nmol/L。Black等[37]对澳大利亚青少年进行前瞻性研究发现,与室外身体活动<1次/周相比,室外身体活动为1~3次/周和≥4次/周与血液循环25(OH)D水平呈显著正相关,回归系数(regression coefficient,β)分别为5和10.3。Van Den Heuvel等[32]的研究结果显示,室外身体活动中骑行、庭院身体活动与血液循环25(OH)D水平呈显著正相关,而室外步行与25(OH)D水平无显著相关关系。
2.3.2 不同强度身体活动与血液循环维生素D水平的关系
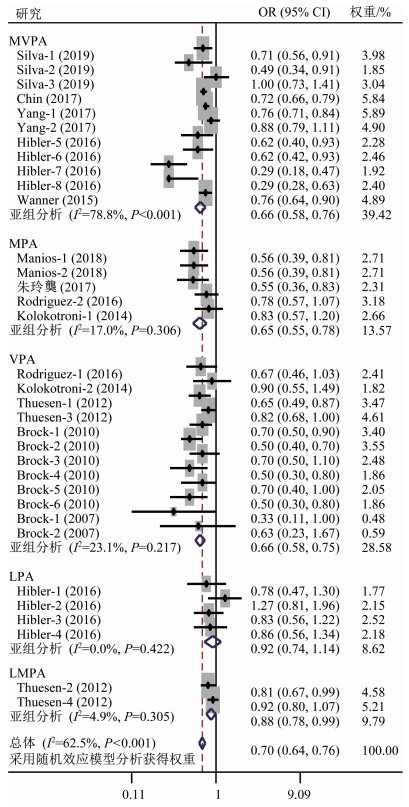
在针对身体活动与维生素D关系的调查研究中,明确区分不同身体活动强度的研究共20篇[10, 17-18, 30, 38-53],其中8篇[17-18, 38, 46-47, 51-53]不符合meta分析纳入标准,对其进行系统综述。符合meta分析纳入标准的研究共12篇[10, 30, 39-45, 48-50],其中,中高强度身体活动5篇[10, 30, 41, 43-44]、中等强度身体活动4篇[39-40, 42, 45]、高强度身体活动5篇[42, 45, 48-50]、低强度身体活动1篇[43]、低中强度身体活动1篇[48]。异质性检验结果显示,各研究间存在异质性(I2=62.5%,P<0.001),选用随机效应模型分析。meta分析结果(图 3)显示,较高的身体活动水平与较低的维生素D缺乏风险显著相关(合并效应量OR=0.70,95%CI 0.64~0.76,P<0.001)。亚组分析结果显示,较高的中高强度身体活动、中等强度身体活动、高强度身体活动和低中强度身体活动均与较低的维生素D缺乏风险相关(合并效应量OR=0.66,95%CI 0.58~0.76,P<0.001;OR=0.65,95%CI 0.55~0.78,P<0.001;OR=0.66,95%CI 0.58~0.75,P<0.001;OR=0.88,95%CI 0.78~0.99,P=0.034)。但较高的低强度身体活动与较低的维生素D缺乏风险无关(合并效应量OR=0.92,95%CI 0.74~1.14,P=0.450)。提示中高强度身体活动可能有助于提高维生素D水平,降低维生素D缺乏风险,但低强度身体活动并无该效应。
![]() 图 3 不同强度身体活动与维生素D缺乏风险关系的森林图注:各研究作者后的数字表示该研究中的亚组,其中:Silva-1、Silva-2和Silva-3分别表示总体、男性和女性MVPA;Yang-1和Yang-2分别表示2001—2006年MVPA和2007—2010年MVPA;Hibler-1、Hibler-2、Hibler-5、Hibler-7分别表示当25(OH)D<50 nmol/L时5.5 h/d LPA、3.2 h/d LPA、1.4 h/d MVPA、3.3 h/d MVPA,Hibler-3、Hibler-4、Hibler-6和Hibler-8分别表示当25(OH)D<75 nmol/L时5.5 h/d LPA、3.2 h/d LPA、1.4 h/d MVPA、3.3 h/d MVPA;Manios-1和Manios-2分别表示30~59.9 min/d MPA和>60 min/d MPA;Rodriguez-1和Rodriguez-2分别表示VPA和MPA;Kolokotroni-1和Kolokotroni-2分别表示MPA和VPA;Thuesen-1和Thuesen-2分别表示缺乏标准为25(OH)D<25 nmol/L时VPA和LMPA,Thuesen-3和Thuesen-4分别表示缺乏标准为25(OH)D<50 nmol/L时VPA和LMPA;Brock-1(2010)、Brock-2(2010)、Brock-3(2010)、Brock-4(2010)、Brock-5(2010)、Brock-6(2010)分别表示总体(男/女)每周VPA<3 h、总体(男/女)每周VPA≥3 h、女性每周VPA<3 h、女性每周VPA≥3 h、男性每周VPA<3 h、男性每周VPA≥3 h;Brock-1(2007)和Brock-2(2007)分别表示越南裔VPA和澳大利亚裔/英国裔VPA;MVPA表示中高强度身体活动,MPA表示中等强度身体活动,VPA表示高强度身体活动,LPA表示低强度身体活动,LMPA表示低中强度身体活动;OR表示比值比,95%CI表示95%置信区间。Figure 3. Forest plot displaying the effect of physical activity with different intensity on vitamin D
图 3 不同强度身体活动与维生素D缺乏风险关系的森林图注:各研究作者后的数字表示该研究中的亚组,其中:Silva-1、Silva-2和Silva-3分别表示总体、男性和女性MVPA;Yang-1和Yang-2分别表示2001—2006年MVPA和2007—2010年MVPA;Hibler-1、Hibler-2、Hibler-5、Hibler-7分别表示当25(OH)D<50 nmol/L时5.5 h/d LPA、3.2 h/d LPA、1.4 h/d MVPA、3.3 h/d MVPA,Hibler-3、Hibler-4、Hibler-6和Hibler-8分别表示当25(OH)D<75 nmol/L时5.5 h/d LPA、3.2 h/d LPA、1.4 h/d MVPA、3.3 h/d MVPA;Manios-1和Manios-2分别表示30~59.9 min/d MPA和>60 min/d MPA;Rodriguez-1和Rodriguez-2分别表示VPA和MPA;Kolokotroni-1和Kolokotroni-2分别表示MPA和VPA;Thuesen-1和Thuesen-2分别表示缺乏标准为25(OH)D<25 nmol/L时VPA和LMPA,Thuesen-3和Thuesen-4分别表示缺乏标准为25(OH)D<50 nmol/L时VPA和LMPA;Brock-1(2010)、Brock-2(2010)、Brock-3(2010)、Brock-4(2010)、Brock-5(2010)、Brock-6(2010)分别表示总体(男/女)每周VPA<3 h、总体(男/女)每周VPA≥3 h、女性每周VPA<3 h、女性每周VPA≥3 h、男性每周VPA<3 h、男性每周VPA≥3 h;Brock-1(2007)和Brock-2(2007)分别表示越南裔VPA和澳大利亚裔/英国裔VPA;MVPA表示中高强度身体活动,MPA表示中等强度身体活动,VPA表示高强度身体活动,LPA表示低强度身体活动,LMPA表示低中强度身体活动;OR表示比值比,95%CI表示95%置信区间。Figure 3. Forest plot displaying the effect of physical activity with different intensity on vitamin D在未纳入meta分析的不同强度身体活动对维生素D影响的研究中,Scragg等[17]在校正年龄和季节后发现,进行高强度身体活动的成年男性血液循环25(OH)D浓度比不进行者平均高4.8 nmol/L。Scragg等[18]还发现,与无休闲身体活动者相比,高强度休闲身体活动工人的血液循环25(OH)D水平显著更高。Choi[47]研究发现,成年男女中等和高强度身体活动均与血液循环25(OH)D水平呈正相关。在儿童人群中,Jones等[51]发现澳大利亚男童高强度身体活动与血液循环25(OH)D水平具有显著正相关关系,低强度身体活动与血液循环25(OH)D水平无关。Hall等[52]的事后分析结果显示,美国妇女在产后第1个月,校正种族、体质量指数、纯母乳喂养、能量消耗后,中等强度身体活动总时长与血清25(OH)D水平呈显著正相关,并且每周延长中等强度身体活动2.5 h,血清25(OH)D浓度将增加7.23 nmol/L;在产后第4个月,校正维生素D补充和阳光暴露后,每周延长中等强度身体活动1.5 h,血清25(OH)D浓度将增加11.73 nmol/L;只有在产后第7个月,中等强度身体活动与血清25(OH)D水平之间无显著关系。Skender等[53]对大肠癌患者的纵向研究发现,中高强度和高强度身体活动均与25(OH)D3水平呈显著正相关。但Nadeem Saqib等[38]的研究表明,维生素D充足和不足的巴基斯坦人身体活动强度无显著性差异。Valtueña等[46]的研究也表明,维生素D充足和不足的西班牙青少年高强度身体活动时长无显著性差异。Choi[47]的研究还发现,成年女性低强度身体活动与血液循环25(OH)D水平呈显著正相关,但男性无此相关性。
2.3.3 不同季节身体活动与血液循环维生素D水平的关系
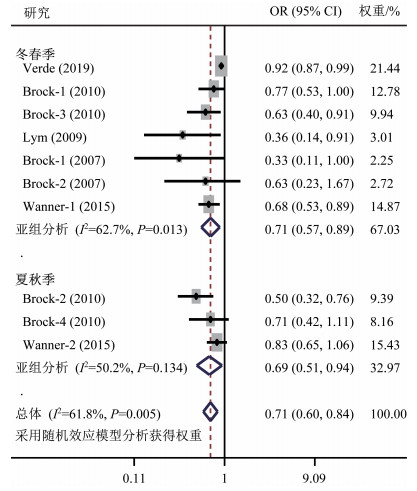
在针对身体活动与维生素D关系的调查研究中,明确区分不同季节的研究共12篇[9, 20, 44, 50, 54-61],其中7篇[9, 20, 54, 56-58, 61]不符合meta分析纳入标准,对其进行系统综述。因为夏秋季属于高日照季节,冬春季属于低日照季节[16],因此季节以夏秋季和冬春季划分。符合meta分析的研究共5篇[44, 50, 55, 59-60],均包括冬春季,其中2篇[44, 59]同时包括夏秋季。异质性检验结果显示,各研究间存在异质性(I2=61.8%,P=0.005),选用随机效应模型分析。meta分析结果(图 4)显示,较高的身体活动水平与较低的维生素D缺乏风险显著相关(合并效应量OR=0.71,95%CI 0.60~0.84,P<0.001)。亚组分析结果显示,无论冬春季还是夏秋季,较高的身体活动水平均与较低的维生素缺乏风险显著相关(合并效应量OR=0.71,95%CI 0.57~0.89,P=0.003;OR=0.69,95%CI 0.51~0.94,P=0.019)。提示冬春季和夏秋季进行身体活动均可能有助于提高维生素D水平,降低维生素D缺乏风险。
![]() 图 4 不同季节身体活动与维生素D缺乏风险关系的森林图注:各研究作者后的数字表示该研究中的亚组,其中:Brock-1(2010)、Brock-2(2010)、Brock-3(2010)和Brock-4(2010)分别表示冬春季进行身体活动、夏秋季进行身体活动、冬春季进行重体力劳动和夏秋季进行重体力劳动;Brock-1(2007)和Brock-2(2007)分别表示冬春季越南裔进行身体活动和冬春季澳大利亚裔/英国裔进行身体活动;Wanner-1和Wanner-2分别表示冬春季进行身体活动和夏秋季进行身体活动;OR表示比值比,95%CI表示95%置信区间。Figure 4. Forest plot displaying the effect of physical activity in different seasons on vitamin D
图 4 不同季节身体活动与维生素D缺乏风险关系的森林图注:各研究作者后的数字表示该研究中的亚组,其中:Brock-1(2010)、Brock-2(2010)、Brock-3(2010)和Brock-4(2010)分别表示冬春季进行身体活动、夏秋季进行身体活动、冬春季进行重体力劳动和夏秋季进行重体力劳动;Brock-1(2007)和Brock-2(2007)分别表示冬春季越南裔进行身体活动和冬春季澳大利亚裔/英国裔进行身体活动;Wanner-1和Wanner-2分别表示冬春季进行身体活动和夏秋季进行身体活动;OR表示比值比,95%CI表示95%置信区间。Figure 4. Forest plot displaying the effect of physical activity in different seasons on vitamin D在未纳入meta分析的不同季节身体活动对维生素D影响的研究中,Orces[54]研究发现,冬春季、夏秋季和全年中高强度身体活动充足的美国成年人血液循环25(OH)D水平和25(OH)D3水平均显著高于活动不足者。Mortensen等[56]对丹麦儿童在9—10月(秋季)进行调查发现,相比不活跃的儿童,每周进行6~7 h中高强度身体活动的儿童血液循环25(OH)D浓度显著增加5.6 nmo/L。Al-Othman等[9]在夏季对沙特阿拉伯儿童青少年进行调查发现,身体活动中等活跃者和活跃者血液循环25(OH)D水平显著高于不活跃者。Foo等[61]在4月(春季)对北京青春期女性进行调查发现,在未校正模型和校正发育阶段、身体活动参数、饮食钙磷摄入的模型中,总体身体活动水平、参加体育运动与血液循环25(OH)D水平均具有显著正相关关系。Kluczynski等[20]研究发现,绝经妇女全年休闲身体活动和庭院工作与血液循环25(OH)D水平呈显著正相关,但校正年龄、维生素D摄入、阳光暴露、腰围和季节等混杂因素后该显著相关性均消失;在校正年龄模型和校正年龄、维生素D摄入、阳光暴露、季节模型中,夏秋季休闲性身体活动和庭院工作均与血液循环25(OH)D水平呈显著性相关,但冬春季均无显著性。Klenk等[57]研究发现,德国老年人冬、春和秋季的步行时长与血液循环25(OH)D水平存在显著的剂量效应关系,血液循环25(OH)D水平虽在夏季最高,但与步行时长无关。Voipio等[58]研究发现,总体(男性和女性)、男性和女性成年人的秋冬季身体活动量(MET-h/周)与血清25(OH)D水平、维生素D缺乏均无显著相关性。
2.3.4 总体身体活动水平与血液循环维生素D水平的关系
在观察性研究中,除不同场所、强度和季节的研究外,还有探究总体身体活动水平(身体活动总量、频率等)与维生素D水平或缺乏关系的研究共13篇[16, 19, 34, 62-72],均不符合meta分析纳入标准。Scott等[19]对澳大利亚50~79岁人群的前瞻性队列研究发现,在校正年龄、基线血液循环25(OH)D水平、采样季节、维生素D补充、阳光暴露后,身体活动量(每天1 000步)与Δ25(OH)D呈显著正相关关系。Palaniswamy等[16]研究发现,相比进行Q4(>22.0 MET-h/周)身体活动者,进行Q1(0~3.79 MET-h/周)、Q2(3.80~11.29 MET-h/周)、Q3(11.30~21.99 MET-h/周)身体活动的31岁成年人维生素D缺乏的风险显著增加。陈亚军等[66]研究发现,较少运动(每周运动<3 d、每周总运动时长<120 min)的糖尿病患者血液循环25(OH)D水平显著低于经常运动者(每周运动≥3 d,每周总运动时长≥120 min)。马雯娟等[62]研究发现,健康成年人每周运动≥3次可以显著降低维生素D缺乏风险。Scragg等[34]研究发现,中高强度身体活动频率与Δ25(OH)D水平呈显著相关关系,但校正年龄、性别、种族、体质量指数、采样月份、奶制品摄入、谷物摄入、维生素D补充等混杂因素后,中高强度身体活动频率与Δ25(OH)D的关系不再具有显著性。Soininen等[63]研究发现,6~8岁儿童进行1.5~2.1 h/d和>2.2 h/d的身体活动将显著降低血清25(OH)D浓度低于50 nmol/L的风险。De Touvier等[68]研究发现,≥1 h/d步行当量的活动可以显著降低维生素D缺乏[25(OH)D水平≤10 ng/mL]和不足[10 ng/mL<25(OH)D水平≤20 ng/mL]的风险,但<1 h/d步行当量的活动则对维生素D水平无显著性影响。Al-Eisa等[64]调查研究发现,身体活动得分与血液循环25(OH)D水平呈显著正相关。Mckibben等[72]的纵向研究发现,白人和黑人的身体活动指数与维生素D缺乏呈显著相关性。Berger等[71]、Hintzpeter等[70]、Mckibben等[72]、Raczkiewicz等[65]和Jungert等[67]均发现,身体活动水平与维生素D水平呈显著正相关。Bener等[69]研究发现,维生素D缺乏和充足的卡塔尔儿童青少年中,进行身体活动者和无身体活动者的比例具有显著性差异。
2.4 急性运动干预对血液循环维生素D水平的影响
共有5篇研究探究急性运动干预对维生素D的影响[73-77],受试者均为身体活跃者,但均不符合meta分析纳入标准。Mieszkowski等[73]对超级马拉松业余运动员进行一次超级马拉松运动干预后发现,与运动前24 h相比,维生素D3补充组和安慰剂组运动后即刻和24 h的25(OH)D3水平均显著增高,而25(OH)D2水平在2组间无显著性差异;与安慰剂组相比,维生素D3补充组25(OH)D3水平显著增高,25(OH)D2水平无显著性差异。Sun等[74]对20名日本成年人进行急性耐力运动(强度为最大摄氧量的70%)干预研究发现,与基线相比,运动后即刻、1 h、3 h、24 h血液循环25(OH)D水平均显著升高;且血液循环25(OH)D水平的变化存在性别和时间交互效应,男性血液循环25(OH)D水平在运动后即刻、1 h、3 h均显著升高,男性血液循环25(OH)D水平的曲线下面积显著高于女性。Barker等[75]对14名成年人进行一侧下肢急性抗阻训练、另一侧休息的研究发现,与运动前相比,运动后即刻血液循环25(OH)D水平显著增加,随后逐渐降低,至运动后1 h恢复至运动前水平。Maïmoun等[76]对身体活跃的老年人、身体中等活跃的老年人和身体活跃的青年人进行急性最大递增跑台运动后发现,仅身体活跃的老年人血液循环25(OH)D水平显著降低。Maïmoun等[77]的另一项研究对7名男性公路自行车运动员进行强度高于通气阈15%和低于通气阈15%的运动干预后发现,血液循环25(OH)D浓度和1,25(OH)2D浓度均无显著性变化。
2.5 长期运动干预对血液循环维生素D水平的影响
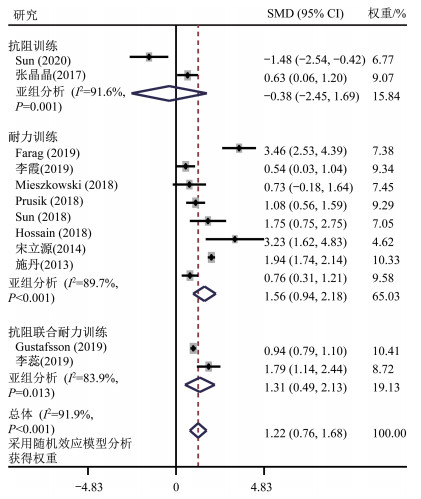
共有18篇研究探究长期运动干预对维生素D的影响,其中6篇[24, 78-82]不符合meta分析纳入标准,对其进行系统综述。符合meta分析纳入标准的研究共12篇[21-23, 83-91],受试者共1 720名,其中抗阻训练2篇,耐力训练8篇,抗阻联合耐力训练2篇。异质性检验结果显示,各研究间存在异质性(I2=91.9%,P < 0.001),采用随机效应模型进行meta分析。meta分析结果(图 5)显示,运动可以显著提高血清25(OH)D浓度[合并效应量标准化均数差(Standardized Mean Difference,SMD)=1.22,95%CI 0.76~1.68,P<0.001]。以干预方式进行亚组分析,结果表明,抗阻训练、耐力训练、抗阻联合耐力训练的合并效应量SMD分别为-0.38(95%CI-2.45~1.69,P=0.722)、1.56(95%CI 0.94~2.18,P<0.001)、1.31(95%CI 0.49~2.13,P=0.002)。可见耐力训练、抗阻联合耐力训练可有效提高血清25(OH)D水平。
在未纳入meta分析的探究长期运动干预对维生素D影响的研究中,Klausen等[81]研究发现,与常规训练相比,马拉松运动员在停训3周后恢复训练的第4周1,25(OH)2D水平显著降低,但血液循环25(OH)D水平无显著性变化。Pilch等[78]在深秋季节、室外对绝经后肥胖女性于早晨进行6周的北欧式健步走(运动强度为最大摄氧量的38%~50%)干预发现,干预后血清25(OH)D水平显著降低(P<0.05),但1 a后随访时血液循环25(OH)D水平与干预前无显著性差异。Evans等[80]对成年人进行为期4个月的军事训练发现,男性的血液循环25(OH)D水平显著降低(P=0.007),女性无显著性变化。Lithgow等[24]对超重/肥胖成年人进行为期6周的高强度间歇训练发现,血液循环25(OH)D水平无显著性改变。3项研究[24, 78, 81]均与meta分析中耐力训练可以提高血清25(OH)D水平的结果不一致。Agergaard等[79]研究发现:健康久坐青年人进行抗阻训练0、2、6、12周后血液循环25(OH)D水平均显著低于基线(运动干预前4周,维生素D补充干预开始时间点)水平,并且在进行抗阻训练6、12周时血液循环25(OH)D水平显著低于抗阻训练联合维生素D干预组;而健康久坐老年人进行抗阻训练干预0、6、12周后血液循环25(OH)D水平均显著低于基线水平,在0、2、6、12周均低于抗阻训练联合维生素D干预组。该研究结果表明,抗阻训练并不能提高血液循环维生素D水平,与meta分析结果一致。Moradi等[82]研究发现,自闭症儿童进行为期12周的知觉训练(双脚跳、单脚跳、动静平衡训练、踢球、投球、投接球)后,血清25(OH)D水平无显著性变化。
2.6 发表偏倚和异质性分析
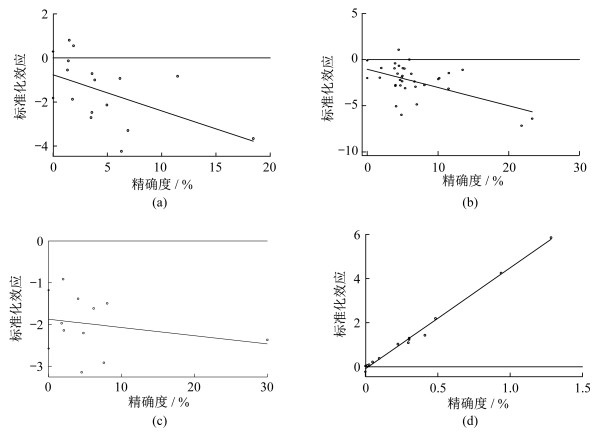
不同场所(95%CI-1.82~0.29,t=-1.55,P=0.143)、不同季节(95%CI-0.09~0.05,t=-0.69,P=0.510)的身体活动与维生素D缺乏风险关系和长期运动干预与维生素D水平关系(95%CI-0.22~0.04,t=-1.60,P=0.140)的95%CI均包含0,说明存在发表偏倚的可能性较小,meta分析结果比较稳健,发表偏倚不是其异质性来源;不同强度(95%CI-2.00~-0.11,t=-2.27,P=0.030)的身体活动与维生素D缺乏风险关系的95%CI不包含0,说明存在发表偏倚,且差异有统计学意义,发表偏倚可能是其异质性来源。见图 6。
为避免出现假阳性结果,进行单因素meta回归分析[92]。对可能影响不同强度身体活动与维生素D缺乏风险关系的因素进行meta回归分析,结果如表 1所示,发表年份、人群、国家/地区、数据来源、维生素D切点、阳光暴露均不是其异质性来源(P均>0.05)。将可能影响不同季节身体活动与维生素D缺乏风险关系的因素进行meta回归分析,结果如表 2所示,发表年份可能是其异质性来源(P=0.003)。将可能影响长期运动干预与维生素D水平关系的因素进行单因素meta回归分析,结果如表 3所示,基线维生素D水平、性别、干预方式和维生素D补充是其异质性来源(P=0.001、0.008、0.032、0.049)。
表 1 不同强度身体活动与维生素D缺乏关系的meta回归分析Table 1. Meta-regression analysis of the effect of physical activity with different intensity on vitamin D变量 回归系数 标准误 t P 95% CI 发表年份 1.00 0.02 0.45 0.655 0.97~1.04 人群 0.91 0.05 -1.72 0.095 0.82~1.02 国家/地区 0.97 0.02 -1.17 0.252 0.93~1.02 数据来源 1.00 0.02 -0.12 0.902 0.96~1.03 维生素D切点 0.99 0.07 -0.21 0.832 0.86~1.13 阳光暴露 1.08 0.11 0.72 0.478 0.87~1.33 注:95%CI表示95%置信区间。 表 2 不同季节身体活动与维生素D缺乏关系的meta回归分析Table 2. Meta-regression analysis of the effect of physical activity in different seasons on vitamin D变量 回归系数 标准误 t P 95% CI 发表年份 1.04 0.01 4.16 0.003* 1.02~1.07 人群 1.11 0.08 1.45 0.185 0.94~1.32 国家/地区 1.06 0.10 0.60 0.564 0.85~1.31 数据来源 0.94 0.10 -0.63 0.549 0.74~1.19 维生素D切点 1.09 0.09 1.03 0.331 0.90~1.30 阳光暴露 0.99 0.19 -0.05 0.959 0.64~1.52 注:95%CI表示95%置信区间;*表示P < 0.05。 表 3 长期运动干预与维生素D水平关系的meta回归分析Table 3. Meta-regression analysis of the effect of long-term exercise intervention on vitamin D变量 回归系数 标准误 t P 95% CI 基线维生素D水平 0.82 0.22 3.70 0.001** 0.36~1.29 性别 -10.80 3.72 -2.91 0.008** -18.50~-3.09 年龄 1.25 7.06 0.18 0.860 -13.38~15.88 样本量 0.05 0.04 1.40 0.177 -0.03~0.13 干预方式 15.93 6.98 2.28 0.032* 1.46~30.40 干预时长 0.03 0.31 0.08 0.934 -0.61~0.67 健康状况 -5.68 9.09 -0.63 0.538 -24.53~13.16 维生素D补充 -13.38 6.41 -2.09 0.049* 58.05~124.86 注:95%CI表示95%置信区间;*表示P < 0.05,**表示P < 0.01。 2.7 敏感性分析
敏感性分析结果(图 7)显示,所有研究均在2条可信区间线范围内,各研究之间的异质性不大,剔除某一篇研究对结局指标的影响不大,因此异质性并非来源于单项研究。
3. 讨论
由本综述结果可知,身体活动与血液循环25(OH)D水平呈显著正相关关系,较高的身体活动与较低的维生素D缺乏风险相关。急性和长期运动干预均可显著提高血液循环维生素D水平,急性运动干预对维生素D的影响可能存在时间效应,而长期运动干预可能受不同干预方式的影响。
meta分析结果显示,观察性研究中不同强度和不同季节身体活动与维生素D缺乏风险关系的meta分析结果异质性较高。Egger检验结果表明,探讨不同季节身体活动与维生素D缺乏风险关系的研究不存在发表偏倚(P>0.05),meta分析结果较为稳健。发表年份在不同季节身体活动与维生素D缺乏风险关系的meta分析中差异具有显著性(P=0.003),说明发表年份是其异质性来源。Egger检验结果显示,不同强度身体活动存在明显发表偏倚(P=0.030),meta回归结果显示各因素均无显著性(P均>0.05),说明发表偏倚可能是其异质性来源。本文中长期运动干预对维生素D影响的meta分析的异质性较高,可能是由基线维生素D水平、性别、干预方式和维生素D补充共同导致的。研究[79, 84, 87, 93]表明,运动干预联合维生素D补充更能显著提高维生素D水平。研究[80, 88]表明,不同性别运动干预引起的维生素D水平的改变也有所不同,可见运动干预对维生素D的影响可能存在性别差异。
3.1 身体活动与维生素D的相关关系
研究[16]发现,身体活动不足是导致维生素D缺乏的一个重要危险因素。本文也发现身体活动可以提高维生素D水平,降低维生素D缺乏风险。
不同场所身体活动与维生素D缺乏风险关系的meta分析结果显示,总体身体活动和室外身体活动均可显著提高25(OH)D水平,降低维生素D缺乏风险,但室内身体活动并无该效应。本文所纳入的不符合meta分析标准的大多数文献[18, 29, 32, 36-37]也得出与meta分析类似的结果。但Van Den Heuvel等[32]的研究结果发现,室外步行与血液循环25(OH)D水平无显著关系,该作者认为这一差异可能是由骑行和庭院活动更倾向于在晴天进行所致。有研究者[34, 42]认为,身体活动提高维生素D水平是由间接增加阳光暴露所致。但Wanner等[44]研究发现,与室内身体活动相比,室外身体活动与维生素D的关系并没有更强。纵向研究[94]也发现,从秋季到春季运动员的维生素D水平均显著下降,但室内、外项目运动员之间无显著性差异。且校正阳光暴露因素后,身体活动水平与血液循环25(OH)D水平之间仍具有显著相关性[17, 19, 50]。可见,现有室内身体活动对维生素D影响的研究并不能得到一致的结果,这可能是由室内相关研究较少(仅2篇[30-31]),且以恶性肿瘤患者[30]和老年人(≥65岁)[31]为研究对象所致。
不同强度身体活动与维生素D缺乏风险关系的meta分析结果表明,仅中高强度身体活动可显著提高维生素D水平,降低维生素D缺乏风险。本文所纳入的不符合meta分析标准的文献结果也支持meta分析结果[17-18, 47, 51-53]。Hibler等[43]研究发现,中高强度身体活动与1,25(OH)2D和25(OH)D水平呈显著正相关,但低强度身体活动与1,25(OH)2D和25(OH)D水平无显著性关系,该结果与Da Silva等[10]和Jones等[51]的研究结果一致。Van Den Heuvel等[32]的研究结果显示,步行与血液循环25(OH)D水平无显著性关系,该结果与De Rui[31]得出的结果一致。这可能是由于步行的运动强度过低,不能使维生素D水平发生显著性变化。还有研究[47, 51]发现,低强度身体活动对维生素D的影响可能存在性别差异。未纳入meta分析的研究中,Nadeem Saqib等[38]和Valtueña等[46]的研究结果与meta分析结果并不一致。这可能是由于在其研究中维生素D充足和不足的受试者数量(分别为46名、245名[38]和27名、73名[46])悬殊,且未校正混杂因素。
不同季节身体活动与维生素D缺乏风险关系的meta分析结果表明,冬春季和夏秋季身体活动均可显著提高维生素D水平,降低维生素D缺乏风险,提示全年进行身体活动均对维生素D具有有益作用。本文所纳入的不符合meta分析标准的大多数文献结果也支持meta分析结果[9, 34, 54, 56],但也有研究结果与meta分析结果不一致[20, 57-58]。Kluczynski等[20]研究发现,夏秋季休闲性身体活动和园艺工作在校正阳光暴露等因素后,与血液循环25(OH)D水平仍有显著性关系,但在冬春季无相关关系。Klenk等[57]研究发现,冬、春、秋季步行时长与血液循环25(OH)D水平呈剂量效应关系,但在夏季无显著性关系,该学者认为,这可能是由于夏季血液循环25(OH)D水平最高且夏季步行主要在室内进行。Voipio等[58]研究发现,秋冬季身体活动量(MET-h/周)与血清25(OH)D水平、维生素D缺乏风险均无显著相关性。但Kluczynski等[20]、Klenk等[57]和Voipio等[58]的研究均不能区别室内外身体活动,这可能是由不同季节的室内外身体活动水平不同所致。
除不同场所、强度和季节的研究外,使用身体活动量(MET-h/周)、频率、步数等方式探究总体身体活动水平与维生素D水平或缺乏风险关系的研究结果也显示,身体活动可显著提高维生素D水平。但身体活动是否独立于阳光暴露因素显著提高维生素D水平及其可能的影响机制均需进一步探究。
3.2 运动干预对维生素D的影响
在急性运动干预研究中,Mieszkowski等[73]、Sun等[74]和Barker等[75]均发现急性运动可显著提高血液循环维生素D水平。维生素D是脂溶性维生素,可存储于脂肪组织。Hengist等[95]认为,脂肪组织储存维生素D的释放是脂解过程的附加产物,即脂肪细胞在脂解酶的作用下释放甘油三酯的过程中,储存的维生素D代谢物也同时被释放出来。急性运动可促进脂解酶的释放[96],从而加速脂解过程,维生素D随着脂解从脂肪组织中释放出来。这可能是急性运动引起维生素D增加的原因之一。但Maïmoun等[77]发现,7名男性公路自行车运动员在进行115%和85%通气阈强度运动的运动期和恢复期,血液循环25(OH)D水平、1,25(OH)2D水平均无显著性改变,但115%通气阈强度运动50 min时甲状旁腺激素(Parathyroid Hormone,PTH)显著增加,在运动后15 min达到峰值,而在85%通气阈强度运动的各个时间点PTH均无显著性改变。Maïmoun等[76]的另一项研究发现,身体活跃的老年人、身体中等活跃的老年人和身体活跃的青年人在急性最大递增运动后血清1,25(OH)2D水平均无显著性改变,PTH均显著升高,同时仅身体活跃的老年人血清25(OH)D水平显著下降。在Maïmoun等[76-77]的2项研究中运动后PTH均显著升高,而在其他研究中PTH与血液循环25(OH)D水平呈显著负相关[97]。并且Maïmoun等[76-77]的2项研究均未考虑时间因素,血清25(OH)D(mmol/L)[77]和血清1,25(OH)2D(pg/mL)[76]单位异常,研究质量均不高(质量评分均为65%)。这些均可能是其与Żebrowska等[98]、Sun等[74]和Barker等[75]研究结果不一致的原因。
长期运动干预研究的meta分析结果显示,运动可显著提高血液循环25(OH)D水平。亚组分析结果显示,耐力训练和耐力联合抗阻训练均能显著提高血液循环25(OH)D水平,而抗阻训练并无显著影响。但Pilch等[78]、Sun等[88]、Lithgow等[24]和Evans等[80]的研究与本文meta分析结果不一致。Pilch等[78]的研究结果表明,6周北欧式健步走后肥胖女性血液循环25(OH)D水平显著降低,该学者认为这是由于在深秋季节室外活动、阳光暴露减少导致维生素D的生物合成减少[99]、骨骼肌代谢消耗维生素D[100]。由于Pilch等[78]的研究缺乏对照组,因此对季节导致的血液循环25(OH)D水平的改变量并不清楚,但Sun等[88]的研究结果表明,耐力训练可抵消由季节导致的25(OH)D水平波动,耐力训练组25(OH)D水平无显著性改变,但对照组显著降低,且与对照组相比,耐力训练组肝内脂肪含量减少较多。维生素D储存于脂肪组织中,降低了维生素D的可获得性[101]。因此Sun等[88]认为,运动对维生素D的影响部分是由肝内脂肪改变引起的。
另外,研究[102]发现,由于肥胖者脂肪组织释放维生素D的功能受损,更多的维生素D储存于脂肪组织中,这也可能是Pilch等[78]和Lithgow等[24]研究中超重/肥胖受试者血清25(OH)D水平没有增加的原因之一。Evans等[80]研究发现,4个月的军事训练并不能显著改变女性血液循环25(OH)D和PTH水平,但男性血液循环25(OH)D水平显著降低、PTH水平显著升高,该学者认为,PTH诱导的25(OH)D转化为1,25(OH)2D的增加导致男性血液循环25(OH)D水平的降低。雌激素可以上调维生素D受体基因表达[103],Evans等[80]的研究中女性血液循环25(OH)D水平没有显著性改变,可能是由于维生素D受体增加导致维生素D利用增多。Maïmoun等[104]研究发现32周赛季后,铁人三项运动员1,25(OH)2D水平显著增加,该结果与Klausen等[81]的研究结果不一致,但与动物实验结果[105]一致。Klausen等[81]发现,马拉松运动员在恢复训练后第4周1,25(OH)2D水平显著降低,但血液循环25(OH)D水平无显著性变化,而PTH水平显著增高。PTH可以上调1α-羟化酶的活性,提高1,25(OH)2D水平[106]。因此,Klausen等[81]的研究结果可能是由25(OH)D和1,25(OH)2D利用增加所致。meta分析结果显示,抗阻训练对血液循环25(OH)D水平无显著影响。研究认为,由于肌肉组织是维生素D的重要靶器官和血管外贮存池[107-108],抗阻运动促进了肌肉组织对维生素D的利用,同时随着抗阻训练的进行,训练组受试者的肌肉质量增加,从而增大了肌肉的25(OH)D3储备量。这可能是抗阻训练未能改变血液循环25(OH)D水平的原因。
综上所述,运动干预可提高血液循环25(OH)D水平,但研究数量较少,且研究结果并不完全一致,影响因素尚未明确,仍需进一步探究。
3.3 局限与展望
① 纳入的51篇观察性研究中45篇(83%)为横断面研究,而横断面研究并不能反映因果关系;身体活动的测量方法大部分(90%)是主观测量,易受受试者回忆偏差影响;在纳入的横断面研究中,维生素D缺乏切点并不统一,对身体活动与维生素D缺乏风险关系的meta分析结果具有一定的影响。以后的研究可以进一步进行纵向研究和前瞻性研究分析,也可采用加速度计等客观方式测量身体活动量和强度。②由于运动干预对维生素D影响的研究刚刚起步,相关研究较少,纳入meta分析的研究仅有12篇,期待未来有更多的研究进一步扩充该部分的meta分析结果,为运动调节微量营养素提供更多的理论支撑。③研究[109]表明,90%以上的维生素D是由皮肤经紫外线照射合成的,低强度的紫外线照射即可获得充足的血液循环25(OH)D,阳光暴露是机体维生素D状态的重要影响因素,但纳入的文献并不能严格控制阳光暴露因素。以后的研究可以通过遮光等方式进行动物实验,以明确身体活动对维生素D的影响是否独立于阳光暴露因素。④文献检索仅限于中文和英文,可能导致语言和文化差异。这些不足均有待进一步研究弥补。
4. 结论
无论是观察性研究还是实验性研究均证实了增加身体活动对血液循环维生素D营养状态的有益作用,特别是增加室外中高强度身体活动有助于降低维生素D缺乏风险,但其相关关系是否独立于阳光暴露因素尚无明确定论,需进一步探讨。此外,身体活动调节血液循环维生素D水平的作用可能是通过影响维生素D的代谢相关酶、受体、储存组织等途径实现的,但具体机制有待进一步研究。
-
图 2 不同场所身体活动与维生素D缺乏风险关系的森林图
注:各研究作者后的数字表示该研究中的亚组,其中Yang-1、Yang-2分别表示室外身体活动和室内身体活动亚组,De Rui-1、De Rui-2、De Rui-3、De Rui-4、De Rui-5、De Rui-6、De Rui-7、De Rui-8、De Rui-9、De Rui-10、De Rui-11分别表示男性室外快走、男性室外骑行、男性室外园艺、男性室外垂钓、女性室外快走、女性室外骑行、女性室外园艺、男性室内舞蹈、男性体育馆运动、女性室内舞蹈、女性体育馆运动亚组,Florez-1和Florez-1分别表示西班牙裔白人室外身体活动和非西班牙裔白人室外身体活动亚组;OR表示比值比,95%CI表示95%置信区间。
Figure 2. Forest plot displaying the effect of physical activity in different venues on vitamin D
图 3 不同强度身体活动与维生素D缺乏风险关系的森林图
注:各研究作者后的数字表示该研究中的亚组,其中:Silva-1、Silva-2和Silva-3分别表示总体、男性和女性MVPA;Yang-1和Yang-2分别表示2001—2006年MVPA和2007—2010年MVPA;Hibler-1、Hibler-2、Hibler-5、Hibler-7分别表示当25(OH)D<50 nmol/L时5.5 h/d LPA、3.2 h/d LPA、1.4 h/d MVPA、3.3 h/d MVPA,Hibler-3、Hibler-4、Hibler-6和Hibler-8分别表示当25(OH)D<75 nmol/L时5.5 h/d LPA、3.2 h/d LPA、1.4 h/d MVPA、3.3 h/d MVPA;Manios-1和Manios-2分别表示30~59.9 min/d MPA和>60 min/d MPA;Rodriguez-1和Rodriguez-2分别表示VPA和MPA;Kolokotroni-1和Kolokotroni-2分别表示MPA和VPA;Thuesen-1和Thuesen-2分别表示缺乏标准为25(OH)D<25 nmol/L时VPA和LMPA,Thuesen-3和Thuesen-4分别表示缺乏标准为25(OH)D<50 nmol/L时VPA和LMPA;Brock-1(2010)、Brock-2(2010)、Brock-3(2010)、Brock-4(2010)、Brock-5(2010)、Brock-6(2010)分别表示总体(男/女)每周VPA<3 h、总体(男/女)每周VPA≥3 h、女性每周VPA<3 h、女性每周VPA≥3 h、男性每周VPA<3 h、男性每周VPA≥3 h;Brock-1(2007)和Brock-2(2007)分别表示越南裔VPA和澳大利亚裔/英国裔VPA;MVPA表示中高强度身体活动,MPA表示中等强度身体活动,VPA表示高强度身体活动,LPA表示低强度身体活动,LMPA表示低中强度身体活动;OR表示比值比,95%CI表示95%置信区间。
Figure 3. Forest plot displaying the effect of physical activity with different intensity on vitamin D
图 4 不同季节身体活动与维生素D缺乏风险关系的森林图
注:各研究作者后的数字表示该研究中的亚组,其中:Brock-1(2010)、Brock-2(2010)、Brock-3(2010)和Brock-4(2010)分别表示冬春季进行身体活动、夏秋季进行身体活动、冬春季进行重体力劳动和夏秋季进行重体力劳动;Brock-1(2007)和Brock-2(2007)分别表示冬春季越南裔进行身体活动和冬春季澳大利亚裔/英国裔进行身体活动;Wanner-1和Wanner-2分别表示冬春季进行身体活动和夏秋季进行身体活动;OR表示比值比,95%CI表示95%置信区间。
Figure 4. Forest plot displaying the effect of physical activity in different seasons on vitamin D
表 1 不同强度身体活动与维生素D缺乏关系的meta回归分析
Table 1 Meta-regression analysis of the effect of physical activity with different intensity on vitamin D
变量 回归系数 标准误 t P 95% CI 发表年份 1.00 0.02 0.45 0.655 0.97~1.04 人群 0.91 0.05 -1.72 0.095 0.82~1.02 国家/地区 0.97 0.02 -1.17 0.252 0.93~1.02 数据来源 1.00 0.02 -0.12 0.902 0.96~1.03 维生素D切点 0.99 0.07 -0.21 0.832 0.86~1.13 阳光暴露 1.08 0.11 0.72 0.478 0.87~1.33 注:95%CI表示95%置信区间。 表 2 不同季节身体活动与维生素D缺乏关系的meta回归分析
Table 2 Meta-regression analysis of the effect of physical activity in different seasons on vitamin D
变量 回归系数 标准误 t P 95% CI 发表年份 1.04 0.01 4.16 0.003* 1.02~1.07 人群 1.11 0.08 1.45 0.185 0.94~1.32 国家/地区 1.06 0.10 0.60 0.564 0.85~1.31 数据来源 0.94 0.10 -0.63 0.549 0.74~1.19 维生素D切点 1.09 0.09 1.03 0.331 0.90~1.30 阳光暴露 0.99 0.19 -0.05 0.959 0.64~1.52 注:95%CI表示95%置信区间;*表示P < 0.05。 表 3 长期运动干预与维生素D水平关系的meta回归分析
Table 3 Meta-regression analysis of the effect of long-term exercise intervention on vitamin D
变量 回归系数 标准误 t P 95% CI 基线维生素D水平 0.82 0.22 3.70 0.001** 0.36~1.29 性别 -10.80 3.72 -2.91 0.008** -18.50~-3.09 年龄 1.25 7.06 0.18 0.860 -13.38~15.88 样本量 0.05 0.04 1.40 0.177 -0.03~0.13 干预方式 15.93 6.98 2.28 0.032* 1.46~30.40 干预时长 0.03 0.31 0.08 0.934 -0.61~0.67 健康状况 -5.68 9.09 -0.63 0.538 -24.53~13.16 维生素D补充 -13.38 6.41 -2.09 0.049* 58.05~124.86 注:95%CI表示95%置信区间;*表示P < 0.05,**表示P < 0.01。 -
[1] MADDALONI E, CAVALLARI I, NAPOLI N, et al. Vitamin D and diabetes mellitus[J]. Front Horm Res, 2018, 50: 161-176
[2] SUN X M, CAO Z B, TANISAWA K, et al. Vitamin D supplementation reduces insulin resistance in Japanese adults: A secondary analysis of a double-blind, randomized, placebo-controlled trial[J]. Nutr Res, 2016, 36(10): 1121-1129 doi: 10.1016/j.nutres.2016.07.006
[3] LI Y C. Molecular mechanism of vitamin D in the cardiovascular system[J]. J Investig Med, 2011, 59(6): 868-871 doi: 10.2310/JIM.0b013e31820ee448
[4] POSKITT E M, COLE T J, LAWSON D E. Diet, sunlight, and 25-hydroxy vitamin D in healthy children and adults[J]. Br Med J, 1979, 1(6158): 221-223 doi: 10.1136/bmj.1.6158.221
[5] LAWSON D E, PAUL A A, BLACK A E, et al. Relative contributions of diet and sunlight to vitamin D state in the elderly[J]. Br Med J, 1979, 2(6185): 303-305 doi: 10.1136/bmj.2.6185.303
[6] ROSAS-PERALTA M, HOLICK M F, BORRAYO-SÁNCHEZ G, et al. Dysfunctional immunometabolic effects of vitamin D deficiency, increased cardiometabolic risk. Potential epidemiological alert in America?[J]. Endocrinol Diabetes Nutr, 2017, 64(3): 162-173 doi: 10.1016/j.endinu.2016.11.009
[7] PALACIOS C, GONZALEZ L. Is vitamin D deficiency a major global public health problem?[J]. J Steroid Biochem Mol Biol, 2014, 144(Pt A): 138-145 http://www.researchgate.net/profile/Cristina_Palacios/publication/258635154_Is_vitamin_D_deficiency_a_major_publichealth_problem/links/00b7d52e7bede79963000000.pdf
[8] RITU G, GUPTA A. Vitamin D deficiency in India: Prevalence, causalities and interventions[J]. Nutrients, 2014, 6(2): 729-775 doi: 10.3390/nu6020729
[9] AL-OTHMAN A, AL-MUSHARAF S, AL-DAGHRI N M, et al. Effect of physical activity and sun exposure on vitamin D status of Saudi children and adolescents[J]. BMC Pediatr, 2012, 12(1): 1-6 doi: 10.1186/1471-2431-12-1
[10] DA SILVA A C M, CUREAU F V, DE OLIVEIRA C L, et al. Physical activity but not sedentary time is associated with vitamin D status in adolescents: Study of cardiovascular risk in adolescents (ERICA)[J]. Eur J Clin Nutr, 2019, 73(3): 432-440 doi: 10.1038/s41430-018-0192-0
[11] DZIK K P, KACZOR J J. Mechanisms of vitamin D on skeletal muscle function: Oxidative stress, energy metabolism and anabolic state[J]. Eur J Appl Physiol, 2019, 119(4): 825-839 doi: 10.1007/s00421-019-04104-x
[12] HAN B, WANG X J, WANG N J, et al. Investigation of vitamin D status and its correlation with insulin resistance in a Chinese population[J]. Public Health Nutr, 2017, 20(9): 1602-1608 doi: 10.1017/S1368980017000490
[13] PRASAD P, KOCHHAR A. Interplay of vitamin D and metabolic syndrome: A review[J]. Diabetes Metab Syndr, 2016, 10(2): 105-112 doi: 10.1016/j.dsx.2015.02.014
[14] ZITTERMANN A, PROKOP S. The role of vitamin D for cardiovascular disease and overall mortality[J]. Adv Exp Med Biol, 2014, 810: 106-119 http://europepmc.org/abstract/med/25207362
[15] LEE I M, SHIROMA E J, LOBELO F, et al. Effect of physical inactivity on major non-communicable diseases worldwide: An analysis of burden of disease and life expectancy[J]. Lancet, 2012, 380(9838): 219-229 doi: 10.1016/S0140-6736(12)61031-9
[16] PALANISWAMY S, HYPPÖNEN E, WILLIAMS D M, et al. Potential determinants of vitamin D in Finnish adults: A cross-sectional study from the Northern Finland Birth Cohort 1966[J]. BMJ Open, 2017, 7(3): e013161 doi: 10.1136/bmjopen-2016-013161
[17] SCRAGG R, HOLDAWAY I, JACKSON R, et al. Plasma 25-hydroxyvitamin D3 and its relation to physical activity and other heart disease risk factors in the general population[J]. Ann Epidemiol, 1992, 2(5): 697-703 doi: 10.1016/1047-2797(92)90014-H
[18] SCRAGG R, HOLDAWAY I, SINGH V, et al. Serum 25-hydroxyvitamin D3 is related to physical activity and ethnicity but not obesity in a multicultural workforce[J]. Aust N Z J Med, 1995, 25(3): 218-223 doi: 10.1111/j.1445-5994.1995.tb01526.x
[19] SCOTT D, BLIZZARD L, FELL J, et al. A prospective study of the associations between 25-hydroxy-vitamin D, sarcopenia progression and physical activity in older adults[J]. Clin Endocrinol (Oxf), 2010, 73(5): 581-587 doi: 10.1111/j.1365-2265.2010.03858.x
[20] KLUCZYNSKI M A, LAMONTE M J, MARES J A, et al. Duration of physical activity and serum 25-hydroxyvitamin D status of postmenopausal women[J]. Ann Epidemiol, 2011, 21(6): 440-449 doi: 10.1016/j.annepidem.2010.11.011
[21] SUN X M, MA X K, ZHANG L, et al. Effects of resistance training on serum 25(OH) D concentrations in young men: A randomized controlled trial[J]. Nutr Metab (Lond), 2020, 17(1): 59 doi: 10.1186/s12986-020-00480-w
[22] GUSTAFSSON M K, ROMUNDSTAD P R, STAFNE S N, et al. The effect of an exercise program in pregnancy on vitamin D status among healthy, pregnant Norwegian women: A randomized controlled trial[J]. BMC Pregnancy Childbirth, 2019, 19(1): 76 doi: 10.1186/s12884-019-2220-z
[23] HOSSAIN M J, LEVINSON A, GEORGE D, et al. Vitamin D status and cardiovascular risk in obesity: Effect of physical activity in nonvitamin D supplemented adolescents[J]. Metab Syndr Relat Disord, 2018, 16(4): 197-203 doi: 10.1089/met.2017.0171
[24] LITHGOW H M, FLORIDA-JAMES G, LEGGATE M. The combined effect of high-intensity intermittent training and vitamin D supplementation on glycemic control in overweight and obese adults[J]. Physiol Rep, 2018, 6(9): e13684 doi: 10.14814/phy2.13684
[25] MOHER D, LIBERATI A, TETZLAFF J, et al. Preferred reporting items for systematic reviews and meta-analyses: The PRISMA statement[J]. PLoS Med, 2009, 6(7): e1000097 doi: 10.1371/journal.pmed.1000097
[26] KMET L M, LEE R C, COOK L S. Standard quality assessment criteria for evaluating primary research papers from a variety of fields[R]. Edmonton: Alberta Heritage Foundation for Medical Research, HTA Initiative, 2004: 1-28
[27] 方积乾. 卫生统计学[M]. 北京: 人民卫生出版社, 2016: 343-344 [28] 王丹, 牟振云, 翟俊霞, 等. Stata软件在meta-分析发表性偏倚识别中的探讨[J]. 现代预防医学, 2008, 35(15): 2819-2822 doi: 10.3969/j.issn.1003-8507.2008.15.002 [29] 钱素凤, 吴惠英, 边平达, 等. 老年男性室外运动与骨代谢标志物和骨密度的关系[J]. 浙江医学, 2018, 40(7): 742-744 https://www.cnki.com.cn/Article/CJFDTOTAL-ZJYE201807019.htm [30] YANG L, TORIOLA A T. Leisure-time physical activity and circulating 25-hydroxyvitamin D levels in cancer survivors: A cross-sectional analysis using data from the US National Health and Nutrition Examination Survey[J]. BMJ Open, 2017, 7(7): e016064 doi: 10.1136/bmjopen-2017-016064
[31] DE RUI M, TOFFANELLO E D, VERONESE N, et al. Vitamin D deficiency and leisure time activities in the elderly: Are all pastimes the same?[J]. PLoS One, 2014, 9(4): e94805 doi: 10.1371/journal.pone.0094805
[32] VAN DEN HEUVEL E G H M, VAN SCHOOR N, DE JONGH R T, et al. Cross-sectional study on different characteristics of physical activity as determinants of vitamin D status; inadequate in half of the population[J]. Eur J Clin Nutr, 2013, 67(4): 360-365 doi: 10.1038/ejcn.2013.22
[33] ABSOUD M, CUMMINS C, LIM M J, et al. Prevalence and predictors of vitamin D insufficiency in children: A Great Britain population based study[J]. PLoS One, 2011, 6(7): e22179 doi: 10.1371/journal.pone.0022179
[34] SCRAGG R, CAMARGO C A. Frequency of leisure-time physical activity and serum 25-hydroxyvitamin D levels in the US population: Results from the third national health and nutrition examination survey[J]. Am J Epidemiol, 2008, 168(6): 577-586 doi: 10.1093/aje/kwn163
[35] FLOREZ H, MARTINEZ R, CHACRA W, et al. Outdoor exercise reduces the risk of hypovitaminosis D in the obese[J]. J Steroid Biochem Mol Biol, 2007, 103(3-5): 679-681 doi: 10.1016/j.jsbmb.2006.12.032
[36] VAN DAM R M, SNIJDER M B, DEKKER J M, et al. Potentially modifiable determinants of vitamin D status in an older population in the Netherlands: The Hoorn study[J]. Am J Clin Nutr, 2007, 85(3): 755-761 doi: 10.1093/ajcn/85.3.755
[37] BLACK L J, BURROWS S A, JACOBY P, et al. Vitamin D status and predictors of serum 25-hydroxyvitamin D concentrations in Western Australian adolescents[J]. Br J Nutr, 2014, 112(7): 1154-1162 doi: 10.1017/S000711451400186X
[38] NADEEM SAQIB M A, RAFIQUE I, HAYDER I, et al. Comparison of vitamin D levels with bone density, calcium, phosphate and alkaline phosphatase: An insight from major cities of Pakistan[J]. J Pak Med Assoc, 2018, 68(4): 543-547 http://www.ncbi.nlm.nih.gov/pubmed/29808042
[39] MANIOS Y, MOSCHONIS G, LAMBRINOU C P, et al. Associations of vitamin D status with dietary intakes and physical activity levels among adults from seven European countries: The Food4Me study[J]. Eur J Nutr, 2018, 57(4): 1357-1368 doi: 10.1007/s00394-017-1415-1
[40] 朱玲龑, 冉利梅, 聂四平, 等. 677例围绝经期女性维生素D3水平及其影响因素[J]. 贵州医科大学学报, 2017, 42(11): 1321-1326 https://www.cnki.com.cn/Article/CJFDTOTAL-GYYB201711019.htm [41] CHIN K, ZHAO D, TIBUAKUU M, et al. Physical activity, vitamin D, and incident atherosclerotic cardiovascular disease in whites and blacks: The ARIC study[J]. J Clin Endocrinol Metab, 2017, 102(4): 1227-1236 doi: 10.1210/jc.2016-3743
[42] RODRIGUEZ A, SANTA MARINA L, JIMENEZ A M, et al. Vitamin D status in pregnancy and determinants in a southern European cohort study[J]. Paediatr Perinat Epidemiol, 2016, 30(3): 217-228 doi: 10.1111/ppe.12281
[43] HIBLER E A, SARDO MOLMENTI C L, DAI Q, et al. Physical activity, sedentary behavior, and vitamin D metabolites[J]. Bone, 2016, 83(24): 248-255 http://www.onacademic.com/detail/journal_1000038433629710_ee95.html
[44] WANNER M, RICHARD A, MARTIN B, et al. Associations between objective and self-reported physical activity and vitamin D serum levels in the US population[J]. Cancer Causes Control, 2015, 26(6): 881-891 doi: 10.1007/s10552-015-0563-y
[45] KOLOKOTRONI O, PAPADOPOULOU A, YIALLOUROS P K, et al. Association of vitamin D with adiposity measures and other determinants in a cross-sectional study of Cypriot adolescents[J]. Public Health Nutr, 2015, 18(1): 112-121 doi: 10.1017/S1368980013003480
[46] VALTUEÑA J, GRACIA-MARCO L, VICENTE-RODRÍGUEZ G, et al. Vitamin D status and physical activity interact to improve bone mass in adolescents. The HELENA study[J]. Osteoporos Int, 2012, 23(8): 2227-2237 doi: 10.1007/s00198-011-1884-7
[47] CHOI E Y. 25(OH) D status and demographic and lifestyle determinants of 25(OH) D among Korean adults[J]. Asia Pac J Clin Nutr, 2012, 21(4): 526-535 http://europepmc.org/abstract/MED/23017311
[48] THUESEN B, HUSEMOEN L, FENGER M, et al. Determinants of vitamin D status in a general population of Danish adults[J]. Bone, 2012, 50(3): 605-610 doi: 10.1016/j.bone.2011.12.016
[49] BROCK K, HUANG W Y, FRASER D R, et al. Low vitamin D status is associated with physical inactivity, obesity and low vitamin D intake in a large US sample of healthy middle-aged men and women[J]. J Steroid Biochem Mol Biol, 2010, 121(1-2): 462-466 doi: 10.1016/j.jsbmb.2010.03.091
[50] BROCK K, CANT R, CLEMSON L, et al. Effects of diet and exercise on plasma vitamin D (25(OH) D) levels in Vietnamese immigrant elderly in Sydney, Australia[J]. J Steroid Biochem Mol Biol, 2007, 103(3-5): 786-792 doi: 10.1016/j.jsbmb.2006.12.048
[51] JONES G, DWYER T, HYNES K L, et al. Vitamin D insufficiency in adolescent males in Southern Tasmania: Prevalence, determinants, and relationship to bone turnover markers[J]. Osteoporos Int, 2005, 16(6): 636-641 doi: 10.1007/s00198-004-1733-z
[52] HALL J T, EBELING M, SHARY J R, et al. The relationship between physical activity and vitamin D status in postpartum lactating and formula-feeding women[J]. J Steroid Biochem Mol Biol, 2018, 177: 261-265 doi: 10.1016/j.jsbmb.2017.08.015
[53] SKENDER S, BÖHM J, SCHROTZ-KING P, et al. Plasma 25-hydroxyvitamin D3 levels in colorectal cancer patients and associations with physical activity[J]. Nutr Cancer, 2017, 69(2): 229-237 doi: 10.1080/01635581.2017.1265131
[54] ORCES C H. Association between leisure-time aerobic physical activity and vitamin D concentrations among US older adults: The NHANES 2007-2012[J]. Aging Clin Exp Res, 2019, 31(5): 685-693 doi: 10.1007/s40520-018-1031-9
[55] VERDE Z, GIAQUINTA A, SAINZ C M, et al. Bone mineral metabolism status, quality of life, and muscle strength in older people[J]. Nutrients, 2019, 11(11): E2748 doi: 10.3390/nu11112748
[56] MORTENSEN C, MØLGAARD C, HAUGER H, et al. Sun behaviour and physical activity associated with autumn vitamin D status in 4-8-year-old Danish children[J]. Public Health Nutr, 2018, 21(17): 3158-3167 doi: 10.1017/S1368980018002094
[57] KLENK J, RAPP K, DENKINGER M, et al. Objectively measured physical activity and vitamin D status in older people from Germany[J]. J Epidemiol Community Health, 2015, 69(4): 388-392 doi: 10.1136/jech-2014-204632
[58] VOIPIO A J W, PAHKALA K A, VIIKARI J S A, et al. Determinants of serum 25(OH) D concentration in young and middle-aged adults. The cardiovascular risk in young Finns study[J]. Ann Med, 2015, 47(3): 253-261 http://www.onacademic.com/detail/journal_1000037657418510_5233.html
[59] BROCK K E, GRAUBARD B I, FRASER D R, et al. Predictors of vitamin D biochemical status in a large sample of middle-aged male smokers in Finland[J]. Eur J Clin Nutr, 2010, 64(3): 280-288 doi: 10.1038/ejcn.2009.137
[60] LYM Y L, JOH H K. Serum 25-hydroxyvitamin D3 is related to fish intake and exercise in Korean adult men[J]. Asia Pac J Clin Nutr, 2009, 18(3): 372-376 http://www.researchgate.net/profile/Hee_Kyung_Joh/publication/26853330_Serum_25-hydroxyvitamin_D3_is_related_to_fish_intake_and_exercise_in_Korean_adult_men/links/551a92380cf26cbb81a2f420.pdf
[61] FOO L H, ZHANG Q, ZHU K, et al. Relationship between vitamin D status, body composition and physical exercise of adolescent girls in Beijing[J]. Osteoporos Int, 2009, 20(3): 417-425 doi: 10.1007/s00198-008-0667-2
[62] 马雯娟, 刘静, 魏莲花, 等. 甘肃省健康成人血清维生素D水平及其相关因素[J]. 中华临床营养杂志, 2017, 25(4): 240-245 doi: 10.3760/cma.j.issn.1674-635X.2017.04.007 [63] SOININEN S, ELORANTA A M, LINDI V, et al. Determinants of serum 25-hydroxyvitamin D concentration in Finnish children: The physical activity and nutrition in children (PANIC) study[J]. Br J Nutr, 2016, 115(6): 1080-1091 doi: 10.1017/S0007114515005292
[64] AL-EISA E S, ALGHADIR A H, GABR S A. Correlation between vitamin D levels and muscle fatigue risk factors based on physical activity in healthy older adults[J]. Clin Interv Aging, 2016, 11(4): 513-522 http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=PMC4862760&blobtype=pdf
[65] RACZKIEWICZ A, KISIEL B, KULIG M, et al. Vitamin D status and its association with quality of life, physical activity, and disease activity in rheumatoid arthritis patients[J]. J Clin Rheumatol, 2015, 21(3): 126-130 doi: 10.1097/RHU.0000000000000233
[66] 陈亚军, 袁海军. 日常运动对2型糖尿病患者维生素D水平的影响[J]. 吉林医学, 2015, 36(12): 2451-2452 doi: 10.3969/j.issn.1004-0412.2015.12.004 [67] JUNGERT A, NEUHÄUSER-BERTHOLD M. Sex-specific determinants of serum 25-hydroxyvitamin D3 concentrations in an elderly German cohort: A cross-sectional study[J]. Nutr Metab (Lond), 2015, 12(2): 2
[68] DE TOUVIER M, DESCHASAUX M, MONTOURCY M, et al. Determinants of vitamin D status in Caucasian adults: Influence of sun exposure, dietary intake, sociodemographic, lifestyle, anthropometric, and genetic factors[J]. J Investig Dermatol, 2015, 135(2): 378-388 doi: 10.1038/jid.2014.400
[69] BENER A, AL-ALI M, HOFFMANN G F. Vitamin D deficiency in healthy children in a sunny country: Associated factors[J]. Int J Food Sci Nutr, 2009, 60(Suppl 5): 60-70 http://conservativeliberalparentdev.files.wordpress.com/2015/06/vitamind-d-study.pdf
[70] HINTZPETER B, MENSINK G B M, THIERFELDER W, et al. Vitamin D status and health correlates among German adults[J]. Eur J Clin Nutr, 2008, 62(9): 1079-1089 doi: 10.1038/sj.ejcn.1602825
[71] BERGER C, GREENE-FINESTONE L S, LANGSETMO L, et al. Temporal trends and determinants of longitudinal change in 25-hydroxyvitamin D and parathyroid hormone levels[J]. J Bone Miner Res, 2012, 27(6): 1381-1389 doi: 10.1002/jbmr.1587
[72] MCKIBBEN R A, ZHAO D, LUTSEY P L, et al. Factors associated with change in 25-hydroxyvitamin D levels over longitudinal follow-up in the ARIC study[J]. J Clin Endocrinal Metab, 2016, 101(1): 33-43 doi: 10.1210/jc.2015-1711
[73] MIESZKOWSKI J, STANKIEWICZ B, KOCHANOWICZ A, et al. Ultra-marathon-induced increase in serum levels of vitamin D metabolites: A double-blind randomized controlled trial[J]. Nutrients, 2020, 12(12): E3629 doi: 10.3390/nu12123629
[74] SUN X M, CAO Z B, TANIGUCHI H, et al. Effect of an acute bout of endurance exercise on serum 25(OH) D concentrations in young adults[J]. J Clin Endocrinol Metab, 2017, 102(11): 3937-3944 doi: 10.1210/jc.2017-00146
[75] BARKER T, HENRIKSEN V T, MARTINS T B, et al. Higher serum 25-hydroxyvitamin D concentrations associate with a faster recovery of skeletal muscle strength after muscular injury[J]. Nutrients, 2013, 5(4): 1253-1275 doi: 10.3390/nu5041253
[76] MAÏMOUN L, SIMAR D, CAILLAUD C, et al. Response of calciotropic hormones and bone turnover to brisk walking according to age and fitness level[J]. J Sci Med Sport, 2009, 12(4): 463-467 doi: 10.1016/j.jsams.2008.05.004
[77] MAÏMOUN L, MANETTA J, COURET I, et al. The intensity level of physical exercise and the bone metabolism response[J]. Int J Sports Med, 2006, 27(2): 105-111 doi: 10.1055/s-2005-837621
[78] PILCH W, TYKA A, CEBULA A, et al. Effects of a 6-week Nordic walking training on changes in 25(OH) D blood concentration in women aged over 55[J]. J Sports Med Phys Fitness, 2017, 57(1/2): 124-129 http://www.researchgate.net/profile/Ewa_Sliwicka/publication/293634837_Effects_of_6-week_Nordic_walking_training_on_changes_in_25OHD_blood_concentration_in_women_after_55_years_of_age/links/5975e6efaca2728d0262362b/Effects-of-6-week-Nordic-walking-training-on-changes-in-25OHD-blood-concentration-in-women-after-55-years-of-age.pdf
[79] AGERGAARD J, TRØSTRUP J, UTH J, et al. Does vitamin-D intake during resistance training improve the skeletal muscle hypertrophic and strength response in young and elderly men?A randomized controlled trial[J]. Nutr Metab (Lond), 2015, 12(1): 1-14 doi: 10.1186/1743-7075-12-1
[80] EVANS R K, ANTCZAK A J, LESTER M, et al. Effects of a 4-month recruit training program on markers of bone metabolism[J]. Med Sci Sports Exerc, 2008, 40(11 Suppl): S660-S670 http://www.researchgate.net/profile/Ran_Yanovich/publication/23312288_Effects_of_a_4-Month_Recruit_Training_Program_on_Markers_of_Bone_Metabolism/links/565edb3708aefe619b273ec7.pdf
[81] KLAUSEN T, BREUM L, SØRENSEN H A, et al. Plasma levels of parathyroid hormone, vitamin D, calcitonin, and calcium in association with endurance exercise[J]. Calcif Tissue Int, 1993, 52(3): 205-208 doi: 10.1007/BF00298719
[82] MORADI H, SOHRABI M, TAHERI H, et al. Comparison of the effects of perceptual-motor exercises, vitamin D supplementation and the combination of these interventions on decreasing stereotypical behavior in children with autism disorder[J]. Int J Dev Disabil, 2020, 66(2): 122-132 doi: 10.1080/20473869.2018.1502068
[83] FARAG H A M, HOSSEINZADEH-ATTAR M J, MUHAMMAD B A, et al. Effects of vitamin D supplementation along with endurance physical activity on lipid profile in metabolic syndrome patients: A randomized controlled trial[J]. Diabetes Metab Syndr, 2019, 13(2): 1093-1098 doi: 10.1016/j.dsx.2019.01.029
[84] 李蕊, 杨震, 韩伟, 等. 联合性运动疗法对绝经后骨质疏松症患者骨代谢的影响[J]. 国际骨科学杂志, 2019, 40(1): 52-56, 62 doi: 10.3969/j.issn.1673-7083.2019.01.011 [85] 李霞, 李容华, 徐林, 等. 高强度间歇训练对老年慢性阻塞性肺疾病合并骨质疏松患者康复效果的临床研究[J]. 中国医学前沿杂志(电子版), 2019, 11(5): 30-34 https://www.cnki.com.cn/Article/CJFDTOTAL-YXQY201905010.htm [86] MIESZKOWSKI J, NIESPODZIŃSKI B, KOCHANOWICZ A, et al. The effect of Nordic walking training combined with vitamin D supplementation on postural control and muscle strength in elderly people: A randomized controlled trial[J]. Int J Environ Res Public Health, 2018, 15(9): E1951 doi: 10.3390/ijerph15091951
[87] PRUSIK K, KORTAS J, PRUSIK K, et al. Nordic walking training causes a decrease in blood cholesterol in elderly women supplemented with vitamin D[J]. Front Endocrinol (Lausanne), 2018, 9(42): 42 http://www.onacademic.com/detail/journal_1000040527882210_8b74.html
[88] SUN X M, CAO Z B, TANISAWA K, et al. Effects of chronic endurance exercise training on serum 25(OH) D concentrations in elderly Japanese men[J]. Endocrine, 2018, 59(2): 330-337 doi: 10.1007/s12020-017-1478-z
[89] 张晶晶, 李艳, 茅慧雯, 等. 下肢强化负重运动训练对脑卒中后偏瘫患者骨质疏松的影响[J]. 中国老年学杂志, 2017, 37(21): 5382-5383 doi: 10.3969/j.issn.1005-9202.2017.21.075 [90] 宋立源, 轩应利, 杨军, 等. 绝经后T2DM合并OP患者饮食及运动管理与糖、骨代谢及骨密度相关性的临床研究[J]. 中国骨质疏松杂志, 2014, 20(2): 156-160 https://www.cnki.com.cn/Article/CJFDTOTAL-ZGZS201402010.htm [91] 施丹, 史晓, 李富龙, 等. 运动疗法对骨质疏松症患者的临床作用研究[J]. 中华老年医学杂志, 2013, 32(8): 872-874 doi: 10.3760/cma.j.issn.0254-9026.2013.08.022 [92] 张天嵩, 刘江波, 钟文昭. Stata在探索异质性来源: Meta回归分析中的应用[J]. 循证医学, 2009, 9(1): 48-50 doi: 10.3969/j.issn.1671-5144.2009.01.012 [93] 沈新升, 蔡仲卿, 陈鸥. 运动康复联合阿仑膦酸钠对老年骨质疏松患者的干预效果[J]. 中国老年学杂志, 2019, 39(6): 1365-1367 doi: 10.3969/j.issn.1005-9202.2019.06.028 [94] WILSON-BARNES S L, HUNT J E A, WILLIAMS E L, et al. Seasonal variation in vitamin D status, bone health and athletic performance in competitive university student athletes: A longitudinal study[J]. J Nutr Sci, 2020, 9: e8 doi: 10.1017/jns.2020.1
[95] HENGIST A, PERKIN O, GONZALEZ J T, et al. Mobilising vitamin D from adipose tissue: The potential impact of exercise[J]. Nutr Bull, 2019, 44(1): 25-35 doi: 10.1111/nbu.12369
[96] DE GLISEZINSKI I, LARROUY D, BAJZOVA M, et al. Adrenaline but not noradrenaline is a determinant of exercise-induced lipid mobilization in human subcutaneous adipose tissue[J]. J Physiol, 2009, 587(Pt 13): 3393-3404 http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2727046/pdf/tjp0587-3393.pdf
[97] SUN X M, TANISAWA K, ZHANG Y P, et al. Effect of vitamin D supplementation on body composition and physical fitness in healthy adults: A double-blind, randomized controlled trial[J]. Ann Nutr Metab, 2019, 75(4): 231-237 doi: 10.1159/000504873
[98] ŻEBROWSKA A, SADOWSKA-KRĘPA E, STANULA A, et al. The effect of vitamin D supplementation on serum total 25(OH) levels and biochemical markers of skeletal muscles in runners[J]. J Int Soc Sports Nutr, 2020, 17(1): 18 doi: 10.1186/s12970-020-00347-8
[99] HOLICK M F. Sunlight and vitamin D for bone health and prevention of autoimmune diseases, cancers, and cardiovascular disease[J]. Am J Clin Nutr, 2004, 80(Suppl): 1678S-1688S http://aje.oxfordjournals.org/cgi/ijlink?linkType=ABST&journalCode=ajcn&resid=80/6/1678S
[100] GIRGIS C M, MOKBEL N, CHA K M, et al. The vitamin D receptor (VDR) is expressed in skeletal muscle of male mice and modulates 25-hydroxyvitamin D (25OHD) uptake in myofibers[J]. Endocrinology, 2014, 155(9): 3227-3237 doi: 10.1210/en.2014-1016
[101] WORTSMAN J, MATSUOKA L Y, CHEN T C, et al. Decreased bioavailability of vitamin D in obesity[J]. Am J Clin Nutr, 2000, 72(3): 690-693 doi: 10.1093/ajcn/72.3.690
[102] DI NISIO A, DE TONI L, SABOVIC I, et al. Impaired release of vitamin D in dysfunctional adipose tissue: New cues on vitamin D supplementation in obesity[J]. J Clin Endocrinol Metab, 2017, 102(7): 2564-2574 doi: 10.1210/jc.2016-3591
[103] GILAD L A, BRESLER T, GNAINSKY J, et al. Regulation of vitamin D receptor expression via estrogen-induced activation of the ERK 1/2 signaling pathway in colon and breast cancer cells[J]. J Endocrinol, 2005, 185(3): 577-592 doi: 10.1677/joe.1.05770
[104] MAÏMOUN L, GALY O, MANETTA J, et al. Competitive season of triathlon does not alter bone metabolism and bone mineral status in male triathletes[J]. Int J Sports Med, 2004, 25(3): 230-234 doi: 10.1055/s-2003-45257
[105] IWAMOTO J, SHIMAMURA C, TAKEDA T, et al. Effects of treadmill exercise on bone mass, bone metabolism, and calciotropic hormones in young growing rats[J]. J Bone Miner Metab, 2004, 22(1): 26-31 doi: 10.1007/s00774-003-0443-5
[106] BLAU J E, COLLINS M T. The PTH-vitamin D-FGF23 axis[J]. Rev Endocr Metab Disord, 2015, 16(2): 165-174 doi: 10.1007/s11154-015-9318-z
[107] 马晓凯. 抗阻训练对循环维生素D的影响[D]. 上海: 上海体育学院, 2017: 15 [108] ABBOUD M, PUGLISI D A, DAVIES B N, et al. Evidence for a specific uptake and retention mechanism for 25-hydroxyvitamin D (25OHD) in skeletal muscle cells[J]. Endocrinology, 2013, 154(9): 3022-3030 doi: 10.1210/en.2012-2245
[109] MAKIDA K, NISHIDA Y, MORITA D, et al. Low energy irradiation of narrow-range UV-LED prevents osteosarcopenia associated with vitamin D deficiency in senescence-accelerated mouse prone 6[J]. Sci Rep, 2020, 10(1): 11892 doi: 10.1038/s41598-020-68641-8
-
期刊类型引用(2)
1. 张景华,曹振波. 运动对机体内维生素D代谢影响机制研究进展. 中国运动医学杂志. 2023(10): 825-835 .  百度学术
百度学术
2. 袁凌峰,黄铭涵,毛俊,王宇晨. 基因数据在体育运动领域的应用与展望. 体育与科学. 2022(03): 104-114 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: