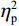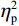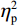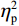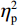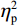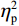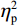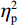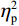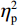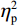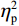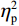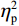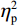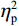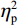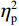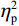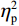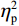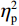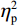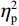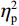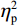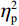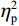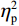Visual-Motor Integration Advantage in Table Tennis Players: EEG Evidence Based on Functional Lateralization Theory
-
摘要:目的
探究乒乓球运动员视觉运动整合的优势特征,并基于功能偏侧化理论分析其神经机制。
方法选取22名乒乓球运动员作为专家组,21名普通大学生作为新手组。采用半视野速示技术,设置视觉运动整合任务,测试并比较乒乓球运动员与新手视觉运动整合的行为差异及脑电特征。
结果①乒乓球专家组的右手反应时显著短于新手组(P < 0.05);②在视觉加工阶段,乒乓球专家组的P1成分潜伏期显著长于新手组,且专家组左半球N2潜伏期显著高于右半球(P < 0.05);③在视觉运动转换和运动执行阶段,乒乓球专家组诱发了更大的BA6区的negativity波幅和BA4区的N2波幅(P < 0.05);④在顶-枕区域,乒乓球专家组的高频alpha节律神经振荡水平低于新手组,具体表现为在左视野右手反应模式下高频alpha节律振荡水平较低(P < 0.05)。
结论①乒乓球运动员右手(优势手)的视觉运动反应时更短;②乒乓球运动员大脑右半球在早期视觉加工阶段对刺激识别更迅速,在视觉运动转换阶段更直接有效;③乒乓球运动员在视觉运动整合过程中表现出更少的注意资源消耗,主要体现在右半球的视觉加工和左半球的动作反应优势上。
Abstract:ObjectiveTo explore the advantages of visual-motor integration in table tennis players, and analyze its neural mechanism based on functional lateralization theory.
Methods22 table tennis players were selected as a group of experts, and 21 general college students were selected as a group of novices. Using the half-visual field tachistoscopic technique, a visual-motor integration task was set up to test and compare the behavioral differences in visual-motor integration and electroencephalographic characteristics between players and novices.
Results① The right-hand reaction time of the table tennis experts was significantly shorter than that of the novice group (P<0.05); ② In the visual processing stage, the P1 component latency of the players was significantly longer than that of the novice group, and the N2 latency of their left hemisphere was significantly higher than that of the right hemisphere (P<0.05); ③ In the visual-motor transition and motor execution stages, the players induced greater BA6 negativity wave amplitude and N2 wave amplitude in the BA4 area (P<0.05); ④ In the parietal-occipital region, the players had lower levels of high-frequency alpha rhythmic neural oscillations than the novice grouphad, which was specifically reflected in the low level of high-frequency alpha rhythmic oscillations in the right-handed response mode of the left visual field (P<0.05).
Conclusions① The visual-motor reaction time of right-handed table tennis players was shorter; ② The right hemisphere of table tennis players can recognize stimuli more quickly in the early visual processing stage and more directly and effectively in the visual motor transition stage; ③ The expertise effect of table tennis players on the visual-motor integration function is mainly reflected in the visual processing of the right hemisphere and the reaction advantage of the left hemisphere.
-
人们可以完成各种行为有赖于良好的视觉运动整合能力[1]。视觉运动整合(Visual-Motor Integration,VMI),亦称视动整合,是将个体感知到的视觉信息与运动技能相结合,以便正确执行手、腿和躯体运动的能力[2],是感知视觉输入、处理信息和协调运动响应的能力[3]。视觉运动整合是一个复合概念,有研究[4]发现,一些拥有正常视知觉和精细动作能力的儿童在视觉运动整合能力评估中仍会有较差的表现。因此,视觉运动整合不是视知觉和执行动作的简单相加,而是中央和外周神经系统协同工作的结果。一项分析猴子执行视觉运动任务的事件相关局部场电位的研究[5]发现,在刺激开始后主要激活了4个皮质区的特异性活动,视觉刺激先激活了纹状体和下颞叶,随后引起了广泛视觉区域的反应,然后到达形成知觉决策和反应选择的后顶叶和运动区;反应特异性处理开始于刺激后150 ms左右,这表明知觉决策形成和反应选择是通过视觉、运动和执行区域的并发过程产生的。这些阶段并非独立划分,而是在大脑中产生连贯的时空表征。此后针对人类的研究发现:视觉信息通过外周神经传入中枢神经系统,从外侧膝状体连接到初级视觉皮层,感知处理视觉亮度、颜色等信号;由大细胞通路传递到高级视觉区,其中颞中区对连续运动视觉信息的方向和速度表现出高度的选择性;随后发生视觉运动转换,在后顶叶将视觉信息转换为运动指令,辅助运动区促进动作的规划和执行;最后将神经信号发送到运动皮层,执行相应的动作。这些研究[6−7]确定了中枢神经系统的4个连续且并行的信息处理过程与视觉运动反应相关,包括初级视觉皮层对视觉刺激的感知、高级视觉区域的视觉加工、运动指令的转化以及最后的动作执行,这4个过程影响了视觉运动整合的任务表现。
在许多球类运动中,运动员需要在紧迫的时间压力下完成视觉运动任务,因此快速感知视野中的线索并启动目标反应的能力至关重要。通常情况下,此类运动员的视觉运动反应时较短[8−9]。感觉运动的适应性有助于运动员调整行为以适应不断变化的环境刺激,从而保持适当的目标导向的运动表现。运动员在动态变化的快节奏环境中做出反应时,要在感觉和运动系统之间保持适当的感觉运动整合,这需要重塑特别的神经网络[7]。局部大脑网络的变化是由长时间的广泛训练引起的,运动专家的皮层变化往往与执行的任务相关[7]。通过训练可以让神经元之间形成新的突触连接模式,并通过刻意练习使已有的连接模式固化稳定[10]。有证据[11]表明,运动员在视觉空间需求中形成了特殊的枕叶神经同步机制,相比于非运动员有着更突出的视觉运动表现。
乒乓球是一种间歇短、速度快、变化多的技能主导型球类项目,运动员需要在极短的时间内做出反应[12]。Akpinar等[13]在一个巧合预测实验中发现了乒乓球运动中这些高要求的视觉运动适应行为。具体来说,在3种速度条件下,要求不同球拍类运动员预测物体何时到达指定目标点,同时收集运动员反应的绝对误差和可变误差,结果发现不同类型运动员的视觉-运动系统在该实验范式中适应了相应运动类型特有的刺激速度,乒乓球运动员在高速条件下的表现明显优于网球和羽毛球运动员。除此之外,视觉运动反应实验表明,与非运动员[14]和网球运动员[15−16]相比,乒乓球运动员的视觉运动反应时间更短。虽然这些发现强调了视觉运动反应能力在乒乓球运动中的关键作用,但这些研究主要集中在行为表现上。近期有研究[17]发现了羽毛球运动员与非运动员视觉运动反应存在差异的神经相关因素——当刺激出现后,运动员表现出较早的颞中区(middle temporal area,MT)激活,反映视觉运动信息感知的N2成分较早出现。但也有研究[6]认为,视觉加工阶段的P1和N2成分与刺激特征的感知处理有关,与视觉运动反应时间的缩短无直接关联。此外,运动员还表现出初级运动皮层(primary motor cortex,BA4)和前-辅助运动皮层(pre-and supplementary motor cortex,BA6)的激活更快,这主要体现在nega-tivity成分的潜伏期更短,该成分与视觉信号转换到运动指令的过程有关[5−6, 18]。针对BA6区positivity成分的研究[5]发现,其与即将执行的运动无关的感觉刺激输入有关。还有研究[19]发现,高频alpha与感觉运动区的皮层激活有关。例如,Störmer等[20]通过给被试左右视野呈现不同声音刺激,发现会导致其对侧枕区高频alpha节律的神经振荡增加,表明被试对该侧空间投入了注意资源。同时,针对乒乓球运动员加工专项相关信息的研究[21]发现,运动员在执行视觉-控制任务时alpha节律的能量下降较少,表明运动员大脑皮层的激活程度相对较低,从而节省了中枢神经系统的资源。
目前,研究者对乒乓球运动专长带来的视觉运动整合系统的神经机制适应性知之甚少。针对这一适应性的神经机制,传统观点认为,为了适应日益复杂和协调的行为,需要发展更广泛的神经回路来执行潜在的计算,这种计算可以通过扩大脑网络来实现[22],但这无疑会消耗巨大的能量和远程处理时间。有研究者[22]提出,半球功能专业化是解释这一问题的有效途径,即重塑同一半球内的神经机制以发展更有效的局部回路。一项针对视觉运动区域的功能性磁共振(functional Magnetic Resonance Imagine, fMRI)研究[23]发现,乒乓球运动员的视觉运动系统与非运动员相比,感觉运动区增加了内在功能的灵活性,而视觉区增加了内在功能的专业化,以支持其卓越的运动表现。有研究[24−25]发现,羽毛球运动员的反应优越性主要源自其快速视觉运动转换。但也有研究[26−27]认为,导致运动员视觉运动表现优异的原因是其优异的视觉感知和加工信息的能力。大脑功能偏侧化在许多知觉和认知过程中都有显著的特征[28],视觉和运动系统的信息加工通常都遵循特征性的偏侧化模式[29]。行为学研究[30−31]发现,快速呈现在左视野的视觉刺激比右视野更容易被识别。羽毛球运动员的行为表现具有右手和左眼优势[32]。但另一项研究[33]发现,羽毛球运动员对右眼视野中的反应更充分,反应时间更短,这可能是由于长期训练导致右眼感知的刺激在大脑左半球进行处理,同时控制身体右侧的功能,从而做出快速而准确的反应。视觉运动整合功能的偏侧化也是发展高级认知能力及其半球功能专业化的基础[34]。这种半球偏侧化现象也影响了顶叶的部分区域。然而关于顶叶回路在视觉运动系统中的作用存在争议,早期研究强调对侧顶叶皮层的激活[35],而最近的研究提出在行为适应过程中,左侧[36]、右侧[37−38]或双边[39−40]顶叶均有调节作用。
总体而言,目前运动领域有关视觉运动整合及其功能偏侧化的研究相对较少,尤其对运动员的视觉运动整合的偏侧化特征及运动专长对视觉运动整合功能的偏侧化影响的探讨更是鲜见。评估大脑激活的偏侧化是确定视觉运动整合的哪些神经过程有助于视觉运动反应表现,以及这些神经过程如何在功能上受到长期运动训练影响的有效方法。这既能精准定位发生专业化神经可塑性的区域,又能探究视觉运动信息流的高效整合过程。因此,本文选择经典视觉运动Simon任务,结合半视野速示技术进行改良,通过快速呈现半视野刺激引起的视知觉和运动,评估大脑对视觉刺激的整合能力。为了更清楚全面地描述视觉运动整合的大脑神经活动时程,采用事件相关电位(event-related potentials,ERP)和事件相关谱扰动(event-related spectral perturbation,ERSP)方法,详细区分视觉与运动半球偏侧化,将视觉运动整合各阶段的相关ERP指标结合高频alpha节律的神经振荡特征,分析并探讨:①在视野与反应手结合的不同模式下,乒乓球运动员和新手之间视觉运动整合表现是否存在差异及其特征;②比较乒乓球运动员视觉运动整合优势的相关ERP成分,探究该优势具体体现在视觉运动整合的哪个阶段;③乒乓球运动员视觉运动整合的神经振荡特征。假设:①相对于新手,乒乓球运动员在视觉运动整合任务中左视野右手的反应模式下反应速度更快且准确率更高;②两组的差异体现在不同半球相关ERP成分上,即右半球初、次级视觉皮层(primary and secondary visual cortex,V1和V4)的P1和N2,BA6区的positivity和negativity,以及左半球BA4区的P2和N2成分上;③在高频alpha节律上,乒乓球运动员右半球的视觉加工阶段、视觉运动转换阶段和左半球的动作反应阶段产生较低的神经振荡频率。
1. 研究对象与方法
1.1 研究对象
实验选取43名被试,由22名专业体育高等院校乒乓球校队队员(专家组)和21名普通大学生(新手组)组成。专家组被试均为国家一级运动员且平均训练年限为7年及以上,训练频率为5次/周以上,每次约3h;新手组为无任何球类经验的大学生。所有被试视力或矫正视力良好,均为右利手,无色盲色弱,无身心健康问题,均为自愿参加并签署知情同意书。研究经相关高校的医学伦理委员会批准(批准号:2023017),并按照《赫尔辛基宣言》所规定的伦理标准执行。
因个别被试的脑电数据伪迹过多,剔除专家组2名被试及新手组1名被试。最终纳入数据分析的专家组被试20人[男12人,平均年龄(19.65±1.42)岁],新手组被试20人[男13人,平均年龄(20.55±1.47)岁],专家组与新手组被试年龄无显著差异。
1.2 实验设计
采用2(组别:专家组、新手组)×2(视野:左视野、右视野)×2(反应手:左手、右手)的混合设计。组别为被试间变量,视野和反应手为被试内变量。因变量为行为反应的反应时和正确率、视觉运动整合过程中的ERP成分以及高频alpha节律的ERSP值。
1.3 实验材料与流程
用下巴托架将被试的头部位置固定,被试的眼睛水平视线与屏幕中央垂直,距离为65 cm,屏幕背景为黑色。视觉刺激为一个随机位置呈现的彩色(红色或蓝色)正方形目标[(60×60) px]嵌入由64个灰色方形[(60×60) px]组成的分心物阵列[(480×480) px],每一侧分心物阵列中心点距屏幕中心注视点360 px,分心物阵列距屏幕中心注视点范围为120~600 px,分别在左或右视野呈现。所有刺激呈现在19 英寸的电脑屏幕上,屏幕分辨率为
(1440 ×900) px,刷新频率为60 Hz。正式实验包含240个试次,4种任务条件各60个试次,随机分至4个block;每个block包含60个试次,其中,30个试次随机呈现在左视野,30个试次随机呈现在右视野。每个试次依次按“注视点-视觉刺激-黑屏(练习任务时有反馈)”3个过程进行(图1),即:首先呈现一个白色“+”注视点(200~300 ms);随后呈现视觉刺激250 ms,被试需要在呈现刺激后立刻对该刺激颜色做出判断,左手食指为蓝色,右手食指为红色;随后进入试次之间
1000 ~1500 ms的间隔黑屏。在练习任务中出现黑屏时进行反馈,反馈信息为判断是否正确及其反应时间,正式实验中黑屏无反馈信息。正式实验前先进行练习。练习前先呈现指导语和解说实验任务,当被试对实验任务及操作理解后开始练习。每个实验条件练习2个试次,共练习8个试次,每个block之间被试可以选择休息。1.4 数据采集
实验程序由E-Prime编制,采用德国Brain Product公司基于国际10~20系统扩展的64导电极帽,记录连续的脑电活动。使用Brain Amp放大器、Ag-AgCl电极和Brain Vision Recorder软件在台式计算机上记录脑电数据,并使用MATLAB软件进行数据分析和处理。记录信号时,以FCz电极点作为参考电位,右眼眶下方1 cm处放置垂直眼电(VEOG),所有电极的头皮阻抗<5 kΩ。所有连续的信号以500 Hz的采样率进行数字化。
1.5 数据分析
1.5.1 行为数据
采用SPSS统计软件对反应时和正确率进行2(组别:专家组、新手组)×2(视野:左视野、右视野)×2(反应手:左手、右手)的重复测量方差分析。剔除平均反应时±3个标准差之外的70个试次。
1.5.2 脑电数据
采用BP Analyzer对数据进行预处理。以双耳乳突(TP9和TP10)的平均电位作为重参考电极,还原FCz电极并导出数据。将重参考的数据再导入MATLAB软件和EEGLAB工具箱进行滤波,滤波通频带为0.1~30 Hz,用独立成分分析法(independent component analysis)识别并去除眼动伪迹。以刺激出现为零点,选择−200~
1000 ms进行分段,并以刺激呈现前−200~0 ms时间间隔作为基线校正的基线值,排除电压超过±80 μV的试次。基于以往研究和本文实验设计,选取12个电极点,分别是O1、O2、PO7、PO8、P7、P8、P5、P6、F1、F2、FC1和FC2,并根据区域合并电极点形成四大脑区,分别是左侧V1区(V1左,包括O1)、右侧V1区(V1右,包括O2)、左侧V4区(V4左,包括PO7、P7和P5)、右侧V4区(V4右,包括PO8、P8和P6)、左侧BA6区(BA6左,包括F1)、右侧BA6区(BA6右,包括F2)、左侧BA4区(BA4左,包括FC1)和右侧BA4区(BA4右,包括FC2)。根据以往研究及本实验的ERP波形,在视觉加工阶段选取V1区P1(70~130 ms)、V4区P1(80~130 ms)和N2(140~180 ms)的平均波幅和潜伏期进行2(组别:专家组、新手组)×2(视野:左视野、右视野)的重复测量方差分析。选取视觉运动转换阶段BA6区的positivity(160~220 ms)和negativity(240~300 ms),以及动作计划阶段BA4区的P2(165~230 ms)和N2(260~320 ms)的平均波幅和潜伏期进行2(组别:专家组、新手组)×2(视野:左视野、右视野)×2(反应手:左手、右手)的重复测量方差分析。采用Greenhouse-Geisser方法对P值进行校正,多重检验时采用Bonferroni方法对P值进行校正,显著性水平α为0.05。
1.5.3 时频数据
采用MATLAB和EEGLAB工具箱进行时频分析的数据预处理。预处理完成后,在Letswave软件中,使用持续小波变换(continuous wavelet transform,CWT)将脑电(Electroencephalogram,EEG)数据转换为时频域数据。计算时频表征中的ERSP,以获得EEG节律的能量调节。母小波(mother wavelet short)设置为cmor1.0~1.5,并以0.58 Hz的频率呈现1~30 Hz的时频表征,输出格式设置为功率值。采用的公式为ERt,f =[At,f −Rf ]/Rf ×100%,其中,At,f指在给定时间(t)和频率(f)下的单试次振荡能量,Rf指在基线时间窗内单试次能量的平均值。
在完成视觉运动整合任务时,被试大脑激活区域集中在顶枕区域,根据脑地形图分布和前人文献,本文将顶-枕区(P1、P2、P3、P4、PO3和PO4)定义为时频感兴趣区,计算其高频alpha节律(10~13 Hz)的ERSP平均值,并对其做−200~0 ms的基线矫正。对视觉运动整合过程中诱发的高频alpha节律进行2(组别:专家组、新手组)×2(视野:左视野、右视野)×2(反应手:左手、右手)的重复测量方差分析。在分析过程中,当统计量不满足球形检验时,对自由度和P值进行Greenhouse-Geisser法矫正,采用Bonferroni法进行事后比较,显著性水平α为0.05。
2. 研究结果
2.1 行为学数据结果
对反应时和正确率进行以被试类型为组间变量的2(视野:左视野、右视野)×2(反应手:左手、右手)重复测量方差分析。
反应时结果显示:视野主效应显著(F(1,38)= 11.59,P < 0.001,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.23),右视野反应时[(392.10 ± 5.73)ms]短于左视野[(396.49 ± 5.83)ms];反应手主效应边缘显著(F(1,38)= 4.05,P = 0.051,$ {\eta }_{\mathrm{p}}^{2} $ = 0.10),右手反应时[(392.48 ± 5.72)ms]短于左手[(396.11 ± 5.90)ms];视野和反应手的交互作用显著(F(1,38) = 79.81,P < 0.01,$ {\eta }_{\mathrm{p}}^{2} $ = 0.67)。简单效应分析结果显示:在左视野条件下,左手反应时[(386.23 ± 6.65)ms]显著短于右手[(406.75 ± 5.43)ms](P < 0.01);在右视野条件下,右手反应时[(378.20 ± 6.37)ms]显著短于左手[(406.00 ± 5.46) ms](P < 0.01)。组别与反应手交互作用显著(F(1,38) = 4.74,P = 0.036,$ {\eta }_{\mathrm{p}}^{2} $ = 0.11)。简单效应分析结果显示,在右手反应的情况下,专家组反应时[(387.25 ± 8.10 )ms]显著短于新手组[(394.83 ± 8.34)ms](P < 0.05),左手反应时无显著差异(P > 0.05)。反应时组别主效应不显著(F(1,38)= 0.32,P > 0.05)。组别和视野交互作用不显著(F(1,38)= 0.25,P > 0.05)。组别、视野和反应手三者交互作用不显著(F(1,38)= 0.19,P > 0.05)。正确率结果显示:视野主效应显著(F(1,38)= 18.27,P < 0.01,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.33),右视野正确率(0.93 ± 0.01)显著高于左视野(0.89 ± 0.01);反应手主效应显著(F(1,38)= 34.25,P < 0.01,$ {\eta }_{\mathrm{p}}^{2} $ = 0.47),左手反应正确率(0.93 ± 0.01)显著高于右手(0.89 ± 0.01);视野和反应手的交互作用显著(F(1,38) = 27.21,P < 0.01,$ {\eta }_{\mathrm{p}}^{2} $ = 0.42)。简单效应分析结果显示:在左视野条件下,左手反应正确率(0.94 ± 0.01)显著高于右手(0.86 ± 0.01)(P < 0.05);在右视野条件下,左右手反应正确率无显著差异(P > 0.05);在右手反应情况下,左视野正确率(0.86 ± 0.01)显著低于右视野(0.93 ± 0.01)(P < 0.05)。正确率组别主效应不显著(F(1,38)= 0.24,P > 0.05)。组别和视野交互作用不显著(F(1,38)= 0.68,P > 0.05)。组别和反应手交互作用不显著(F(1,38)= 1.01,P > 0.05)。组别、视野和反应手三者交互作用不显著(F(1,38)= 0.03,P > 0.05)。2.2 脑电数据结果
图2为V1区和V4区的ERP总平均波形图及地形图,根据总平均波形的特征,选取V1区P1(70~130 ms)、V4区P1(80~130 ms)和N2(140~180 ms)的平均波幅和潜伏期进行2(组别:专家组、新手组)×2(视野:左视野、右视野)的重复测量方差分析。
(1)V1区。P1波幅的统计结果显示,视野主效应显著(F(1,38) = 7.55,P < 0.05,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.18)。事后检验显示,右视野[(0.01 ± 0.25)μV]比左视野[(−0.63 ± 0.27)μV]诱发了更大的P1平均波幅(P < 0.05)。组别主效应不显著(F(1,38)= 0.92,P > 0.05),组别和视野的交互作用不显著(F(1,38)= 1.52,P > 0.05)。P1潜伏期的统计结果显示,组别主效应显著(F(1,38) = 4.34,P < 0.05,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.11)。事后检验显示,专家组[(103.22 ± 2.45)ms]比新手组[(96.11 ± 2.38)ms]P1的潜伏期更长(P < 0.05)。视野主效应显著(F(1,38) = 4.35,P < 0.05,$ {\eta }_{\mathrm{p}}^{2} $ = 0.11)。事后检验显示,右视野[(102.74 ± 2.29)ms]比左视野[(96.59 ± 2.24)ms]P1的潜伏期更长(P < 0.05)。组别和视野的交互作用不显著(F(1,38)= 0.23,P > 0.05)。(2)V4区。P1波幅的统计结果显示,视野主效应显著(F(1,38) = 4.99,P < 0.05,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.13)。事后检验显示,右视野[(1.08 ± 0.25) μV]比左视野[(0.46 ± 0.28 ) μV]诱发了更大的P1平均波幅(P < 0.05)。组别主效应不显著(F(1,38)= 0.61,P > 0.05)。组别和视野的交互作用不显著(F(1,38)= 0.89,P > 0.05)。P1潜伏期的统计结果显示,视野主效应显著(F(1,38) = 6.65,P < 0.05,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.17)。事后检验显示,右视野[(107.42 ± 1.65)ms]比左视野[(103.37 ± 1.58 )ms]P1的潜伏期更长(P < 0.05)。组别主效应不显著(F(1,38)=0.44,P > 0.05),组别和视野的交互作用不显著(F(1,38)=0.12,P > 0.05)。N2波幅的统计结果显示,视野主效应显著(F(1,38) = 5.85,P < 0.05,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.14)。事后检验显示,左视野[(−4.26 ± 0.48)μV]比右视野[(−3.34 ± 0.38 )μV]诱发了更大的N2平均波幅(P < 0.05)。组别主效应不显著(F(1,38)= 0.90,P > 0.05),组别和视野的交互作用不显著(F(1,38)= 1.04,P > 0.05)。N2潜伏期的统计结果显示,视野主效应显著(F(1,38) = 4.27,P < 0.05,
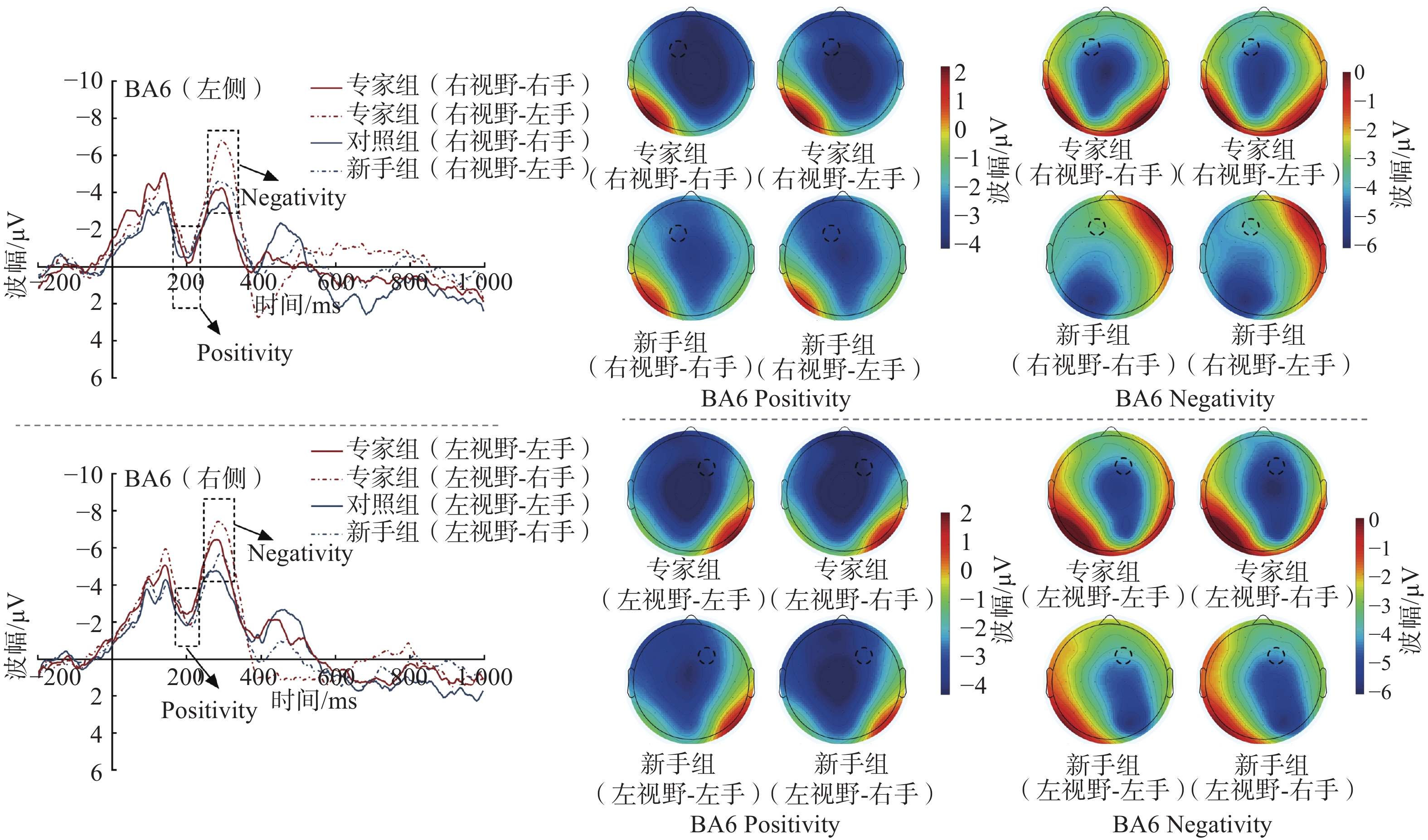
$ {\eta }_{\mathrm{p}}^{2} $ = 0.11)。事后检验显示,右视野[(167.39 ± 1.49)ms]比左视野[(164.76 ± 1.39 )ms]N2的潜伏期更长(P < 0.05)。组别和视野的交互作用显著(F(1,38) = 5.15,P < 0.05,$ {\eta }_{\mathrm{p}}^{2} $ = 0.13)。简单效应分析显示,专家组N2潜伏期出现左右半球差异,右视野潜伏期[(169.35 ± 2.02)ms]显著高于左视野[(163.80±1.97)ms](P < 0.05)。但新手组未发现类似效应。图3为BA6区的ERP总平均波形图及地形图,根据总平均波形的特征,选取BA6区的positivity(160~220 ms)和negativity(240~300 ms)平均波幅和潜伏期进行2(组别:专家组、新手组)×2(视野:左视野、右视野)×2(反应手:左手、右手)的重复测量方差分析。
BA6区positivity波幅的统计结果显示,视野主效应显著(F(1,38) = 13.24,P < 0.001,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.28)。事后检验显示,右视野[(−1.28 ± 0.54 )μV]比左视野(−2.76 ± 0.39 )μV]诱发了更加正性的BA6 positivity平均波幅(P < 0.001)。组别和反应手主效应不显著(F(1,38)= 0.69,P > 0.05),三者不存在显著的交互作用(F(1,38)= 0.43,P > 0.05)。BA6区positivity潜伏期的统计结果显示,反应手主效应显著(F(1,38) = 6.35,P < 0.05,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.15)。事后检验显示,右手[(201.24 ± 2.29)ms]比左手[(196.45 ± 2.29)ms]的BA6 positivity潜伏期更长(P < 0.05)。组别和视野的交互作用显著(F(1,38) = 4.25,P < 0.05,$ {\eta }_{\mathrm{p}}^{2} $ = 0.11)。简单效应分析显示,在右视野条件下,专家组[(202.79 ± 3.33)ms]比新手组[(191.90 ± 3.33)ms]的BA6 positivity潜伏期更长(P < 0.05),左视野未发现类似效应。视野和反应手的交互作用显著(F(1,38) =4.39,P < 0.05,$ {\eta }_{\mathrm{p}}^{2} $ = 0.11)。简单效应分析显示,在左视野条件下,右手[(205.42 ± 2.81)ms]比左手[(195.26 ± 3.08)ms]的BA6 positivity潜伏期更长(P < 0.05)。但右视野未发现类似效应。组别和视野主效应不显著(F(1,38)= 0.78,P > 0.05),三者不存在显著的交互作用(F(1,38)= 0.56,P > 0.05)。BA6区negativity波幅的统计结果显示,组别主效应显著(F(1,38) = 6.87,P < 0.05,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.17)。事后检验显示,专家组[(−6.64 ± 0.85)μV]比新手组[(−3.49 ± 0.85)μV]诱发了更大的BA6区negativity平均波幅(P < 0.05)。视野主效应显著(F(1,38) = 5.24,P < 0.05,$ {\eta }_{\mathrm{p}}^{2} $ = 0.13)。事后检验显示,左视野[(−5.70 ± 0.64)μV]比右视野[(−4.43 ± 0.69)μV]诱发了更大的BA6区negativity平均波幅(P < 0.05)。反应手主效应不显著(F(1,38)= 0.77,P > 0.05)。视野和反应手的交互作用显著(F(1,38) = 4.99,P < 0.05,$ {\eta }_{\mathrm{p}}^{2} $ = 0.13)。简单效应分析显示,在左视野条件下,右手[(−6.28 ± 0.72)μV]比左手[(−5.13 ± 0.65)μV]诱发了更大的BA6 negativity平均波幅(P < 0.05)。在右视野条件下,左手[(−5.31 ± 0.76)μV]比右手[(−3.55 ± 0.72)μV]诱发了更大的BA6区negativity平均波幅(P < 0.05)。三者不存在显著的交互作用(F(1,38)= 0.21,P > 0.05)。BA6区negativity潜伏期的统计结果显示,组别、视野和反应手的主效应及交互作用均不显著(Ps > 0.05)。
图4为BA4区的ERP总平均波形图及地形图,根据总平均波形的特征,选取BA4区的P2(165~230 ms)和N2(260~320 ms)的平均波幅和潜伏期进行2(组别:专家组、新手组)×2(视野:左视野、右视野)×2(反应手:左手、右手)的重复测量方差分析。
P2波幅的统计结果显示,视野主效应显著(F(1,38) = 14.72,P < 0.001,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.29)。事后检验显示,右视野[(−1.90 ± 0.44)μV]比左视野[(−3.24 ± 0.32)μV]诱发了更大的P2平均波幅(P < 0.001)。组别和反应手主效应不显著(F(1,38)= 0.35,P > 0.05),三者不存在显著的交互作用(F(1,38)= 0.24,P > 0.05)。P2潜伏期的统计结果显示,组别、视野和反应手的主效应和交互作用均不显著(Ps > 0.05)。
N2波幅的统计结果显示,组别主效应显著(F(1,38) = 5.10,P < 0.05,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.12)。事后检验显示,专家组[(−6.34 ± 0.78)μV]比新手组[(−3.87 ± 0.76)μV]诱发了更大的N2平均波幅(P < 0.05)。视野主效应显著(F(1,38) = 6.57,P < 0.05,$ {\eta }_{\mathrm{p}}^{2} $ = 0.15)。事后检验显示,左视野[(−5.67 ± 0.57)μV]比右视野[(−4.455 ± 0.61)μV]诱发了更大的N2平均波幅(P < 0.05)。视野和反应手的交互作用显著(F(1,38) =10.79,P < 0.05,$ {\eta }_{\mathrm{p}}^{2} $ = 0.23)。简单效应分析显示,在右视野条件下,左手[(−5.38 ± 0.69)μV]比右手[(−3.72 ± 0.61)μV]诱发了更大的N2平均波幅(P < 0.05)。但左视野未发现类似效应。反应手主效应不显著(F(1,38)= 1.13,P > 0.05),三者的交互作用不显著(F(1,38)= 0.75,P > 0.05)。N2潜伏期的统计结果显示,视野和反应手的交互作用显著(F(1,38) = 11.45,P < 0.01,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.27)。简单效应分析显示,在左视野条件下,左手[(277.95 ± 2.31)ms]比右手[(286.79 ± 2.76)ms]N2的潜伏期更短(P < 0.05)。组别、视野和反应手的主效应均不显著(Ps > 0.05)。2.3 时频分析结果
时频分析结果如图5所示。组别主效应显著(F(1,38) = 4.27,P < 0.05,
$ {\eta }_{\mathrm{p}}^{2} $ = 0.11)。事后检验显示,专家组高频alpha节律的ERSP值显著高于新手组(P < 0.05)。反应手主效应显著(F(1,38) = 6.03,P < 0.05,$ {\eta }_{\mathrm{p}}^{2} $ = 0.15)。事后检验显示,右手反应的高频alpha节律的ERSP值显著高于左手(P < 0.05)。组别、视野和反应手的交互作用显著(F(1,38) = 5.31,P < 0.05,$ {\eta }_{\mathrm{p}}^{2} $ = 0.13)。简单效应分析显示,在左视野条件下,专家组右手高频alpha节律的ERSP值显著高于新手组右手(P < 0.05)。以上结果表明,相比于新手组,乒乓球专家的高频alpha节律的振荡水平较低,具体表现为在左视野的右手反应模式下更具优势。3. 讨 论
在竞技运动中,运动员需要感知和评估特定情境,选择正确的解决方案,并启动适当的运动反应。换言之,运动成绩在很大程度上取决于运动员的感知、认知和运动能力。功能偏侧化理论认为这种潜在的优势可能源于两方面,一方面是左右半球能够进行并行和互补的信息加工,另一方面是偏侧化能够选择性地增强一侧半球在感知或运动学习方面的能力,从而提高该侧半球在反应效率上的优势[41]。精英运动员通过长期训练,其大脑半球功能的专业化程度较高,这种半球内信息传递和处理的效率提高,支持了运动员卓越的运动表现[22−23]。本文以乒乓球专家和新手为研究对象,通过视觉与运动的大脑半球偏侧化特征进一步把视觉运动整合过程分为视觉加工、视觉运动转换和运动执行等阶段,根据功能偏侧化理论探讨了乒乓球运动员视觉运动整合过程不同阶段的优势表现及其神经学证据。
3.1 乒乓球运动员视觉运动整合的行为特征
行为结果显示,在右手反应的情况下,专家组反应时显著短于新手组,与视野无关,且在左手反应情况下并未发现差异。这与以往研究[6]结果一致,即专家相比于新手其视觉运动反应更快。本文并未发现反应时的组别主效应,可能的原因是本文招募的均为右利手被试,长期训练主要影响了专家组的右手(优势手)反应,左手反应未表现出专家和新手之间的差异,故未出现组别主效应。一些研究发现,运动员往往需要在没有大量认知处理的情况下启动目标反应,这种简单视觉运动反应在足球[8]、排球[9, 27]、乒乓球[14]和羽毛球[6, 18]中多次被证明运动员表现优于非运动员,但这些研究均未区分运动员的优势手与非优势手。本文发现,这种简单视觉运动反应的优势只在优势手侧(左半球)存在,在非优势手侧,专家与新手的反应无显著差异。这也进一步证实了运动员更快的视觉运动反应时间可归因于动作前的神经生理过程。专家的视觉运动整合行为表现的左半球优势与以往研究中发现的视觉运动和视觉空间能力的右侧偏侧化结果相反[42],也有研究[32]发现,羽毛球运动员在视觉运动反应任务中存在右手和左眼优势,这可能与研究过程中呈现的刺激类型有关。
行为结果的正确率组间并无显著差异,原因可能是实验的刺激条件易辨别,出现一定的天花板效应,两组被试在进行快速识别编码后,都能准确做出反应,只在反应时上存在差异。视野和反应手的行为结果均出现显著差异。在反应时和准确率上表现出显著的视觉运动Simon效应,即个体对非空间特征做空间反应时,刺激呈现位置对反应的影响[43]。视觉运动Simon效应是一种同侧反应视觉运动易化产生的短暂效应,会随着反应时的延长而减小或消失[44],本文结果与前人研究[45]结果一致。以上结果表明,不管是专家还是新手,视觉运动整合都出现了同侧易化效应,但专家组在不同视野条件下均存在右手(左半球)反应优势,具体体现为反应时显著短于其他情况。
3.2 乒乓球运动员视觉运动整合在视觉加工阶段的优势特征
本文选取该阶段V1区的P1成分、V4区的P1和N2成分进行分析,结果发现,在V1区P1的潜伏期专家组显著长于新手组,在V4区N2的潜伏期专家组出现左右半球差异,右视野(左半球)潜伏期显著长于左视野(右半球),这与前人研究[6, 24, 27]结果不一致。V1区P1成分易受视觉刺激的亮度和对比度等因素的影响,并且与无意识感觉偏向相关[46]。以往研究[24, 27]发现,参加视觉运动整合能力要求较高项目的运动员,其P1潜伏期不仅比非运动员短,也短于赛艇运动员,因此认为运动员的视觉加工速度更快,视神经信号传输更快。但也有研究[26, 47]发现,P1潜伏期在排球、板球和非运动员之间并不存在差异。在本文中,乒乓球专家没有将注意立即指向视觉刺激的物理特征,而是保持一定的稳定水平,以完成后续的加工过程,这与本文选取的刺激特点有关。目前关于运动员视觉加工的研究结果存在很大差异,这些差异可能由于不同研究选取的运动类型、运动员水平或视觉刺激的特征不同所致。
本文还发现专家组的V4区N2出现右半球优势,其左视野潜伏期激活较早。这与以往研究[48−49]支持的视觉功能右半球偏侧性占主导地位的观点一致,但这种优势未体现在本文结果的行为层面,也未在新手组发现。N2是一个与刺激运动过程相关的视觉成分[50],本文中未出现专家和新手之间的N2差异可能是由于视觉刺激为固定的颜色,这与Hülsdünker等[6]在2016年发表的一项针对对比度的研究结果一致。在分析左右视野的结果后发现,右视野诱发了更大的P1波幅和更长的P1潜伏期,左视野诱发了V4区更大的N2波幅和更短的N2潜伏期。P1成分一般与物理刺激的早期加工有关,往往表明注意指向了该感知过程[51]。本文结果验证了视觉功能的左偏向,即对应右半球视觉处理的优势现象[48]。
3.3 乒乓球运动员视觉运动整合在视觉运动转换阶段的优势特征
本文结合前人研究[18]选取BA6区的positivity成分和negativity成分进行分析,结果发现在右视野条件下,专家组的positivity成分潜伏期更长。这与视觉加工阶段P1成分潜伏期结果一致,可能是由于专家左视野(右半球)存在显著优势,导致其在右视野(左半球)的潜伏期较长。在negativity成分上发现了组间差异,专家组诱发了更大的BA6区negativity波幅。这一结果与前人研究[18]结果一致,这可能是由于运动员存在更强的顶叶连通性[52],与新手相比,顶叶与BA6区之间的直接连接可能使运动员的视觉信号更直接有效地转移到运动命令中。Kansaku等[53]在fMRI研究中发现了一个特定的神经网络,它由前运动区、辅助运动区和顶叶组成,所有类型的感觉信号都会在此汇聚并进行下一步运动指令的转换。BA6区negativity的高激活表明运动员在视觉运动转换阶段存在优势,但本文并未发现专家组的BA6区negativity成分有更早的激活,这与前人研究[18]结果不一致,可能是因为实验任务的差异,以往研究没有区分左右手反应。
在视野层面分析BA6区的positivity成分和negativity成分发现了与视觉区P1和N2结果一致的波幅和潜伏期差异,说明视觉运动整合过程中的视觉运动转换阶段同样存在右半球视觉处理的优势现象。在BA6区positivity成分上发现,在左视野情况下右手潜伏期更长,但右视野并未发现类似效应,这与以往研究[44−45]不一致且不符合视觉运动Simon效应,原因可能与刺激位置的呈现会激活同侧运动皮层做出早期准备有关。BA6区positivity成分与早期的无意识感觉偏向抑制有关,在左视野呈现视觉刺激会相应地激活右半球的反应准备,当需要被试用右手做出反应时,右半球的视觉功能优势导致BA6区positivity成分出现得较晚。
3.4 乒乓球运动员视觉运动整合在运动执行阶段的优势特征
本文选取该阶段在BA4区的P2和N2成分进行分析发现,BA4区的N2成分波幅存在显著的组间差异,专家组诱发了更大的N2波幅。这与BA6区negativity波幅结果一致。BA4区与顶叶位置更为接近,专家组的转换信号能够更加直接有效地转移到运动命令中,使运动执行阶段同样产生了更大的N2波幅。这一结果也与Kansaku等[53]发现的特定感觉运动转换网络一致。其余视野结果与上述结果一致,BA4的N2潜伏期在左视野条件下左手短于右手,但在右视野条件下未发现这种现象。结合上述研究结果笔者进一步分析原因发现,右半球可能不仅存在视觉功能优势,还在视觉运动整合的整个阶段皆存在右半球优势。
3.5 乒乓球运动员视觉运动整合的神经振荡水平
本文采用高频alpha节律的ERSP值评估高频alpha节律的振荡水平,即alpha节律越大,则alpha节律的神经振荡强度越低,体现更少的注意资源消耗[54]。结果发现,组别主效应显著,专家组高频alpha节律神经振荡水平低于新手组。研究[55−57]表明,运动员在完成一项专项任务或专项相关的认知任务时,其任务相关皮层的神经振荡水平较低,消耗较少的注意资源,本文结果与前人一致。这表明相比于新手组,乒乓球专家组枕-顶联合区激活水平较低。进一步分析发现,组别、视野和反应手的交互作用显著,表现为在左视野条件下,专家组右手alpha节律的ERSP值显著高于新手组,即专家在左视野右手反应模式下高频alpha节律振荡水平低,在该模式下具有优势,注意资源消耗少。该结果与前人一项针对羽毛球运动员协调运动能力的研究[32]结果不一致。Poliszczuk等[32]2009年评估高水平羽毛球运动员的协调运动能力,发现运动员尽管在左眼上占优势,但其右视野右手反应时间更短、准确性更高。本文分析EEG结果发现,在两组人群中左视野(右半球)均存在显著优势,专家组因为长期的右利手(左半球)训练,其视觉加工过程与右手之间的连接增强,其左右半球的枕-顶联合区连接均有增强,但由于视觉加工的右半球优势,左视野右手条件下的专长效应更显著。
综合以上研究结果,本文发现乒乓球运动员右手(优势手)反应时显著短于未经训练个体,该优势与视野无关,即不管在左视野还是右视野,乒乓球运动员右手(优势手)均存在反应优势;综合分析行为和神经数据后发现,该优势与右半球视觉联合区更早激活、右半球BA6区和初级运动皮层负成分的更大反应有关,同时也体现在视觉运动整合中后期枕-顶联合区神经振荡强度降低上。该结果表明乒乓球运动员视觉运动整合的行为优势与右半球视觉加工和视觉运动转换阶段有关。
4. 结论、不足与展望
本文基于功能偏侧化理论,结合专家-新手范式,考察乒乓球运动员的视觉运动整合优势特征及其神经机制发现:乒乓球运动员右手(优势手)的视觉运动反应时更短;乒乓球运动员的大脑右半球在早期视觉加工阶段对刺激识别更迅速,在视觉运动转换阶段更直接有效;乒乓球运动员在视觉运动整合过程中表现出更少的注意资源消耗,主要体现在右半球的视觉加工和左半球的反应优势上。
本文在已有研究基础上通过功能偏侧化理论进一步探讨了乒乓球运动员视觉运动表现的优势,但仍存在不足之处。①由于专业运动员训练和比赛的影响,高水平被试样本量较少,后续研究建议在更高水平运动群体中进行;②虽然本文对以往范式进行了改进,较为贴近视觉运动整合的研究范式,但脑电实验的特殊性限制了其生态学效度,同时本文主要针对手部的整合行为,未涉及上肢大范围活动,后续研究可以采用虚拟仿真技术,完善视觉刺激和运动任务,将视觉运动的范围扩大,更加详细全面地探索视觉运动整合。
作者贡献声明:漆昌柱:提出论文选题,撰写论文,指导修改论文;作者贡献声明:宋一锐:采集、分析数据;作者贡献声明:王淙一:采集数据,撰写论文。 -
-
[1] ROSSIT S,MCINTOSH R D. Visuomotor control in the healthy and damaged brain[M]// Encyclopedia of behavioral neuroscience. 2nd edition. Amsterdam:Elsevier,2022:570-578
[2] LAHAV O,APTER A,RATZON N Z. Psychological adjustment and levels of self esteem in children with visual-motor integration difficulties influences the results of a randomized intervention trial[J]. Research in Developmental Disabilities,2013,34(1):56-64 doi: 10.1016/j.ridd.2012.07.024
[3] EXNER C E. Hand function in the child:Chapter 12- intervention for children with hand skill problems[M]. Saint Louis:Mosby,2006:239-266
[4] 兰莉,李公正,刘灵. 视觉运动整和不同发育水平儿童脑电功率差异[J]. 中国行为医学科学,2002,11(3):321-322 [5] LEDBERG A,BRESSLER S L,DING M Z,et al. Large-scale visuomotor integration in the cerebral cortex[J]. Cerebral Cortex,2007,17(1):44-62 doi: 10.1093/cercor/bhj123
[6] HÜLSDÜNKER T,STRÜDER H K,MIERAU A. Neural correlates of expert visuomotor performance in badminton players[J]. Medicine and Science in Sports and Exercise,2016,48(11):2125-2134 doi: 10.1249/MSS.0000000000001010
[7] HÜLSDÜNKER T,STRÜDER H K,MIERAU A. The athletes' visuomotor system : Cortical processes contributing to faster visuomotor reactions[J]. European Journal of Sport Science,2018,18(7):955-964 doi: 10.1080/17461391.2018.1468484
[8] ANDO S,KIDA N,ODA S. Central and peripheral visual reaction time of soccer players and nonathletes[J]. Perceptual and Motor Skills,2001,92(3 Pt 1):786-794
[9] ZWIERKO T. Differences in peripheral perception between athletes and nonathletes[J]. Journal of Human Kinetics,2008,19(2008):53-62 doi: 10.2478/v10078-008-0004-z
[10] 李谷静. 舞蹈训练对脑的可塑性影响研究[D]. 成都:电子科技大学,2018:9 [11] DEL PERCIO C,BRANCUCCI A,VECCHIO F,et al. Visual event-related potentials in elite and amateur athletes[J]. Brain Research Bulletin,2007,74(1-3):104-112 doi: 10.1016/j.brainresbull.2007.05.011
[12] DUREY A,SEYDLER R. Perfecting of a ball bounce and trajectories simulation software:In order to predict the consequences of changing table tennis rules[J]. Int J Table Tennis,1994,2:15-32
[13] AKPINAR S,DEVRILMEZ E,KIRAZCI S. Coincidence-anticipation timing requirements are different in racket sports[J]. Perceptual and Motor Skills,2012,115(2):581-593 doi: 10.2466/30.25.27.PMS.115.5.581-593
[14] BHABHOR M K,VIDJA K,BHANDERI P,et al. A comparative study of visual reaction time in table tennis players and healthy controls[J]. Indian Journal of Physiology and Pharmacology,2013,57(4):439-442
[15] AK E,KOÇAK S. Coincidence-anticipation timing and reaction time in youth tennis and table tennis players[J]. Perceptual and Motor Skills,2010,110(3 Pt 1):879-887
[16] CAN S,KILIT B,ARSLAN E,et al. The comparison of reaction time of male tennis players,table tennis players and the ones who don't exercise at all in 10 to 12 age groups[J]. J Phys Educ Sports Sci,2014,8:195-201
[17] KUBA M,KUBOVÁ Z,KREMLÁČEK J,et al. Motion-onset VEPs:Characteristics,methods,and diagnostic use[J]. Vision Research,2007,47(2):189-202 doi: 10.1016/j.visres.2006.09.020
[18] HÜLSDÜNKER T,STRÜDER H K,MIERAU A. Visual motion processing subserves faster visuomotor reaction in badminton players[J]. Medicine and Science in Sports and Exercise,2017,49(6):1097-1110 doi: 10.1249/MSS.0000000000001198
[19] BABILONI C,CARDUCCI F,CINCOTTI F,et al. Human movement-related potentials vs desynchronization of EEG alpha rhythm:A high-resolution EEG study[J]. NeuroImage,1999,10(6):658-665 doi: 10.1006/nimg.1999.0504
[20] STÖRMER V,FENG W F,MARTINEZ A,et al. Salient,irrelevant sounds reflexively induce alpha rhythm desynchronization in parallel with slow potential shifts in visual cortex[J]. Journal of Cognitive Neuroscience,2016,28(3):433-445 doi: 10.1162/jocn_a_00915
[21] LOZE G M,COLLINS D,HOLMES P S. Pre-shot EEG alpha-power reactivity during expert air-pistol shooting:A comparison of best and worst shots[J]. Journal of Sports Sciences,2001,19(9):727-733 doi: 10.1080/02640410152475856
[22] MUTHA P K,HAALAND K Y,SAINBURG R L. The effects of brain lateralization on motor control and adaptation[J]. Journal of Motor Behavior,2012,44(6):455-469 doi: 10.1080/00222895.2012.747482
[23] YIN D Z,WANG X F,ZHANG X Y,et al. Dissociable plasticity of visual-motor system in functional specialization and flexibility in expert table tennis players[J]. Brain Structure and Function,2021,226(6):1973-1990 doi: 10.1007/s00429-021-02304-w
[24] DELPONT E,DOLISI C,SUISSE G,et al. Visual evoked potentials:Differences related to physical activity[J]. International Journal of Sports Medicine,1991,12(3):293-298 doi: 10.1055/s-2007-1024684
[25] MAGNIÉ M N,BERMON S,MARTIN F,et al. Visual and brainstem auditory evoked potentials and maximal aerobic exercise:Does the influence of exercise persist after body temperature recovery?[J]. International Journal of Sports Medicine,1998,19(4):255-259 doi: 10.1055/s-2007-971914
[26] OZMERDIVENLI R,BULUT S,BAYAR H,et al. Effects of exercise on visual evoked potentials[J]. International Journal of Neuroscience,2005,115(7):1043-1050 doi: 10.1080/00207450590898481
[27] ZWIERKO T,OSINSKI W,LUBINSKI W,et al. Speed of visual sensorimotor processes and conductivity of visual pathway in volleyball players[J]. Journal of Human Kinetics,2010,23(2010):21-27 doi: 10.2478/v10078-010-0003-8
[28] GAZZANIGA M S. Cerebral specialization and interhemispheric communication:Does the corpus callosum enable the human condition?[J]. Brain,2000,123(7):1293-1326 doi: 10.1093/brain/123.7.1293
[29] WOLYNSKI B,SCHOTT B H,KANOWSKI M,et al. Visuo-motor integration in humans:Cortical patterns of response lateralisation and functional connectivity[J]. Neuropsychologia,2009,47(5):1313-1322 doi: 10.1016/j.neuropsychologia.2009.01.027
[30] NICHOLLS M E R,BRADSHAW J L,MATTINGLEY J B. Free-viewing perceptual asymmetries for the judgement of brightness,numerosity and size[J]. Neuropsychologia,1999,37(3):307-314 doi: 10.1016/S0028-3932(98)00074-8
[31] VERLEGER R,SPRENGER A,GEBAUER S,et al. On why left events are the right ones:Neural mechanisms underlying the left-hemifield advantage in rapid serial visual presentation[J]. Journal of Cognitive Neuroscience,2009,21(3):474-488 doi: 10.1162/jocn.2009.21038
[32] POLISZCZUK T,MOSAKOWSKA M. Interreactions of peripheral perception and ability of time-movement anticipation in high class competitive badminton players[J]. Studies in Physical Culture & Tourism,2009,16(3):259-265
[33] CABRI J,ALVES F,ARAÚJO D. Book of Abstracts of the 13th Annual Congress of the European College of Sport Science[C]. Estoril:European College of Sport Science,2008:459
[34] GONZALEZ C L R,VAN ROOTSELAAR N A,GIBB R L. Sensorimotor lateralization scaffolds cognitive specialization[J]. Progress in Brain Research,2018,238:405-433
[35] CLOWER D M,HOFFMAN J M,VOTAW J R,et al. Role of posterior parietal cortex in the recalibration of visually guided reaching[J]. Nature,1996,383:618-621 doi: 10.1038/383618a0
[36] DANCKERT J,FERBER S,GOODALE M A. Direct effects of prismatic lenses on visuomotor control:An event-related functional MRI study[J]. The European Journal of Neuroscience,2008,28(8):1696-1704 doi: 10.1111/j.1460-9568.2008.06460.x
[37] GHILARDI M F,GHEZ C,DHAWAN V,et al. Patterns of regional brain activation associated with different forms of motor learning[J]. Brain Research,2000,871(1):127-145 doi: 10.1016/S0006-8993(00)02365-9
[38] KRAKAUER J W,GHILARDI M F,MENTIS M,et al. Differential cortical and subcortical activations in learning rotations and gains for reaching:A PET study[J]. Journal of Neurophysiology,2004,91(2):924-933 doi: 10.1152/jn.00675.2003
[39] GREFKES C,RITZL A,ZILLES K,et al. Human medial intraparietal cortex subserves visuomotor coordinate transformation[J]. NeuroImage,2004,23(4):1494-1506 doi: 10.1016/j.neuroimage.2004.08.031
[40] DIEDRICHSEN J,HASHAMBHOY Y,RANE T,et al. Neural correlates of reach errors[J]. Journal of Neuroscience,2005,25(43):9919-9931 doi: 10.1523/JNEUROSCI.1874-05.2005
[41] GÜNTÜRKÜN O,OCKLENBURG S. Ontogenesis of lateralization[J]. Neuron,2017,94(2):249-263 doi: 10.1016/j.neuron.2017.02.045
[42] EVERTS R,LIDZBA K,WILKE M,et al. Strengthening of laterality of verbal and visuospatial functions during childhood and adolescence[J]. Human Brain Mapping,2009,30(2):473-483 doi: 10.1002/hbm.20523
[43] HEDGE A,MARSH N W A. The effect of irrelevant spatial correspondences on two-choice response-time[J]. Acta Psychologica,1975,39(6):427-439 doi: 10.1016/0001-6918(75)90041-4
[44] 王力,张栎文,张明亮,等. 视觉运动Simon效应和认知Simon效应的影响因素及机制[J]. 心理科学进展,2012,20(5):662-671 [45] PROCTOR R W,MILES J D,BARONI G. Reaction time distribution analysis of spatial correspondence effects[J]. Psychonomic Bulletin & Review,2011,18(2):242-266
[46] LUCK S J,KAPPENMAN E S. The Oxford handbook of event-related potential components [M]. Oxford:Oxford University Press,2013
[47] THOMAS N G,HARDEN L M,ROGERS G G. Visual evoked potentials,reaction times and eye dominance in cricketers[J]. Journal of Sports Medicine and Physical Fitness,2005,45(3):428-433
[48] JEWELL G,MCCOURT M E. Pseudoneglect:A review and meta-analysis of performance factors in line bisection tasks[J]. Neuropsychologia,2000,38(1):93-110 doi: 10.1016/S0028-3932(99)00045-7
[49] JONAS J,FRISMAND S,VIGNAL J P,et al. Right hemispheric dominance of visual phenomena evoked by intracerebral stimulation of the human visual cortex[J]. Human Brain Mapping,2014,35(7):3360-3371 doi: 10.1002/hbm.22407
[50] HOFFMANN M B,UNSÖLD A S,BACH M. Directional tuning of human motion adaptation as reflected by the motion VEP[J]. Vision Research,2001,41(17):2187-2194 doi: 10.1016/S0042-6989(01)00112-2
[51] HILLYARD S A,VOGEL E K,LUCK S J. Sensory gain control (amplification) as a mechanism of selective attention:Electrophysiological and neuroimaging evidence[J]. Philosophical Transactions of the Royal Society of London:Series B,Biological Sciences,1998,353(1373):1257-1270
[52] DI X,ZHU S H,JIN H,et al. Altered resting brain function and structure in professional badminton players[J]. Brain Connectivity,2012,2(4):225-233 doi: 10.1089/brain.2011.0050
[53] KANSAKU K,HANAKAWA T,WU T,et al. A shared neural network for simple reaction time[J]. NeuroImage,2004,22(2):904-911 doi: 10.1016/j.neuroimage.2004.02.006
[54] CHAIRE A,BECKE A,DÜZEL E. Effects of physical exercise on working memory and attention-related neural oscillations[J]. Frontiers in Neuroscience,2020,14:239 doi: 10.3389/fnins.2020.00239
[55] BAUMEISTER J,REINECKE K,LIESEN H,et al. Cortical activity of skilled performance in a complex sports related motor task[J]. European Journal of Applied Physiology,2008,104(4):625-631 doi: 10.1007/s00421-008-0811-x
[56] BABILONI C,MARZANO N,INFARINATO F,et al. "Neural efficiency" of experts brain during judgment of actions:A high-resolution EEG study in elite and amateur karate athletes[J]. Behavioural Brain Research,2010,207(2):466-475 doi: 10.1016/j.bbr.2009.10.034
[57] 魏瑶,李安民. 运动员专项动作识别的神经效率:来自EEG节律去同步化和相干性证据[J]. 天津体育学院学报,2018,33(4):311-320





 下载:
下载: