PGC-1α-mediated Muscle/brain Crosstalk and Antidepressant Effects of Exercise—Reflaction and Prospect from Integrative Biology
-
摘要: 针对抑郁症的研究表明,骨骼肌过氧化物酶体增殖活化受体γ辅助活化因子1α(PGC-1α)通过基因转录调控的途径改善外周色氨酸代谢、减轻中枢炎症反应、增加脑源性神经营养因子的表达,从而远程作用于脑组织发挥抗抑郁效应。基于整合生物学理论,综述骨骼肌PGC-1α在运动抗抑郁中的重要作用及其介导机制,提出PGC-1α介导的外周—中枢"对话"模式。针对其他神经退行性疾病的运动干预作用,提出"肌脑Crosstalk"的可能途径。
-
关键词:
- 抑郁 /
- 运动 /
- PGC-1α /
- 肌脑Crosstalk /
- 整合生物学
Abstract: The recent studies on depression indicated that skeletal muscle peroxisome proliferator-activated receptor γ activating factor 1α (PGC-1α) improves tryptophan metabolism, reduces the central nervous inflammation, and increases the expression of brain-derived neurotrophic factor, thereby exerting antidepressant effects.Based on theories of integrative biology, this review describes the role of skeletal muscle PGC-1α in the antidepressant effects of exercise and the related underlying mechanisms, and proposes a research hypothesis of PGC-1α-mediated crosstalk between skeletal muscle and brain.In addition, some possible pathways of muscle-brain crosstalk are suggested for the role of exercise in the other neurodegenerative diseases.-
Keywords:
- depression /
- exercise /
- PGC-1α /
- muscle/brain Crosstalk /
- integrative biology
-
运动整合生物学认为, 运动是对人体内环境稳态的挑战, 打破了机体各细胞、组织和器官的原有平衡并使其作出应答。多层次的整合和应答为机体建立一个新的动态平衡, 以提高肌肉能量和氧气供应, 满足肌肉收缩需要。这种系统稳态的扰乱和重塑不仅惠及骨骼肌本身, 还给人体多个器官和系统带来积极效应[1]。肌肉不仅是运动器官, 也是系统代谢的重要调节器官, 运动对肌外器官和系统的积极效应都可以从肌肉中找到答案[2]。目前, 关于运动与脑健康的研究, 对其机制的解释主要聚焦于中枢系统的适应性变化, 鲜有报道肌肉活动与大脑适应之间的分子联系。最新研究发现, 骨骼肌的运动敏感基因PGC-1α介导外周代谢调节, 外周代谢产物可经循环途径作用于脑组织, 参与抗抑郁机制[3]。基于整合生物学思路和这一重大发现, 本文重点讨论PGC-1α发挥抗抑郁作用的间接效应和可能机制, 从而深入阐明肌肉活动与大脑适应之间的分子连接通路。基于PGC-1α介导的“外周—中枢对话(肌脑Crosstalk)”机制, 本文考证了其他神经退行性疾病与肌肉活动之间的分子联系, 从一般规律角度提出了“肌脑Crosstalk”的三大可能途径, 为“运动健脑”的有关研究提供思路。
1. PGC-1α是抗抑郁的新型信号调节因子
过氧化物酶体增殖活化受体γ辅助活化因子1α(Peroxisome proliferator-activated receptor-γ coactivator-1α, PGC-1α)是一种核辅助激活因子, 它通过对转录因子的辅助作用激活下游基因表达。PGC-1α可以与过氧化物酶体增殖活化受体γ(PPARγ)、雌激素受体α(ERRα)等多种核受体结合, 参与目的基因转录及转录后的剪接修饰过程[4]。PGC-1α主要表达于线粒体丰富和氧化代谢活跃的组织中, 如骨骼肌、肝和大脑等组织。在生理状态下, PGC-1α表达水平较低, 当组织受到外界环境刺激, 如脂肪组织受到寒冷刺激、肌肉组织受到运动刺激时, PGC-1α的表达迅速提高[5-6]。PGC-1α激活的下游基因主要调控线粒体生物发生、氧化代谢、胰岛素敏感性、肌纤维类型转换等[7-9]。神经元PGC-1α的表达可能与抑郁症发病有关。敲除PGC-1α基因影响多巴胺能神经元功能和神经元小清蛋白的表达[10-11]; PGC-1α过表达提高了海马BDNF表达, 并促进海马神经发生[12]。重要的是, 骨骼肌PGC-1α能介导抗抑郁效应。骨骼肌PGC-1α过表达能抵抗应激诱发的抑郁行为[3]。因此, PGC-1α可能成为抗抑郁的新型信号调节因子。
2. 骨骼肌PGC-1α介导的抗抑郁机制
2.1 骨骼肌PGC-1α调节犬尿氨酸代谢
关于抑郁症病理机制的单胺假说认为, 抑郁症是由中枢神经系统中5-羟色胺、多巴胺等单胺类神经递质降低所致[13]。在生理状态下, 5-羟色胺(5-HT)的生物合成以色氨酸为原材料。色氨酸经色氨酸羟化酶催化首先生成五羟色氨酸, 再经五羟色氨酸脱羧酶催化成5-HT; 而在炎症或应激的状态下, 色氨酸循犬尿氨酸(kynurenine, KYN)途径代谢[14-15], 从而竞争性拮抗5-HT的生物合成, 影响神经递质系统功能[16]。色氨酸循犬尿氨酸途径代谢的下游产物3-羟基犬尿氨酸(3-hydroxykynurenine, 3HKYN)和犬尿喹啉酸(kynurenic acid, KYNA)极具神经毒性。临床研究发现, KYN及其代谢物3HKYN、KYNA的水平与抑郁症高度相关[17]。3HKYN和KYNA在脑内的过度堆积可诱导中枢炎症、突触功能障碍以及影响神经元的再生与退化[18]。因此, 犬尿氨酸代谢途径紊乱被认为是介导抑郁症的重要机制[19]。脑内KYN约60%来自外周, 与KYNA不同, KYN能快速透过血脑屏障[20], 故抑制外周KYN进入脑组织或降低外周KYN水平可能是治疗抑郁症的一条途径。
骨骼肌PGC-1α可通过调节外周KYN代谢改善应激诱导的抑郁行为, 其中犬尿氨酸氨基转移酶(kynurenine aminotransferase, KAT)发挥重要作用[3]。KAT是催化KYN降解为KYNA的一类酶[21], 脑内KAT过度表达或活性提高, 可以使KYN转换为更具神经毒性的KYNA, 进一步加大对神经元的损害, 从而诱发抑郁症[19]。在外周组织中, KAT的活性或表达提高促进KYN降解为难以透过血脑屏障的KYNA, 减少KYN进入脑组织。KAT表达受PGC-1α基因调控。提高骨骼肌PGC-1α1表达, 小鼠骨骼肌KAT表达随之提高, 并抵抗应激诱发的抑郁行为。相反, 骨骼肌PGC-1α1特异性敲除小鼠KAT表达水平降低, 进行KYN处理后表现出抑郁行为[3]。这表明骨骼肌PGC-1α1激活了KAT的表达, 从而促进外周组织中KYN向KYNA的转化, 因此缓解了KYN进入脑组织诱发的神经炎症和突触功能障碍。PGC-1α1对KYN代谢的调控证实了骨骼肌与脑组织之间存在一种“对话”机制, 揭示了骨骼肌PGC-1α对抑郁症以及脑功能的改善性调节通路。
2.2 骨骼肌PGC-1α调节炎症反应
抑郁症是一种精神神经免疫失调, 其发病与炎症反应激活有关[22]。临床研究发现, 抑郁症患者外周和脑脊液中促炎性细胞因子及其他炎症标记物水平升高[23]。促炎性细胞因子可诱导人类和啮齿动物产生抑郁行为, 急性注射内毒素和伤寒疫苗可以使人类产生一系列行为变化, 包括抑郁心境、疲劳和认知障碍[24-26]。腹腔注射脂多糖6 h后小鼠血浆IL-1和IL-6水平显著升高, 48 h后脑内干扰素刺激基因(interferon-stimulated genes, ISGs)表达上调, 中枢神经系统出现免疫激活状态并伴有抑郁行为[27]。因此, 外周促炎性细胞因子水平升高可能导致抑郁, 但外周细胞因子不易直接穿越血脑屏障, 其机制可能是促炎性细胞因子通过某种特殊途径作用于脑组织, 引起中枢系统免疫激活。这些途径包括:① 神经途径[28]。外周释放的细胞因子刺激迷走神经, 激活小胶质细胞, 激活的小胶质细胞在脑组织中释放新的细胞因子。② 体液途径[29]。细胞因子激活脉络丛和脑室周围器官处的白细胞引发局部免疫反应, 使细胞因子经过血脑屏障薄弱处扩散进入脑组织。③ 细胞途径[30]。某些促炎性细胞因子(如TNFα)刺激小胶质细胞产生单核细胞趋化蛋白-1(MCP-1), MCP-1募集外周激活的单核细胞直接进入血脑屏障引发中枢炎症。此外, 外周细胞因子也有可能通过脑膜淋巴管作用于大脑[31]。一旦外周促炎细胞因子信号传入脑组织, 就能影响神经递质代谢、神经内分泌以及相应脑区的活动, 从而参与抑郁症的病理过程[32]。因此, 抑制外周免疫系统激活, 减少外周促炎性细胞因子进入脑组织, 是改善抑郁的另一条途径。
研究表明, 骨骼肌PGC-1α可以营造外周的抗炎环境。通过腺病毒载体提高骨骼肌PGC-1α水平, IL-6、TNFα表达降低[33]; 相反, 骨骼肌特异性敲除PGC-1α的小鼠IL-6和TNFα表达增加, 血浆IL-6水平升高[33], 说明PGC-1α能抑制促炎性细胞因子产生[34]。此外, 对肌肉特异性PGC-1α转基因小鼠进行脂多糖处理后, 骨骼肌抗炎性细胞因子(CCL1、CCL22、IL-1Ra、IL-10) mRNA水平升高, 而促炎性细胞因子的表达受到强烈抑制, 说明PGC-1α在骨骼肌中创造了一种抗炎环境[35]。进一步研究发现, C2C12肌管内促炎性细胞因子的表达需要TNFα、Toll样受体激动剂以及饱和游离脂肪酸等促炎性激活物的激活作用, 而PGC-1α和PGC-1β的表达可以阻止这些促炎性基因的激活。这是由于PGC-1α降低了p65对NF-κB靶基因的激活能力; PGC-1α通过抑制p65磷酸化, 进而抑制NF-κB的活性[36]。因此, PGC-1α通过NF-κB通路减少骨骼肌促炎细胞因子的表达和释放, 在外周营造了一种抗炎环境, 有利于缓解中枢炎症反应, 在一定程度上降低了外周促炎性细胞因子诱发抑郁的风险。
除了抑制外周免疫系统激活, 骨骼肌PGC-1α还可能通过其他途径减轻中枢炎症发挥抗抑郁作用。研究表明, 小鼠经历5周的慢性应激后, 骨骼肌特异性PGC-1α1转基因小鼠的抑郁程度明显低于野生型小鼠, 并且转基因小鼠海马组织中促炎性细胞因子(TNFα、IL-1β、IL-6等)mRNA水平降低, 抗炎性细胞因子(IL-10、IL-4) mRNA水平升高, 而骨骼肌中IL-1和IL-6 mRNA水平无显著变化, 甚至出现TNFα、IL-1β表达升高[3]。该研究提示, PGC-1α1转基因小鼠抵抗应激诱导抑郁行为, 但未降低外周促炎性细胞因子表达。一种可能是, 通过PGC-1α1/KAT通路减少外周KYN进入大脑, 从而抑制了KYN代谢产物所致的中枢炎症激活[3]。还有一种可能是, PGC-1α诱导骨骼肌产生抗炎性细胞因子, 通过上述特殊途径直接调节大脑NF-κB信号发挥抗炎、抗抑郁作用[35-36]。
2.3 骨骼肌PGC-1α调节脑源性神经营养因子
脑源性神经营养因子(Brain-derived neurotrophic factor, BDNF)是一种分泌蛋白, 参与维持树突存活, 调节突触可塑性, 诱导神经发生, 在抑郁症中起重要作用[37-38]。临床研究表明, 重度抑郁患者血清和海马组织中BDNF及其受体TrkB水平降低[39-41], 多种应激可降低海马中BDNF通路的活动, 而抗抑郁药物可增强该通路活动发挥抗抑郁作用[42]。动物研究发现, 应激抑郁动物模型海马组织中BDNF水平下降[43]; 而BDNF缺乏的小鼠模型表现出应激敏感性提高和抑郁行为[44-45]。因此, BDNF是抗抑郁治疗中的又一个重要靶点。
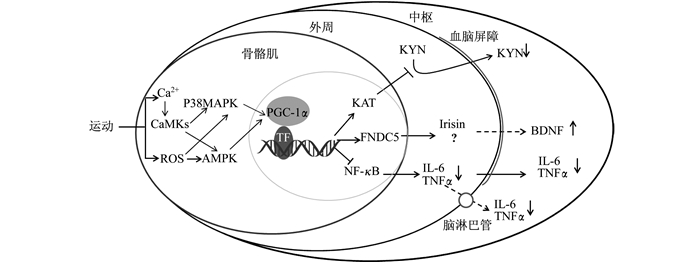
研究表明, 骨骼肌PGC-1α可通过特定途径增加海马组织中BDNF的表达。在这一途径中, 一种名为FNDC5 (Fibronectin type Ⅲ domain containing 5) 的蛋白起重要介导作用[12]。FDNC5依赖PGC-1α表达, 在骨骼肌、脂肪组织中均有表达[46]。FNDC5在蛋白水解酶的作用下可裂解成小分子蛋白进入血液循环, Irisin是FNDC5的裂解产物之一。研究表明, Irisin以剂量依赖方式调节海马神经发生, 生理浓度范围(5~10 nmol/L)的Irisin不影响小鼠H19-7海马神经元细胞增殖, 但50~100 nmol/L浓度的Irisin显著促进H19-7海马神经元细胞增殖[47]。这表明骨骼肌PGC-1α对大脑的改善性调节作用可能是通过激活FNDC5基因表达, 进而促进骨骼肌分泌Irisin介导的。研究发现, 循环Irisin具有激活其他组织中PGC-1α基因的能力, 例如Irisin激活脂肪细胞PGC-1α基因促进白色脂肪棕色化[12]。因此, 有研究认为, Irisin或FNDC5的其他裂解产物可能通过激活脑组织PGC-1α发挥抗抑郁作用[48]。在海马组织中, PGC-1α可通过ERRα调控FNDC5和BDNF的表达。提高PGC-1α可以使海马组织中FNDC5和BDNF表达均升高, 敲除PGC-1α基因发现FNDC5和BDNF水平均下降。在皮层神经元细胞培养实验中, FDNC5过表达引起BDNF基因表达上调, 下调FNDC5基因后BDNF表达也随之下降[12]。由此推测, 大脑中存在PGC-1α/FNDC5/BDNF通路。骨骼肌PGC-1α诱导的FNDC5经裂解为Irisin进入血液循环, 穿越血脑屏障后激活脑组织中的PGC-1α, 通过PGC-1α/FNDC5/BDNF促进神经发生, 从而发挥抗抑郁作用。因此, 骨骼肌PGC-1α可介导产生某些神经保护功能因子(如Irisin), 通过血液循环与大脑之间发生“对话”, 从而实现对脑组织BDNF的表达调控, 进而改善抑郁行为。
3. 运动诱导骨骼肌PGC-1α表达与抑郁行为的改善
骨骼肌PGC-1α可调节KYN代谢、外周炎症因子以及中枢BDNF的表达从而间接发挥抗抑郁效应。由于骨骼肌PGC-1α是一种运动敏感性基因, 在运动中被强烈激活[8], 运动抗抑郁机制中肌肉活动与大脑适应之间的分子联系很可能是通过PGC-1α实现的。运动不仅可以提高PGC-1α的表达, 还可以通过多条信号通路调节PGC-1α的活性[8]。骨骼肌收缩刺激肌浆网释放Ca2+, 激活钙调素依赖性钙调磷酸酶(calcineurin A, can)和钙调素依赖性蛋白激酶(calmodulin-dependent protein kinases, CaMKs), 促进PGC-1α表达; 运动引起骨骼肌活性氧(ROS)生成增多, 通过AMPK、p38MAPK途径激活PGC-1α[49]。
运动改善抑郁行为在抑郁症患者与动物模型中都得了广泛证实。基于骨骼肌PGC-1α介导抗抑郁的3个可能途径以及PGC-1α的运动敏感性, 运动诱导骨骼肌PGC-1α的表达或激活可能是改善抑郁的内置机制。① 运动可能通过PGC-1α/ KAT通路平衡骨骼肌KYN代谢, 减轻KYN的神经毒害作用, 从而发挥抗抑郁效应。研究发现, 有氧运动提高了健康人体骨骼肌PGC-1α和KAT1-4的表达[3]。自主跑轮运动增加了野生型小鼠骨骼肌PGC-1α和KAT1、3、4的表达, 血浆中KYN的代谢产物KYNA水平提高[3]。这表明运动激活的PGC-1α/KAT通路具有调节外周KYN代谢的功能, 但运动的抗抑郁效应是否完全依赖于此有待进一步考证。② 运动可能激活骨骼肌PGC-1α, 降低外周炎症激活诱发抑郁的风险。Kohut等[50]研究发现, 运动通过降低白介素(IL-6、IL-18) 和TNFα水平改善应激诱发的抑郁行为。运动显著降低抑郁患者血浆IL-1β、IL-6和TNFα水平, 并改善抑郁症状[51]。运动对外周炎症反应的调控作用与骨骼肌PGC-1α的激活有关。运动提高骨骼肌PGC-1α的表达, 降低外周炎症因子水平, 从而缓解系统性炎症反应[34]。③ 运动可能提高骨骼肌PGC-1α的表达, 促进骨骼肌分泌FNDC5/Irisin, 从而发挥抗抑郁效应。研究发现, 运动诱导骨骼肌分泌FNDC5/Irisin依赖于PGC-1α的激活[46]。长期运动的人群血浆中的Irisin显著高于不运动人群[52]。Wrann等[12]研究发现, 运动增加了骨骼肌和海马组织中FNDC5的表达, 海马组织中BDNF表达提高。激活小鼠肝脏FNDC5基因也提高了海马组织BDNF水平。这说明运动可通过激活PGC-1α, 促进骨骼肌分泌FDNC5/Irisin, 循环Irisin以远距分泌的形式作用于脑组织发挥神经保护作用。然而, 关于Irisin的研究仍存在争议, 血液Irisin来源途径较多, 目前尚不能证实运动引起的循环Irisin升高主要来源于骨骼肌、脂肪组织还是其他组织。总之, 运动诱导骨骼肌PGC-1α表达或激活, 具有调节外周犬尿氨酸代谢、降低外周炎症反应、分泌神经保护因子等潜在作用, 通过缓解神经毒性、降低中枢炎症反应和促进海马神经发生3条路径发挥抗抑郁效应。
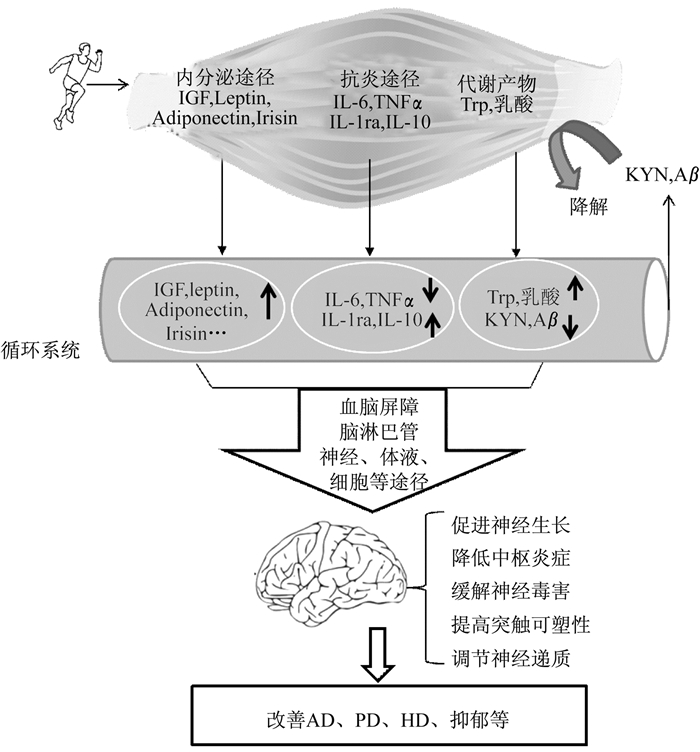
4. 骨骼肌PGC-1α介导的外周—中枢“对话”模式
对骨骼肌PGC-1α介导的运动抗抑郁路径进行分析, PGC-1α介导的外周—中枢“对话”包含3种方式(图 1):① 运动上调骨骼肌PGC-1α, 使骨骼肌减少神经毒害因子(如KYN)向血液循环排放; ② 运动提高骨骼肌PGC-1α的表达, 抑制外周炎症激活, 减少外周促炎性细胞因子作用于大脑; ③ 运动上调骨骼肌PGC-1α, 促使骨骼肌分泌神经保护因子(如Irisin), 从而远程激活大脑分泌神经营养因子(如BDNF)。此外, 运动上调PGC-1α, 能促进骨骼肌分泌抗炎性细胞因子(如IL-10、IL-4);抗炎性细胞因子经过血液循环、血脑屏障或脑膜淋巴管进入脑组织发挥神经保护作用。无论哪一种途径, 骨骼肌PGC-1α均扮演转录辅激活因子角色, 通过对靶基因表达的调控, 向脑组织传递神经功能改善性调节信号。
运动抗抑郁的外周—中枢“对话”模式不仅仅涉及PGC-1α, 还涉及很多肌肉因子(Myokine)、炎症细胞因子、代谢产物、外周神经毒性因子及其相互之间的激活或拮抗作用。PGC-1α介导运动抗抑郁的外周—中枢“对话”模式可能具有以下特征:① 对运动敏感的骨骼肌基因或蛋白可能是外周与中枢“对话”的发起者; ② 该蛋白能比较广泛地调控下游基因表达, 从而调节骨骼肌代谢、炎症和内分泌; ③ 骨骼肌产生的代谢产物、炎症因子、运动因子等, 最终能通过血液循环、血脑屏障或其他特殊途径作用于中枢; ④ 运动抗抑郁机制可能涉及缓解神经毒性, 抑制神经炎症, 以及维持和促进神经生长。基于PGC-1α对运动应激的敏感性, PGC-1α可能成为运动抗抑郁机制的启动因子。
5. 运动健脑的肌脑Crosstalk机制——基于整合生物学的思考
受PGC-1α介导运动抗抑郁路径的启发, 本文进一步考证了运动改善阿尔兹海默病(Alzheimer’s disease, AD)、帕金森氏病(Parkinson’s disease, PD)、亨廷顿氏病(Huntington’s disease, HD)等多种神经退行性疾病的肌脑Crosstalk机制, 从中总结了运动发挥健脑作用的一般规律或途径(图 2)。
(1) 运动通过骨骼肌内分泌功能实现肌脑Crosstalk。运动促进骨骼肌分泌胰岛素样生长因子(insulin-like growth factor, IGF), IGF可通过血液循环进入脑组织, 促进海马齿状回细胞增殖、BDNF基因表达。运动对AD和PD患者认知和记忆功能的改善作用可能与骨骼肌分泌的IGF有关[53-55]。运动还可以刺激骨骼肌分泌肌源性脂肪因子, 如瘦素和脂联素, 并通过远距分泌作用于其他器官[56]。研究认为, 瘦素可透过血脑屏障, 逆转PD动物模型脑内多巴胺神经元丢失[57]。瘦素还可以降低tau蛋白磷酸化、抑制淀粉样蛋白的形成过程, 从而改善AD动物模型的认知功能[58]。运动还可以诱导外周脂联素水平升高, 脂联素透过血脑屏障与海马组织上的脂联素受体1(Adiponectin receptor 1, ADNR1) 结合, 激活ADNR1/AMPK信号通路促进海马神经发生[59]。脂联素还可以调节AD相关的蛋白激酶和磷酸化酶的活性, 影响tau蛋白的磷酸化水平, 为AD的病理研究和治疗提供了靶点[60]。此外, 脂联素还可以保护海马神经元抵抗兴奋性中毒, 而神经元兴奋性中毒与AD、PD和HD发病有关[61-64]。因此, 运动刺激下的骨骼肌能分泌多种信号蛋白作用于脑组织。
(2) 运动通过骨骼肌抗炎功能实现肌脑Crosstalk。中枢炎症反应被认为是多种神经退行性疾病的典型表征, 外周炎症因子可能通过神经、体液、细胞趋化、淋巴管多种途径导致中枢炎症。长期运动抑制骨骼肌分泌促炎性细胞因子IL-6, 降低外周循环IL-6水平, 从而减少IL-6进入大脑[65]。IL-6还可以介导运动的抗炎效果, IL-6可抑制促炎性细胞因子TNFα的表达[66], 促进抗炎性细胞因子IL-1ra、IL-10的表达[67], 抗炎性细胞因子可能通过血脑屏障或脑膜淋巴管进入脑组织, 减轻中枢炎症反应。因此, 运动刺激下的骨骼肌可作为抗炎器官抵抗中枢炎症反应, 从而保护脑组织。
(3) 运动通过骨骼肌代谢产物介导肌脑Crosstalk。运动中骨骼肌产生大量代谢产物, 其中一些小分子物质可透过血脑屏障, 进入中枢神经系统发挥重要作用, 如乳酸和色氨酸等。乳酸可以调节神经元中NMDA受体活性促进神经元可塑性相关基因表达, 改善认知和记忆功能[68]。色氨酸是长时间运动中支链氨基酸的下游产物, 同时它又是脑内5-HT的前体, 急性运动和长期运动均能提高脑内5-HT的水平, 缓解抑郁症状[69-70]。其机制可能是长时间运动使血浆支链氨基酸氧化增加, 其下游产物游离色氨酸浓度相对上升, 进入脑内的游离色氨酸增多, 代谢产生的5-HT随之增加, 在一定程度上弥补抑郁患者脑内5-HT不足。另外, 运动促使骨骼肌成为保护大脑的血液清道夫。如前文所述, 运动可以使骨骼肌KAT表达提高, 从而减少血液中KYN进入脑组织[3]。外周循环的β淀粉样蛋白(amyloid-β, Aβ)是诱导AD患者脑内淀粉样蛋白沉积机制之一[71]。脑啡肽是Aβ的一种降解酶, 在外周组织中也有表达, 提高血浆分泌型脑啡肽可以使血浆和脑内Aβ水平降低[72]。提高肌肉中脑啡肽水平使血浆中Aβ有所下降, 虽无显著性, 但脑内Aβ水平发生了显著性降低[73]。因此, 运动可能促进骨骼肌降解血液中某些对大脑有害的物质, 从而发挥神经保护作用。
6. 小结与展望
PGC-1α是重要的运动敏感基因。运动提高骨骼肌PGC-1α的表达或活性, 以转录辅激活作用调节外周犬尿氨酸代谢、炎症反应和骨骼肌内分泌, 进而通过多种途径作用于脑组织, 以外周—中枢“对话”的形式缓解神经毒性、降低中枢炎症反应、促进神经生长, 进而发挥抗抑郁效应。基于整合生物学的基本思路, 对PGC-1α介导的外周—中枢“对话”模式进行分析, 提出了运动改善神经系统疾病的3种“肌脑Crosstalk”方式。虽然从现有文献中找到了肌脑Crosstalk的有力依据, 但仍有几个问题亟待进一步研究和探索:① 骨骼肌分泌物、外周炎症因子如何作用于脑组织?骨骼肌分泌物数量众多, 但目前只确定少数分泌物能作用于脑组织。未来研究需要进一步筛选可能透过血脑屏障的小分子或进一步探索血脑屏障上的相应受体。另外, 随着脑膜淋巴管的发现, 未来研究将进一步确定外周炎症因子诱导中枢炎症的作用机制, 这对确定外周炎症与抑郁关系, 以及探索运动抗抑郁的炎症机制具有重要意义。② 运动能激活骨骼肌多种基因, 但目前从这些基因中筛选出具有介导肌脑Crosstalk功能的并不多。深入探讨和解决这些问题, 将能更深层次地挖掘运动健脑的整合生物学规律。
-
-
[1] Hawley J A, Hargreaves M, Joyner M J, et al.Integrative biology of exercise[J].Cell, 2014, 159(4):738-749 doi: 10.1016/j.cell.2014.10.029
[2] Baskin K K, Winders B R, Olson E N.Muscle as a "mediator" of systemic metabolism[J].Cell Metabolism, 2015, 21(2):237-248 doi: 10.1016/j.cmet.2014.12.021
[3] Agudelo L Z, Femenia T, Orhan F, et al.Skeletal muscle PGC-1alpha1 modulates kynurenine metabolism and mediates resilience to stress-induced depression[J].Cell, 2014, 159(1):33-45 doi: 10.1016/j.cell.2014.07.051
[4] Wallberg A E, Yamamura S, Malik S, et al.Coordination of p300-mediated chromatin remodeling and TRAP/mediator function through coactivator PGC-1alpha[J].Mol Cell, 2003, 12(5):1137-1149 doi: 10.1016/S1097-2765(03)00391-5
[5] Puigserver P, Wu Z, Park C W, et al.A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis[J].Cell, 1998, 92(6):829-839 doi: 10.1016/S0092-8674(00)81410-5
[6] Pilegaard H, Saltin B, Neufer P D.Exercise induces transient transcriptional activation of the PGC-1alpha gene in human skeletal muscle[J].J Physiol, 2003, 546(Pt 3):851-858 https://www.researchgate.net/publication/8393188_Exercise_induces_transient_transcriptional_activation_of_the_PGC-1alpha_gene_in_human_skeletal_muscle
[7] Spiegelman B M.Transcriptional control of energy homeostasis through the PGC1 coactivators[J].Novartis Found Symp, 2007, 286:3-203 doi: 10.1002/SERIES1767
[8] Lira V A, Benton C R, Yan Z, et al.PGC-1alpha regulation by exercise training and its influences on muscle function and insulin sensitivity[J].Am J Physiol Endocrinol Metab, 2010, 299(2):E145-E161 http://www.biomedsearch.com/nih/PGC-1alpha-REGULATION-BY-EXERCISE/20371735.html
[9] Ruas J L, White J P, Rao R R, et al.A PGC-1alpha isoform induced by resistance training regulates skeletal muscle hypertrophy[J].Cell, 2012, 151(6):1319-1331 doi: 10.1016/j.cell.2012.10.050
[10] Lucas E K, Markwardt S J, Gupta S, et al.Parvalbumin deficiency and GABAergic dysfunction in mice lacking PGC-1alpha[J].J Neurosci, 2010, 30(21):7227-7235 doi: 10.1523/JNEUROSCI.0698-10.2010
[11] Ma D, Li S, Lucas E K, et al.Neuronal inactivation of peroxisome proliferator-activated receptor gamma coactivator 1alpha (PGC-1alpha) protects mice from diet-induced obesity and leads to degenerative lesions[J].J Biol Chem, 2010, 285(50):39087-39095 doi: 10.1074/jbc.M110.151688
[12] Wrann C D, White J P, Salogiannnis J, et al.Exercise induces hippocampal BDNF through a PGC-1α/FNDC5 pathway[J].Cell Metabolism, 2013, 18(5):649-659 doi: 10.1016/j.cmet.2013.09.008
[13] Krishnan V, Nestler E J.The molecular neurobiology of depression[J].Nature, 2008, 455(7215):894-902 doi: 10.1038/nature07455
[14] Zunszain P A, Anacker C, Cattaneo A, et al.Glucocorticoids, cytokines and brain abnormalities in depression[J].Prog Neuropsychopharmacol Biol Psychiatry, 2011, 35(3):722-729 doi: 10.1016/j.pnpbp.2010.04.011
[15] Liao M, Pabarcus M K, Wang Y, et al.Impaired dexamethasone-mediated induction of tryptophan 2, 3-dioxygenase in heme-deficient rat hepatocytes:Translational control by a hepatic eIF2alpha kinase, the heme-regulated inhibitor[J].J Pharmacol Exp Ther, 2007, 323(3):979-989 doi: 10.1124/jpet.107.124602
[16] Liu W, Sheng H, Xu Y, et al.Swimming exercise ameliorates depression-like behavior in chronically stressed rats:Relevant to proinflammatory cytokines and IDO activation[J].Behav Brain Res, 2013, 242:110-116 doi: 10.1016/j.bbr.2012.12.041
[17] Claes S, Myint A M, Domschke K, et al.The kynurenine pathway in major depression:Haplotype analysis of three related functional candidate genes[J].Psychiatry Res, 2011, 188(3):355-360 doi: 10.1016/j.psychres.2011.03.012
[18] Myint A M, Kim Y K.Network beyond IDO in psychiatric disorders:Revisiting neurodegeneration hypothesis[J].Prog Neuropsychopharmacol Biol Psychiatry, 2014, 48:304-313 doi: 10.1016/j.pnpbp.2013.08.008
[19] Schwarcz R, Bruno J P, Muchowski P J, et al.Kynurenines in the mammalian brain:When physiology meets pathology[J].Nature Reviews Neuroscience, 2012, 13(7):465-477 doi: 10.1038/nrn3257
[20] Gal E M, Sherman A D.L-kynurenine:Its synthesis and possible regulatory function in brain[J].Neurochem Res, 1980, 5(3):223-239 doi: 10.1007/BF00964611
[21] Han Q, Cai T, Tagle D A, et al.Thermal stability, pH dependence and inhibition of four murine kynurenine aminotransferases[J].BMC Biochem, 2010, 11:19 doi: 10.1186/1471-2091-11-19
[22] 齐红梅, 刘微娜, 季浏.运动抗抑郁的神经生物学机制综述[J].首都体育学院学报.2013, 25(5):459-464 http://www.cnki.com.cn/Article/CJFDTOTAL-BTSF201305017.htm [23] Miller A H, Maletic V, Raison C L.Inflammation and its discontents:The role of cytokines in the pathophysiology of major depression[J].Biol Psychiatry, 2009, 65(9):732-741 doi: 10.1016/j.biopsych.2008.11.029
[24] Brydon L, Harrison N A, Walker C, et al.Peripheral inflammation is associated with altered substantia nigra activity and psychomotor slowing in humans[J].Biol Psychiatry, 2008, 63(11):1022-1029 doi: 10.1016/j.biopsych.2007.12.007
[25] Eisenberger N I, Berkman E T, Inagaki T K, et al.Inflammation-induced anhedonia:Endotoxin reduces ventral striatum responses to reward[J].Biological Psychiatry, 2010, 68(8):748-754 doi: 10.1016/j.biopsych.2010.06.010
[26] Hannestad J, Dellagioia N, Ortiz N, et al.Citalopram reduces endotoxin-induced fatigue[J].Brain Behav Immun, 2011, 25(2):256-259 doi: 10.1016/j.bbi.2010.10.013
[27] Thomson C A, Mccoll A, Cavanagh J, et al.Peripheral inflammation is associated with remote global gene expression changes in the brain[J].J Neuroinflammation, 2014, 11:73 doi: 10.1186/1742-2094-11-73
[28] Dantzer R, Konsman J P, Bluthe R M, et al.Neural and humoral pathways of communication from the immune system to the brain:Parallel or convergent?[J].Auton Neurosci, 2000, 85(1-3):60-65 doi: 10.1016/S1566-0702(00)00220-4
[29] Vitkovic L, Konsman J P, Bockaert J, et al.Cytokine signals propagate through the brain[J].Mol Psychiatry, 2000, 5(6):604-615 doi: 10.1038/sj.mp.4000813
[30] D'Mello C, Le T, Swain M G.Cerebral microglia recruit monocytes into the brain in response to tumor necrosis factoralpha signaling during peripheral organ inflammation[J].J Neurosci, 2009, 29(7):2089-2102 doi: 10.1523/JNEUROSCI.3567-08.2009
[31] Louveau A, Smirnov I, Keyes T J, et al.Structural and functional features of central nervous system lymphatic vessels[J].Nature, 2015, 523:337-341 doi: 10.1038/nature14432
[32] Dantzer R, O'Connor J C, Freund G G, et al.From inflammation to sickness and depression:When the immune system subjugates the brain[J].Nature Reviews Neuroscience, 2008, 9(1):46-56 doi: 10.1038/nrn2297
[33] Handschin C, Choi C S, Chin S, et al.Abnormal glucose homeostasis in skeletal muscle-specific PGC-1alpha knockout mice reveals skeletal muscle-pancreatic beta cell crosstalk[J].J Clin Invest, 2007, 117(11):3463-3474 doi: 10.1172/JCI31785
[34] Handschin C, Spiegelman B M.The role of exercise and PGC1α in inflammation and chronic disease[J].Nature, 2008, 454(7203):463-469 doi: 10.1038/nature07206
[35] Eisele P S, Furrer R, Beer M, et al.The PGC-1 coactivators promote an anti-inflammatory environment in skeletal muscle in vivo[J].Biochem Biophys Res Commun, 2015, 464(3):692-697 doi: 10.1016/j.bbrc.2015.06.166
[36] Eisele P S, Salatino S, Sobek J, et al.The peroxisome proliferator-activated receptor gamma coactivator 1alpha/beta (PGC-1) coactivators repress the transcriptional activity of NF-kappaB in skeletal muscle cells[J].J Biol Chem, 2013, 288(4):2246-2260 doi: 10.1074/jbc.M112.375253
[37] Duman R S, Monteggia L M.A neurotrophic model for stress-related mood disorders[J].Biol Psychiatry, 2006, 59(12):1116-1127 doi: 10.1016/j.biopsych.2006.02.013
[38] Park H, Poo M M.Neurotrophin regulation of neural circuit development and function[J].Nat Rev Neurosci, 2013, 14(1):7-23 doi: 10.1038/nrc3653
[39] Karege F, Vaudan G, Schwald M, et al.Neurotrophin levels in postmortem brains of suicide victims and the effects of antemortem diagnosis and psychotropic drugs[J].Brain Res Mol Brain Res, 2005, 136(1-2):29-37 doi: 10.1016/j.molbrainres.2004.12.020
[40] Sen S, Duman R, Sanacora G.Serum brain-derived neurotrophic factor, depression, and antidepressant medications:meta-analyses and implications[J].Biol Psychiatry, 2008, 64(6):527-532 doi: 10.1016/j.biopsych.2008.05.005
[41] Autry A E, Monteggia L M.Brain-derived neurotrophic factor and neuropsychiatric disorders[J].Pharmacol Rev, 2012, 64(2):238-258 doi: 10.1124/pr.111.005108
[42] Nestler E J, Barrot M, Dileone R J, et al.Neurobiology of depression[J].Neuron, 2002, 34(1):13-25 doi: 10.1016/S0896-6273(02)00653-0
[43] Duman R S, Monteggia L M.A neurotrophic model for stress-related mood disorders[J].Biol Psychiatry, 2006, 59(12):1116-1127 doi: 10.1016/j.biopsych.2006.02.013
[44] Duman C H, Schlesinger L, Kodama M, et al.A role for MAP kinase signaling in behavioral models of depression and antidepressant treatment[J].Biol Psychiatry, 2007, 61(5):661-670 doi: 10.1016/j.biopsych.2006.05.047
[45] Advani T, Koek W, Hensler J G.Gender differences in the enhanced vulnerability of BDNF+/-mice to mild stress[J].Int J Neuropsychopharmacol, 2009, 12(5):583-588 doi: 10.1017/S1461145709000248
[46] Bostrom P, Wu J, Jedrychowski M P, et al.A PGC1-alpha-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J].Nature, 2012, 481(7382):463-468 doi: 10.1038/nature10777
[47] Moon H, Dincer F, Mantzoros C S.Pharmacological concentrations of irisin increase cell proliferation without influencing markers of neurite outgrowth and synaptogenesis in mouse H19-7 hippocampal cell lines[J].Metabolism, 2013, 62(8):1131-1136 doi: 10.1016/j.metabol.2013.04.007
[48] Xu B.BDNF (Ⅰ)rising from exercise[J].Cell Metab, 2013, 18(5):612-614 doi: 10.1016/j.cmet.2013.10.008
[49] 周伟, 陈俊.运动与PGC-1α依赖性肌肉因子鸢尾素研究进展[J].中国运动医学杂志, 2014, 33(7):746-752 http://www.cnki.com.cn/Article/CJFDTOTAL-YDYX201407021.htm [50] Kohut M L, Mccann D A, Russell D W, et al.Aerobic exercise, but not flexibility/resistance exercise, reduces serum IL-18, CRP, and IL-6 independent of beta-blockers, BMI, and psychosocial factors in older adults[J].Brain Behav Immun, 2006, 20(3):201-209 doi: 10.1016/j.bbi.2005.12.002
[51] Rethorst C D, Toups M S, Greer T L, et al.Pro-inflammatory cytokines as predictors of antidepressant effects of exercise in major depressive disorder[J].Molecular Psychiatry, 2012, 18(10):1119-1124 https://www.researchgate.net/publication/230749831_Pro-Inflammatory_Cytokines_as_Predictors_of_Antidepressant_Effects_of_Exercise_in_Major_Depressive_Disorder
[52] Jedrychowski M P, Wrann C D, Paulo J A, et al.Detection and quantitation of circulating human irisin by tandem mass spectrometry[J].Cell Metabolism, 2015, 22(4):734-740 doi: 10.1016/j.cmet.2015.08.001
[53] Aberg M A, Aberg N D, Hedbacker H, et al.Peripheral infusion of IGF-Ⅰ selectively induces neurogenesis in the adult rat hippocampus[J].J Neurosci, 2000, 20(8):2896-2903 http://www.academia.edu/8862943/Peripheral_Infusion_of_IGF-I_Selectively_Induces_Neurogenesis_in_the_Adult_Rat_Hippocampus
[54] Trejo J L, Carro E, Torres-Aleman I.Circulating insulin-like growth factor I mediates exercise-induced increases in the number of new neurons in the adult hippocampus[J].J Neurosci, 2001, 21(5):1628-1634 https://www.researchgate.net/publication/12108072_Circulating_Insulin-Like_Growth_Factor_I_Mediates_Exercise-Induced_Increases_in_the_Number_of_New_Neurons_in_the_Adult_Hippocampus
[55] Carro E, Nunez A, Busiguina S, et al.Circulating insulin-like growth factor I mediates effects of exercise on the brain[J].J Neurosci, 2000, 20(8):2926-2933 http://www.academia.edu/16819333/Circulating_insulin-like_growth_factor_I_mediates_effects_of_exercise_on_the_brain
[56] 田振军, 贺志雄, 蔡梦昕.运动干预骨骼肌内分泌功能[J].生理科学进展, 2013, 44(4):275-280 http://www.cnki.com.cn/Article/CJFDTOTAL-SLKZ201304008.htm [57] Weng Z, Signore A P, Gao Y, et al.Leptin protects against 6-hydroxydopamine-induced dopaminergic cell death via mitogen-activated protein kinase signaling[J].J Biol Chem, 2007, 282(47):34479-34491 doi: 10.1074/jbc.M705426200
[58] Ca M, Mg C, Lp S, et al.Leptin in Alzheimer's disease[J].Clinica Chimica Acta, 2015, 450:162-168 doi: 10.1016/j.cca.2015.08.009
[59] Yau S Y, Li A, Hoo R L C, et al.Physical exercise-induced hippocampal neurogenesis and antidepressant effects are mediated by the adipocyte hormone adiponectin[J].Proceedings of the National Academy of Sciences, 2014, 111(44):15810-15815 doi: 10.1073/pnas.1415219111
[60] 张小曼, 尹君.脂联素对中枢神经系统作用的研究进展[J].微循环学杂志, 2012, 22(03):50-53 doi: 10.3969/j.issn.1005-1740.2012.03.018 [61] Fan M M, Raymond L A.N-methyl-D-aspartate (NMDA) receptor function and excitotoxicity in Huntington's disease[J].Prog Neurobiol, 2007, 81(5-6):272-293 doi: 10.1016/j.pneurobio.2006.11.003
[62] O'Neill M J, Witkin J M.AMPA receptor potentiators:Application for depression and Parkinson's disease[J].Curr Drug Targets, 2007, 8(5):603-620 doi: 10.2174/138945007780618517
[63] Palop J J, Chin J, Roberson E D, et al.Aberrant excitatory neuronal activity and compensatory remodeling of inhibitory hippocampal circuits in mouse models of Alzheimer's disease[J].Neuron, 2007, 55(5):697-711 doi: 10.1016/j.neuron.2007.07.025
[64] Qiu G, Wan R, Hu J, et al.Adiponectin protects rat hippocampal neurons against excitotoxicity[J].Age (Dordr), 2011, 33(2):155-165 doi: 10.1007/s11357-010-9173-5
[65] Fischer C P.Interleukin-6 in acute exercise and training:what is the biological relevance?[J].Exerc Immunol Rev, 2006, 12:6-33 https://www.researchgate.net/profile/Christian_Philip_Fischer/publication/6600013_Interleukin-6_in_acute_exercise_and_training_What_is_the_biological_relevance/links/0fcfd50a29144cdaf3000000.pdf
[66] Schindler R, Mancilla J, Endres S, et al.Correlations and interactions in the production of interleukin-6 (IL-6), IL-1, and tumor necrosis factor (TNF) in human blood mononuclear cells:IL-6 suppresses IL-1 and TNF[J].Blood, 1990, 75(1):40-47 https://www.researchgate.net/publication/20861079_Correlations_and_interactions_in_the_production_of_interleukin-6_IL-6_IL-1_and_tumor_necrosis_factor_TNF_in_human_blood_mononuclear_cells_IL-6_suppresses_IL-1_and_TNF
[67] Steensberg A, Fischer C P, Keller C, et al.IL-6 enhances plasma IL-1ra, IL-10, and cortisol in humans[J].Am J Physiol Endocrinol Metab, 2003, 285(2):E433-E437 doi: 10.1152/ajpendo.00074.2003
[68] Yang J, Ruchti E, Petit J M, et al.Lactate promotes plasticity gene expression by potentiating NMDA signaling in neurons[J].Proceedings of the National Academy of Sciences, 2014, 111(33):12228-12233 doi: 10.1073/pnas.1322912111
[69] Barchas J D, Freedman D X.Brain amines:Response to physiological stress[J].Biochem Pharmacol, 1963, 12:1232-1235 doi: 10.1016/0006-2952(63)90101-1
[70] Brown B S, Payne T, Kim C, et al.Chronic response of rat brain norepinephrine and serotonin levels to endurance training[J].J Appl Physiol Respir Environ Exerc Physiol, 1979, 46(1):19-23
[71] Zlokovic B V, Martel C L, Mackic J B, et al.Brain uptake of circulating apolipoproteins J and E complexed to Alzheimer's amyloid beta[J].Biochem Biophys Res Commun, 1994, 205(2):1431-1437 doi: 10.1006/bbrc.1994.2825
[72] Liu Y, Studzinski C, Beckett T, et al.Circulating neprilysin clears brain amyloid[J].Mol Cell Neurosci, 2010, 45(2):101-107 doi: 10.1016/j.mcn.2010.05.014
[73] Kuo Y M, Kokjohn T A, Watson M D, et al.Elevated abeta42 in skeletal muscle of Alzheimer disease patients suggests peripheral alterations of AbetaPP metabolism[J].Am J Pathol, 2000, 156(3):797-805 doi: 10.1016/S0002-9440(10)64947-4
-
期刊类型引用(8)
1. 郑鑫虎,杨孟超,王国飞,刘永杰,吴晓阳. 体育锻炼对大学生抑郁焦虑情绪影响效果的横断面研究. 浙江体育科学. 2024(03): 90-97 .  百度学术
百度学术
2. 王芃,王靖,赵津磊,王相,辛鑫,裘莎丽,臧育恒,王兴. 大学生身体活动水平与抑郁症状的关系——基于静息脑电的作用路径分析. 上海体育学院学报. 2023(04): 51-60 .  百度学术
百度学术
3. 金圣杰,陈祥和,房纹萱. 运动抗抑郁表观遗传机制. 中国老年学杂志. 2023(09): 2296-2303 .  百度学术
百度学术
4. 周可林,董硕,国生,魏培栋,付国兵,杨靖颐. 振腹手法对抑郁症大鼠模型的干预机制研究. 世界中医药. 2023(11): 1551-1557 .  百度学术
百度学术
5. 刘文彬,漆正堂,刘微娜. Notch信号通路介导运动对抑郁的调控机制——基于整合生物学视角. 中国体育科技. 2023(07): 81-89 .  百度学术
百度学术
6. 陈祥和,李文秀,刘波,殷荣宾. 骨源性因子ucOCN在运动抗抑郁中的作用机制. 心理科学进展. 2022(02): 375-388 .  百度学术
百度学术
7. 冀翠,韩雨梅,赵伟迪,刘相玉,令狐婷,田俊生,秦雪梅. 逍遥散对抑郁大鼠行为学及骨骼肌线粒体结构与功能的影响. 药物评价研究. 2022(09): 1763-1769 .  百度学术
百度学术
8. 林锦,纪越,申倩,沈莉. 基于网络药理学的麻黄-细辛药对治疗抑郁障碍的作用机制研究. 时珍国医国药. 2021(07): 1609-1612 .  百度学术
百度学术
其他类型引用(13)




 下载:
下载: