Research Progress on the Health Effects of Chrono-Exercise on Metabolic Syndrome
-
摘要:
通过系统检索PubMed、Web of Science、Embase、Scopus和中国知网等数据库中与择时运动、代谢综合征相关的文献,分析择时运动、昼夜节律与代谢综合征的关系。发现:一天中不同时间的运动会影响血糖代谢反应,择时运动对血糖代谢的影响与进餐时间有关;择时运动能够降低代谢与心血管风险,与早上运动相比,晚上运动对降低血压有更大益处;AMPK、PGC1α以及HIF1α在运动调节昼夜节律影响代谢性疾病中发挥重要作用,这可能是择时运动影响代谢健康的潜在机制。认为:择时运动可作为昼夜节律紊乱相关病理的有效处方,将择时运动和进餐时间与分子时钟同步会最大限度地发挥运动对全身代谢健康的促进作用。未来研究可尝试探索不同运动在一天中的不同时间对机体代谢的影响,以最大限度地提高运动效益。
Abstract:A systematic review of relevant research in PubMed, Web of Science, Embase, Scopus and China National Knowledge Internet (CNKI) was conducted to review the literature related to chrono-exercise and metabolic syndrome, trying to analyze the relationship between chrono-exercise, circadian rhythm and metabolic syndrome. It is found that the effect of exercise at different times of the day on glucose metabolism was related to the timing of meals. Chrono-exercise reduced metabolic and cardiovascular risk, and evening exercise had a greater benefit on lowering blood pressure than morning exercise did. AMPK, PGC1α, and HIF1α cytokines played important roles in the regulation of circadian rhythms by exercise to affect metabolic diseases, which may be a potential mechanism for chrono-exercise to affect metabolic health. Conclusion was drawn that chrono-exercise could be an effective prescription for circadian rhythm disorder-related pathologies, and synchronizing chrono-exercise and meal timing with the molecular clock would also maximize the beneficial effects of exercise on systemic metabolic health. Future research should address the effects of different exercises at different times of the day on the metabolic health of the body to maximize the benefits of exercise.
-
Keywords:
- metabolic syndrome /
- chrono-exercise /
- circadian rhythm /
- clock gene
-
代谢综合征(MetS)被世界卫生组织(WHO)定义为以腹部肥胖、胰岛素抵抗、高血压和高血脂为特征的病理状况。据统计,世界上有超10亿人患MetS。美国有34.2%的成年人患MetS[1]。在我国18岁以上成年人中,约4.5亿人患MetS,患病率为33.9%[2],这给社会带来了严重的经济负担,也影响着人们的生活质量。
研究[3]表明,昼夜节律稳态影响MetS。昼夜节律是一个具有高度组织特异性、能够自我维持的生物钟,影响新陈代谢、激素分泌、免疫以及行为活动的节律过程,受外部时间信号影响。光信号是调节外周昼夜节律同步运作的主要“授时因子”,非光性“授时因子”,如进食、体育锻炼等,亦可使昼夜节律发生变化[4]。有研究[5]发现,一天中不同时间段的运动会影响骨骼肌的代谢途径和代谢能力,说明运动的时间段可能影响代谢节律。还有研究评估了运动的时间段如何通过特定的组织或全系统的组织影响代谢健康,其结果并不一致。如:有研究[6]发现,与上午相比,男性超重2型糖尿病(T2DM)受试者在下午进行高强度间歇训练(HIIT)对降低24 h血糖水平更为有效;但对40名久坐超重成年人的研究[7]发现,在改善血糖控制和餐后葡萄糖反应上早上运动和晚上运动并无显著性差异。综上,笔者假设在运动防治MetS的过程中,辅以最佳运动时间段的设置,其效果会进一步增强。本文通过系统检索PubMed、Web of Science、Embase、Scopus和中国知网等数据库中与择时运动(Chrono-exercise)、昼夜节律、MetS相关的文献,分析择时运动、昼夜节律与MetS的关系,了解择时运动对糖代谢与心血管系统的影响,并从分子机制层面探讨择时运动对代谢健康的影响。
1. 择时运动
择时运动是指以时间生物学理论为基础,依据机体生物节律选择运动时间的一种运动方法。目前,随着人们对自身节律的深入研究,利用运动时间生物学探讨人类疾病的发生与发展已成为运动医学与时间生物学领域的研究热点。
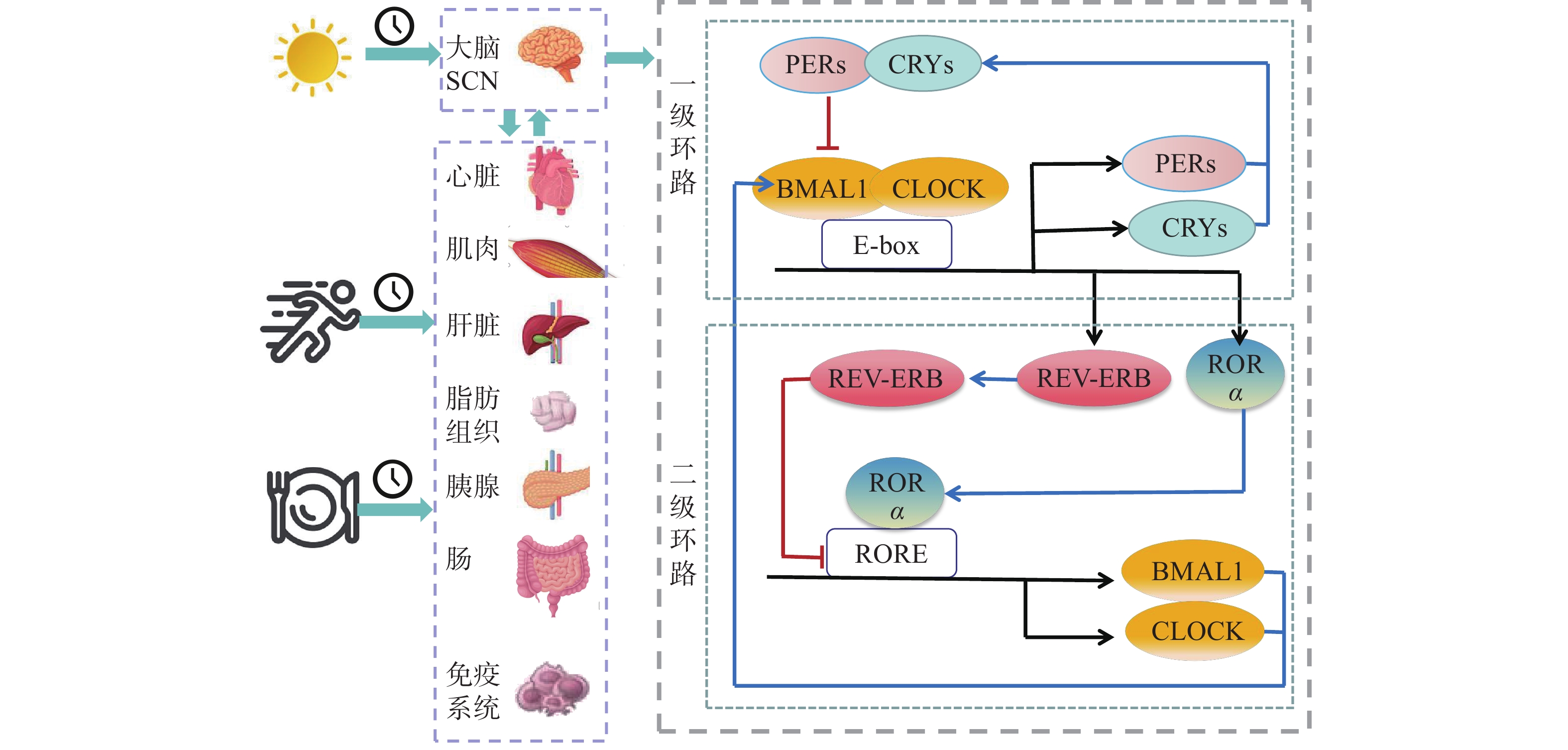
时间生物学证明,昼夜更迭对人体节律具有显著影响,机体的生理活动具有明显的昼夜节律性,形成昼夜节律系统。该系统主要由位于下丘脑视交叉上核(SCN)的核心时钟控制,SCN通过神经系统、内分泌系统等的信号调控其他器官(骨骼肌、心脏、肝脏、肾脏、心脏等)的昼夜节律,即外周时钟[8]。SCN主要通过感知光信号做出反应,外周时钟的改变主要受饮食和身体运动影响,这些影响外周时钟的光信号、饮食因素和运动因素被称为授时因子。授时因子会推迟或加快核心时钟的时间造成“相位偏差”,所以核心时钟在接收光信号后会影响外周时钟,而外周时钟会对进食和运动做出反应,影响核心时钟[9]。
昼夜节律由一个转录翻译反馈环路(TTFL)组成,在人体中循环约24.2 h[10]。有核细胞有4个生物钟基因家族,分别为CLOCK、BMAL1、PERs(PER1、PER2和PER3)和CRYs(CRY1、CRY2和CRY3),它们在分子水平上负责时钟节律性[11]。TTFL包括一级环路和二级环路。在一级环路中核心时钟因子CLOCK和BMAL1结合形成异源二聚体,并通过与靶基因的启动子E-box结合,促进PERs和CRYs等基因的转录,不断积累的PERs和CRYs基因转位到细胞核中,抑制CLOCK和BMAL1基因转录过程中蛋白的活性,随后PERs和CRYs蛋白合成复合物逐渐降解促使CLOCK和BMAL1启动新的转录激活周期[12]。二级环路是CLOCK和BMAL1影响RORα/β/γ和REV-ERBα/β蛋白表达,RORα/β/γ和REV-ERBα/β蛋白通过竞争结合BMAL1启动子区域的RORE元件,分别抑制和增强BMAL1的转录,直接调节昼夜节律[12](图1)。以上TTFL通过相互作用构成了一个复杂的调控网络,调节下游基因的转录周期,进而调控哺乳动物的生理代谢进程和行为活动。这种分子钟活动与骨骼肌中的代谢变化密切相关[13]。运动作为外周时钟节律性表达的外部非光调节器,可通过重新设置代谢受损参与者的外周时钟来调节外周时钟功能障碍及其相关的代谢影响。一天中不同时间段的运动会影响骨骼肌的代谢途径和代谢能力[5],表明运动的时间段可能影响外周时钟与核心时钟间的密切配合,进而影响代谢过程。
2. 择时运动与代谢昼夜节律
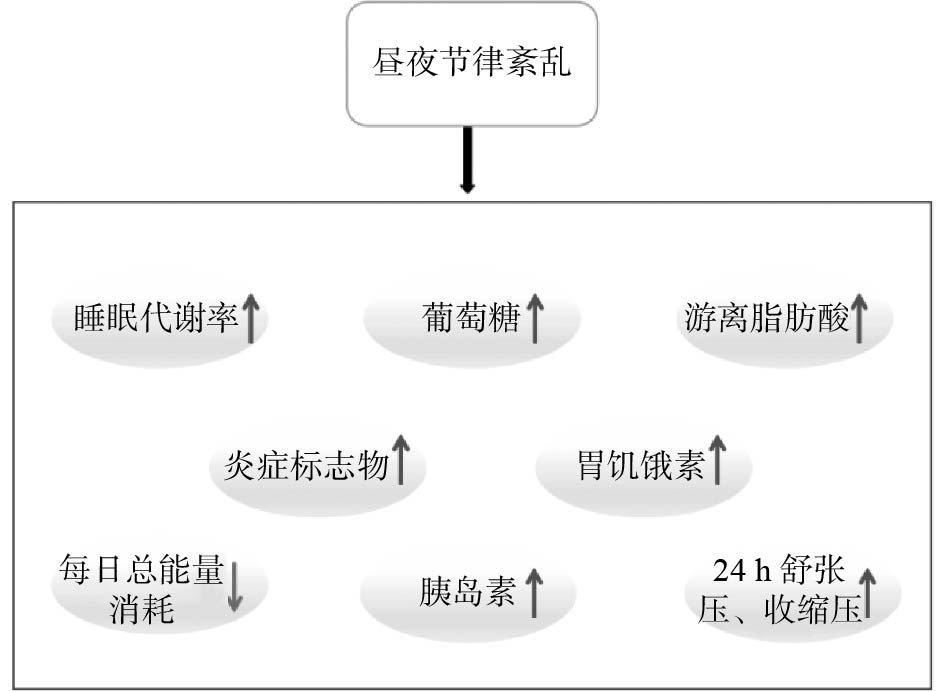
在现代社会生活中,不合理的生活方式和工作学习需求使机体内部昼夜节律受损,如上夜班、跨时区旅行、夜间光污染、睡眠时长减少、长时间屏幕暴露、不良饮食习惯等引起的昼夜节律紊乱[14]。大量临床流行病学调查[15-16]显示,长期昼夜节律紊乱会对代谢健康产生不利影响,导致血液循环中葡萄糖、胰岛素和瘦素水平失调,以及静息代谢率降低(图2)。目前,对纵向研究的系统综述发现,经常上夜班的人患高血压[17]、糖尿病、肥胖症和冠心病的风险更高[18]。昼夜节律是维持细胞和组织动态平衡的重要调节系统,在新陈代谢过程中发挥关键作用。生物钟的正常功能如果被破坏,会导致一系列代谢紊乱症状的出现。糖脂代谢相关基因的表达呈现昼夜波动,而这种昼夜波动受到CLOCK/BMAL1及下游节律调节因子的调控[14]。一旦节律调控基因自身的24 h周期性受到破坏,就容易引起夜间脂肪分解受阻、代谢减慢,使脂肪细胞过度积累,导致肥胖,这一结论在多个节律紊乱模型小鼠的实验中均得到了验证[19]。综上,昼夜节律紊乱会导致糖脂代谢异常,进而引起肥胖。
流行病学证据[20]表明,昼夜节律紊乱引起的睡眠不足会增加人们患T2DM与肥胖症的风险。有规律的运动可提高整体睡眠质量。研究[21]结果显示,高强度运动提升了大鼠血浆中促进睡眠的分子腺苷浓度,对改善睡眠质量有益。关于人类的研究[22]发现,晚上进行剧烈运动可以提高睡眠质量,然而在睡前不久进行剧烈运动可能会引发一种压力反应,从而削弱运动带来的健康效益,甚至对睡眠质量造成损害。因此,选择正确的时间段进行运动才能改善睡眠质量,降低代谢性疾病的风险。运动除了能改善睡眠质量外,还能调节人们因倒班工作带来的不良代谢后果[23]。在仅4 d的模拟倒班工作试验中发现,受试者胰岛素敏感性降低,患T2DM的风险增加[24]。在倒班工作的途中进行择时运动发现,运动可以增强骨骼肌昼夜节律振幅,说明择时运动可能是一种有效提高人们对倒班工作耐受性的方法[25]。另外,运动对核心时钟的调节受一天中不同时间段的影响,早上运动会引起昼夜节律相位的延迟,而晚上运动会导致昼夜节律相位的提前[26],说明晚上运动可能比早上运动更能减少由倒班工作引起的昼夜节律失调[16],且一天中不同的运动时间段可以调节代谢紊乱人群的昼夜节律相位,但这一结果还需更多的研究来验证。
综上,机体可能存在最佳运动时间段,在最佳时间段进行运动可以通过调节分子时钟改善昼夜节律紊乱,预防MetS的发生。MetS是一组以肥胖症、高血糖、血脂异常以及高血压等聚集发病、严重影响机体健康的临床症候群,是在代谢上相互关联的危险因素的组合,这些因素直接导致了心血管疾病和T2DM患病风险的增加。以下将从糖代谢与心血管昼夜变化的角度分析择时运动对MetS的影响。
2.1 择时运动与糖代谢
2.1.1 糖代谢昼夜变化
血糖调节和胰岛素敏感性存在昼夜变化。血糖最低是在凌晨2:00左右,峰值出现在13:00—14:00[27],在相似的血糖负荷下,早上的血糖清除率比晚上高[28]。胰岛素敏感性在晚上有所降低,这是由于人类晚上的胰岛素分泌率较低[29]。胰岛素敏感性的昼夜波动是影响葡萄糖代谢稳态的重要因素。代谢激素如皮质醇和褪黑激素的昼夜波动,以及血浆中非酯化游离脂肪酸(NEFA)浓度的昼夜变化[30],也会影响全身葡萄糖代谢平衡。除了上述因素外,白色脂肪组织与氧化底物水平也会影响葡萄糖代谢昼夜变化[31]。白色脂肪组织具有昼夜节律性,会影响脂肪酶活性、三酰甘油周转和血浆NEFA水平的振荡[32]。使用连续静脉注射棕榈酸酯的研究[33]发现:偏瘦受试者的白色脂肪组织中餐后脂肪酸的储存能力在晚上达到高峰,肥胖受试者的白色脂肪组织餐后脂肪酸的储存能力存在破损,他们在一天中连续进食后表现出不同的昼夜变化。在健康的人类受试者中,晚餐时引起的葡萄糖游离量比早餐时高。动物研究[34]表明,葡萄糖耐量在清醒时达到高峰,在睡眠时达到低谷。
就具体组织而言,与白天相比,晚上骨骼肌对葡萄糖的摄取效率更低[35]。人体骨骼肌细胞内葡萄糖摄取能力部分取决于线粒体的氧化能力,而线粒体的氧化能力在晚上达到峰值[36]。敲除小鼠胰腺细胞中CLOCK和BMAL1时钟基因会导致小鼠胰岛素分泌减少[37]。BMAL1基因的缺失也会抑制肌肉对葡萄糖的摄取,导致机体血糖紊乱[38]。肌细胞脂质储存的增加往往与胰岛素信号的受损有关。脂肪组织中脂肪酸的储存能力和脂肪组织脂肪分解的抑制有助于改善胰岛素敏感性的节律性。因此,昼夜节律可能在协调多个胰岛素反应性外周组织中发挥作用,以及时处理葡萄糖,避免血糖稳态失调。
2.1.2 择时运动对糖代谢昼夜变化的影响
运动是调控外周时钟的重要环境线索,能够调节骨骼肌的时钟基因。一项关于小鼠的研究[5]发现,在急性运动(acute exercise)后,骨骼肌的代谢组和转录组水平的反应与一天中运动的时间段有关,在小鼠的早期活动阶段运动后糖酵解活动增加,在休息阶段运动刺激了碳水化合物的代谢。虽然运动的时间段会影响小鼠的代谢反应,但在关于人类的研究中还未发现一天中促进葡萄糖平衡的最佳运动时间段。
择时运动对人类血糖代谢的影响研究大多采用餐前或餐后运动实验。Francois等[39]发现,在每顿正餐前以90%的最大心率进行6组1 min的运动,比在晚餐前以60%的最大心率进行30 min的运动更能有效降低餐后血糖。Iwayama等[40]发现,早餐前以50%的最大摄氧量进行60 min的适度连续运动后机体能在24 h内增加脂肪氧化程度,但在午餐或晚餐后进行同样的运动没有观察到这种效果。餐后低强度运动也能降低餐后葡萄糖含量。低血糖的发作是胰岛素依赖型糖尿病患者的一个严重问题。在1型糖尿病患者中,下午(16:00)进行中等强度有氧运动比早上(7:00)运动会导致更多的低血糖事件发生[41]。出现这种情况,可能是下午和整个夜晚前半部分的循环皮质醇浓度降低导致的,表明与早上运动相比,下午运动在降低葡萄糖水平方面具有更大潜力。T2DM患者的餐前与餐后运动研究[42]发现,餐后运动对葡萄糖稳态有更大益处。关于糖尿病前期患者的研究[39]发现,每餐后30 min的短期高强度运动比每餐前30 min中等强度运动更能显著降低餐后血糖峰值与餐后血糖漂移。餐后运动过程的肌肉收缩和胰岛素刺激均使得葡萄糖摄取量增加,同时胰岛素和胰高血糖素的比例也会提高,有利于减少肝脏葡萄糖的输出[43]。由此可见,一天中不同时间段的运动与机体的24 h饮食状况紧密联系。运动和饮食是2个强有力的非光信号时间线索,可以影响核心时钟和外周时钟。相反,核心时钟和外周时钟也会影响运动介导的反应。未来研究有必要了解运动和饮食之间的协同作用对糖代谢昼夜变化的调节。
长期择时运动影响葡萄糖代谢稳态的随机临床试验显示,在超重人群和T2DM患者中,下午/晚上的运动训练对葡萄糖稳态的改善比早上更大[44-45]。连续5 d以95%~120%的平均峰值功率进行HIIT后发现,下午运动对降低血糖有更大的效益[45]。进行12周中等强度有氧运动加抗阻训练后,观察到下午运动更能降低血糖[44];但也有研究[46]发现,超重人群或T2DM患者进行为期12周每周早晚各3次中等强度有氧运动和阻力训练后,受试者的血糖水平并无显著性差异。以上研究得出了不同结果可能是因为实验方案不同(包括运动的类型、强度和持续时间以及饮食控制的差异等)(表1)。
表 1 一天中不同时间段急性与长期运动对血糖影响的差异Table 1. Effects of acute and chrono-exercise on blood sugar in different time periods of the day运动类型 文献信息 平均
年龄/岁参与
人数身体状态 运动干预时间段 运动类型 运动量 研究结果 急性运动 Francois等[39] 48 9 OW 早餐前后 跑步机运动 30 min、60%HRmax 早餐后血糖下降 周玉彬[47] 22 13 OW 早餐前和晚餐前 HIIT 24 min、100%VO2max 早餐前运动可显著降低运动后24 h连续间质葡萄糖水平及血糖变异性;晚餐前运动无变化 Gomez等[41] 32 32 T1DM 早上(7:00)
下午(16:00)跑步机运动 60 min中等强度运动 下午运动比早上运动更容易发生低血糖 长期运动 Mancilla等[44] 61 32 T2DM&OW 上午(8:00—10:00) 骑自行车 30 min、70%Wmax、12周 下午运动比上午运动的胰岛素敏感性更高 下午(15:00—18:00) 阻力运动 Moholdt等[45] 35 8 OW 上午(6:30)
下午(18:30)骑自行车 30 min、95%~120%Wmax
和1 min低强度运动,10组、12周下午运动后,夜间葡萄糖下降 Teo等[7] 57 20 OW&T2DM 上午(8:00—10:00) 跑步机运动 30 min、60%~70%
VO2max、12周患者血糖和胰岛素结果都有改善 注:OW表示超重,T1DM表示1型糖尿病,T2DM表示2型糖尿病;VO2max表示最大摄氧量,HRmax表示最大心率,Wmax表示最大工作量。 总体而言,上午、下午运动所产生的降低血糖的效果差异并不明显,而晚上运动后葡萄糖稳态效果更好[44],这可能是由于研究中使用了较低强度的有氧运动结合阻力运动所导致[48]。目前虽没有足够的证据证明一天中葡萄糖稳态的最佳运动时间段,但未来将择时运动和进餐时间段与分子时钟同步可能会最大限度地发挥运动对全身代谢健康的促进作用。
2.2 择时运动与心血管系统
2.2.1 心血管系统昼夜变化
几乎所有心血管系统的生理标志物都有24 h昼夜振荡。心脏大约有13%的基因和8%的蛋白质具有节律性[49]。转录组学和代谢组学数据表明,心肌细胞每天在活动期经历ATP生成阶段促进收缩功能,然后在活动期结束时进入营养储存阶段,随后在休息/睡眠期进入生长/修复阶段,存在显著的节律变化[50]。在健康人群中,心血管系统反应存在昼夜波动,即9:00—10:00的心血管反应最大,15:00左右出现低谷,19:00左右出现第2个高峰[51]。早上交感神经活动增加是导致心血管系统出现昼夜波动的部分原因 [52],夜间较低的压力反射灵敏性是导致早上血压增加的重要因素[53]。血压和心率在白天比晚上高。SCN通过多突触投射到孤束核、心脏、血管和肾上腺皮质[54],直接调控心血管系统的昼夜节律。昼夜节律实验研究[55]显示,心脏副交感神经调节、血浆皮质醇水平和循环儿茶酚胺表现出独立于日常行为(如睡眠和体育活动)的内部昼夜节律,这些昼夜节律可与日常行为反应相互作用,致使机体在一天中的不同时间对相同的日常行为产生不同反应。
一项日间研究[46]和一项昼夜研究[56]表明,血管内皮功能会在早上减弱,增加患心血管疾病的风险。早上血管舒张能力的下降主要由内部昼夜节律系统变化引起。在一项昼夜研究中发现,虽然血管内皮素-1(血管收缩剂)水平早晚无明显变化,但一种更为重要的血管收缩剂—紧张素Ⅱ的水平在早上升高[57],一氧化氮的血清水平(一种主要由内皮组织产生的血管舒张剂)则在早上降低[58]。除了血管收缩剂和血管舒张剂降低早上血管舒张能力外,在早上观察到的由于血小板聚集和纤溶酶原激活物抑制剂1(PAI-1)增加而形成的促血栓环境,也会导致早上发生不良心血管事件的风险增加[59]。在傍晚早些时候,由于来自内部昼夜节律系统、环境和日常行为之间的相互作用,早上引起的不良心血管事件大多被逆转,最终导致双重乘积减少和心血管风险降低。
2.2.2 择时运动对心血管系统昼夜节律的影响
在一天中的任何时间进行定期运动都会对心血管系统和整体健康有益[60]。相关队列研究[61-64]表明,下午晚些时候和晚上进行运动可能对心血管健康具有最大的益处。因此,建议已有代谢性疾病或不良心血管事件风险较高的人群避免在早上进行剧烈运动以降低不良心血管事件的发生风险[65]。
几十年来,人们一直在研究心血管反应在运动中的昼夜变化,运动在降低心血管双乘积反应(反应心脏压力指标)方面的急性效益成为当前的研究热点。该反应主要通过运动后与运动前相比血压值的降低来实现,这种现象被称为运动后低血压(PEH)[66],且一次运动就可以降低血压长达24 h[66],具有重要临床意义。目前有明确的证据表明,PEH在晚上反应更大。在血压正常的人群中,晚上运动比早上运动更能降低收缩压(降低约10 mmHg)和平均血压(降低约6 mmHg)[67]。高血压前期的参与者在晚上运动时的收缩压表现出更大的降幅(降低约3 mmHg)[68],而在高血压患者中,晚上运动的收缩压和平均血压均比早上运动降低约4 mmHg[61]。见表2。
表 2 一天中不同时间段急性与长期运动对心血管影响的差异Table 2. Differences in the effects of acute and chronic exercise on cardiovascular effects at different times of the day运动类型 文献信息 平均
年龄/岁参与人数(性别) 身体状态 运动干预时间段 运动类型 运动量 研究结果 急性运动 Brito等[64] 32 16(男) 高血压前期 早上(9:00)
下午(18:00)骑自行车 45 min,50%̇VO2max 早上运动使一天中的SBP下降,下午运动SBP的下降程度较早上更大 Brito等[75] 33 10(男) 高血压前期 早上(8:00—10:00)
下午(18:00—20:00)骑自行车 CPET 副交感神经的再激活在下午运动时比上午运动要弱 Brito等[66] 33 13(男) 高血压前期 早上(9:00)
下午(18:00)骑自行车 45 min,50%̇VO2max 睡眠中收缩压下降只出现在下午运动时 Brito等[71] 25 5(女)、5(男) 健康 上午(8:30)
下午(18:00)单腿测力计运动 60 min,60%peak power 上午与下午运动的腿部血流量相似 Brito等[61] 49 15(男) 高血压 上午(7:00—9:00)
晚上(19:00—22:00)骑自行车 CPET 下午运动后收缩压下降幅度
更大Jones等[76] 58 3(女)、2(男) 高血压 上午(8:00—10:00)
下午(12:00—14:00)跑步机 30 min,50%̇VO2max 高血压患者下午运动后睡眠时SBP的降幅大于上午运动 长期运动 Brito等[63] 51 15(男) 高血压 上午(7:00—10:00)
下午(18:00—21:00)骑自行车 45 min,中等强度,10周 SBP与DBP仅在下午运动后下降 49 15(男) Brito等[62] 51 15(男) 高血压 上午(7:00—10:00)
下午(18:00—21:00)骑自行车 45 min,中等强度,10周 心率恢复速度仅在下午运动后上升 49 15(男) Arciero等[77] 40 30(女)、26(男) 健康 上午(6:30—8:30)
下午(18:00—20:00)阻力功能运动、间歇冲刺运动 、伸展运动和耐力运动 12周 女性早上训练能降低血压;男性晚上运动能降低血压、心脏病风险和疲劳感 注:SBP表示收缩压,DBP表示舒张压;VO2max表示最大摄氧量,CPET表示心肺功能运动测试,60%peak power表示60%峰值功率。 现有研究[68]表明,平均睡眠血压仅在晚上运动后降低。与晚上相比,早上的心率较低,而早上运动后心脏每搏输出量不能充分补偿早上运动后心率的增加,并使心脏交感神经稳定度下降[64],这可能是由于运动后气压反射灵敏度下降所致[69]。气压反射灵敏度在早上最低[53],因此早上运动会促使该数值降至更低,不利于维持心脏交感神经的稳定性。早上有氧运动会使血管舒张压不足,导致运动后血管阻力增加,而全身血管阻力的增加可能是导致早上血管功能受损的潜在机制。傍晚运动后,运动促进的血管扩张在运动结束后仍然会持续一段时间[64]。在年轻的男性和女性(平均年龄23岁)中,运动后持续的血管舒张依赖于中枢组胺能神经系统[70]。运动后血管舒张程度的昼夜变化似乎与组胺能信号传递无关[71],相反,晚上运动后全身血管阻力的下降主要是由于运动后肌肉交感神经活动的减少导致。
另外,在健康受试者[72]、高血压前期者、高血压患者[73-74]以及冠心病患者中观察到,急性运动后的血压下降与长期运动降低血压的慢性效应存在较强的正相关。一些研究[66, 78]认为,急性运动对血压降低(如PEH)的积累会促进长期运动进一步降低血压。这一理论在以下2个随机对照试验中也得到了验证:对患有高血压的中年男性进行10周的中等强度有氧运动训练后发现,晚上的血压下降程度比早上更明显,这一研究还发现60%的参与者在晚上运动后,血压下降值大于最小可测变化值,而在晨练后只有20%的参与者超过了这一最小可测变化值,且只有晚上运动可使24 h舒张压下降[63]。另一项研究[62]发现,在晚上进行最大心肺功能运动测试后,心率恢复情况比早上运动有更佳的改善,特别是晚上运动对心脏压力反射敏感性、血管运动性交感神经调节和心脏自主神经恢复具有更大益处,但晚上运动对心血管系统的短期与长期效益需要在更大的队列中进行研究,以提高其普适性。
2.3 择时运动影响代谢昼夜节律的潜在机制
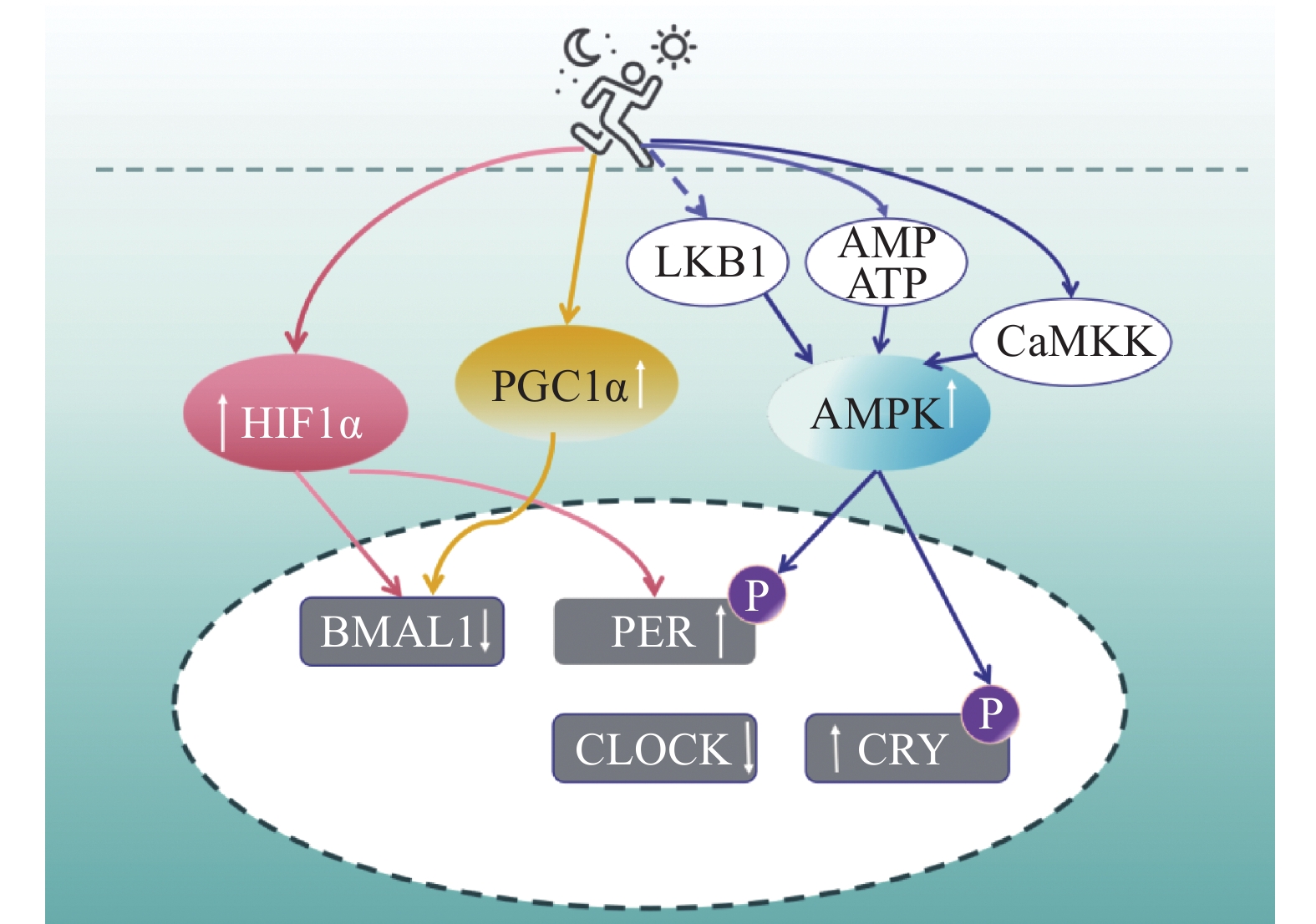
运动是防止肥胖症和T2DM患者血糖控制恶化、改善胰岛素抵抗的有效手段,而择时运动能够使机体代谢利用率大幅增加。在过去的几年里,Sylow等[79]对运动调节代谢的分子机制进行了全面调查,发现运动能调节AMPK与PGC1α蛋白,并影响代谢变化,但是其中的复杂关系还需大量研究验证。Sato等[5]的研究结果强调,不同时间的运动对代谢的影响机制不同(表3),缺氧诱导因子1(HIF1α)的激活取决于每天运动的时间。急性运动对骨骼肌中的HIF1α途径具有影响,该途径在控制代谢和影响代谢疾病中具有重要作用。近期研究发现,AMPK、PGC1α和HIF1α具有昼夜节律性,这可能是择时运动影响代谢昼夜节律的潜在机制。
表 3 择时运动对小鼠骨骼肌代谢分子机制的影响[5]Table 3. Effects of chrono-exercise on the molecular mechanism of mouse skeletal muscle metabolism骨骼肌代谢的分子机制 休息阶段
(3:00—12:00)运动活动阶段
(15:00—0:00)运动葡萄糖代谢 升 降 脂肪代谢 降 无 糖酵解 无 升 脂质氧化 无 升 氨基酸分解 无 升 铜代谢 无 升 HIF1α 无 升 能量消耗 升 无 运动应答基因AMPK是骨骼肌运动过程中能量代谢的重要调节因子,可以不依赖于胰岛素的作用机制而增加骨骼肌中葡萄糖的转运和脂肪酸的氧化[80],揭示了运动作为昼夜节律时间提示的潜在机制。运动通过调节ATP活性、CaMKK(蛋白激酶激酶)以及可能通过LKB1(Liver Kinase B1)使AMPK调节因子受到影响增加AMPK活性,AMPK活性的增加改变了PERs和CRYs蛋白的稳定性,从而影响核心分子时钟基因的表达[81]。AMPK的激活导致CRY1/2的稳定性降低,而CRY1本身又可通过PPARδ降低运动能力[82],导致BMAL1基因表达受到抑制[83]。通过AMPK介导的GLUT4向浆膜下转移可以解释运动的胰岛素增敏作用,从而促进胰岛素刺激的肌细胞葡萄糖摄取[84]。特定分解代谢和调节AMPK亚基的磷酸化在哺乳动物肌肉细胞中显示出昼夜变化[81],缺乏AMPKγ3亚单位的小鼠没有表现出野生型小鼠常见的光暗期呼吸交换比例的昼夜变化[85]。此外,一些基本的时钟网络元件具有AMPK靶激活位点,为运动刺激的胰岛素敏感性与时钟基因相互作用提供了分子机制。考虑到运动时特定AMPK亚单位复合体的磷酸化程度依赖于强度/持续时间、运动类型以及运动时间[86],在一天中的特定时间段进行运动对代谢受损的参与者获得锻炼的最佳效益可能是至关重要的。
除了AMPK外,PGC1α也可能是运动调节生物钟防治代谢性疾病的潜在机制。PGC1α是一种转录激活因子,可被禁食、运动或低温等代谢刺激诱导,并作为代谢调节因子发挥作用。PGC1α调控棕色脂肪组织的氧化磷酸化、适应性产热和活性氧解毒酶的表达。PGC1α通过激活PPARα,诱导脂肪酸氧化,还通过增强HNF-4α和糖皮质激素受体的活性来刺激肝脏糖异生。Lira等[87]发现,PGC1α参与骨骼肌收缩和代谢适应,运动通过增强骨骼肌PGC1α的表达来增强胰岛素的敏感性,改善代谢性疾病。除了这些重要的代谢功能外,PGC1α在昼夜节律的调节中发挥关键作用[88],PGC1α本身在肝脏和骨骼肌等代谢组织中表现出昼夜节律的表达模式,PGC1α激活RORα和RORγ并刺激BMAL1和REV-ERBα的表达。缺乏PGC1α基因的小鼠在运动活动、体温和代谢率方面存在缺陷[88],时钟和代谢基因的异常表达导致了这些缺陷。PGC1α调节时钟机制可能是运动调节骨骼肌生物钟与代谢状态的重要因子。
HIF1α是骨骼肌糖代谢的关键调节因子。运动刺激使机体产生局部缺氧状态,导致HIF1α水平增加。越来越多的证据表明,HIF1α可以调节生物钟,而昼夜蛋白又可以影响HIF1α。在BMAL1基因敲除小鼠中发现,无氧糖酵解、线粒体呼吸和HIF1α靶基因的转录减少[89]。此外,Perrin等[13]在人体骨骼肌细胞中也有类似的发现。Peek等[90]在野生型小鼠中发现,剧烈运动对生物钟和HIF1α目标基因的诱导因一天中的运动时间不同而不同,当小鼠在12:00、18:00和0:00运动时,HIF1α的诱导作用都比在6:00运动大,这表明昼夜节律控制着运动对HIF1α和时钟依赖的转录反应。HIF1α在控制代谢和影响代谢疾病中具有重要作用。虽然早期研究[91]表明,脂肪组织中HIF1α的升高会导致肥胖和胰岛素抵抗,但也有研究表示HIF1α的激活能改善饮食诱导的代谢性疾病,HIF1α通过控制线粒体生物发生和糖酵解刺激BAT的产热功能,这意味着脂肪组织中激活的HIF1α可能对治疗肥胖和改善胰岛素抵抗有益。择时运动诱导AMPK、PGC1α与HIF1α影响代谢昼夜节律的潜在机制如图3所示。
3. 结论与展望
与早上运动相比,在晚上进行急性运动可以更大程度地降低血压,从而在运动后和整个睡眠期间都能减少心脏工作量;在长期运动方面,晚上运动的心血管反应好于早上。择时运动对血糖稳态的影响存在不一致性,未来应进一步确定餐前或餐后锻炼对一天中不同时间段血糖稳态的影响。AMPK、PGC1α以及HIF1α可能是运动调节昼夜节律影响代谢性疾病的潜在分子机制,为研究昼夜节律相关病理和运动之间的复杂关系提供了新思路。目前这一领域的相关研究还存在一些局限:在进行实验时未控制光信号与进食模式等时间线索,这些时间线索也会影响代谢健康;未考虑人与人之间存在的显著个体差异,如内部昼夜节律钟的周期、入睡的习惯时间(时型)以及性别差异;运动调节SCN对外周时钟的影响机制尚未完全阐明,缺乏择时运动对代谢影响的机制研究。
基于前期研究现状,提出以下展望:①目前运动对血糖代谢稳态的影响尚无定论,但运动时间似乎与进餐时间具有联系,未来可进一步研究餐前或餐后运动对一天中不同时间段血糖代谢稳态的影响;②不同强度、持续时间以及频率的运动在一天中的不同时间段对MetS患者代谢健康的急性和长期影响有待进一步研究;③人与人之间存在显著个体差异,需探寻个性化的择时运动方案,寻找MetS患者的最佳运动时间。
作者贡献声明:汤立许:提出论文主题,设计论文框架,撰写论文;作者贡献声明:兰金艳:设计论文框架,修改论文,核实数据。 -
表 1 一天中不同时间段急性与长期运动对血糖影响的差异
Table 1 Effects of acute and chrono-exercise on blood sugar in different time periods of the day
运动类型 文献信息 平均
年龄/岁参与
人数身体状态 运动干预时间段 运动类型 运动量 研究结果 急性运动 Francois等[39] 48 9 OW 早餐前后 跑步机运动 30 min、60%HRmax 早餐后血糖下降 周玉彬[47] 22 13 OW 早餐前和晚餐前 HIIT 24 min、100%VO2max 早餐前运动可显著降低运动后24 h连续间质葡萄糖水平及血糖变异性;晚餐前运动无变化 Gomez等[41] 32 32 T1DM 早上(7:00)
下午(16:00)跑步机运动 60 min中等强度运动 下午运动比早上运动更容易发生低血糖 长期运动 Mancilla等[44] 61 32 T2DM&OW 上午(8:00—10:00) 骑自行车 30 min、70%Wmax、12周 下午运动比上午运动的胰岛素敏感性更高 下午(15:00—18:00) 阻力运动 Moholdt等[45] 35 8 OW 上午(6:30)
下午(18:30)骑自行车 30 min、95%~120%Wmax
和1 min低强度运动,10组、12周下午运动后,夜间葡萄糖下降 Teo等[7] 57 20 OW&T2DM 上午(8:00—10:00) 跑步机运动 30 min、60%~70%
VO2max、12周患者血糖和胰岛素结果都有改善 注:OW表示超重,T1DM表示1型糖尿病,T2DM表示2型糖尿病;VO2max表示最大摄氧量,HRmax表示最大心率,Wmax表示最大工作量。 表 2 一天中不同时间段急性与长期运动对心血管影响的差异
Table 2 Differences in the effects of acute and chronic exercise on cardiovascular effects at different times of the day
运动类型 文献信息 平均
年龄/岁参与人数(性别) 身体状态 运动干预时间段 运动类型 运动量 研究结果 急性运动 Brito等[64] 32 16(男) 高血压前期 早上(9:00)
下午(18:00)骑自行车 45 min,50%̇VO2max 早上运动使一天中的SBP下降,下午运动SBP的下降程度较早上更大 Brito等[75] 33 10(男) 高血压前期 早上(8:00—10:00)
下午(18:00—20:00)骑自行车 CPET 副交感神经的再激活在下午运动时比上午运动要弱 Brito等[66] 33 13(男) 高血压前期 早上(9:00)
下午(18:00)骑自行车 45 min,50%̇VO2max 睡眠中收缩压下降只出现在下午运动时 Brito等[71] 25 5(女)、5(男) 健康 上午(8:30)
下午(18:00)单腿测力计运动 60 min,60%peak power 上午与下午运动的腿部血流量相似 Brito等[61] 49 15(男) 高血压 上午(7:00—9:00)
晚上(19:00—22:00)骑自行车 CPET 下午运动后收缩压下降幅度
更大Jones等[76] 58 3(女)、2(男) 高血压 上午(8:00—10:00)
下午(12:00—14:00)跑步机 30 min,50%̇VO2max 高血压患者下午运动后睡眠时SBP的降幅大于上午运动 长期运动 Brito等[63] 51 15(男) 高血压 上午(7:00—10:00)
下午(18:00—21:00)骑自行车 45 min,中等强度,10周 SBP与DBP仅在下午运动后下降 49 15(男) Brito等[62] 51 15(男) 高血压 上午(7:00—10:00)
下午(18:00—21:00)骑自行车 45 min,中等强度,10周 心率恢复速度仅在下午运动后上升 49 15(男) Arciero等[77] 40 30(女)、26(男) 健康 上午(6:30—8:30)
下午(18:00—20:00)阻力功能运动、间歇冲刺运动 、伸展运动和耐力运动 12周 女性早上训练能降低血压;男性晚上运动能降低血压、心脏病风险和疲劳感 注:SBP表示收缩压,DBP表示舒张压;VO2max表示最大摄氧量,CPET表示心肺功能运动测试,60%peak power表示60%峰值功率。 表 3 择时运动对小鼠骨骼肌代谢分子机制的影响[5]
Table 3 Effects of chrono-exercise on the molecular mechanism of mouse skeletal muscle metabolism
骨骼肌代谢的分子机制 休息阶段
(3:00—12:00)运动活动阶段
(15:00—0:00)运动葡萄糖代谢 升 降 脂肪代谢 降 无 糖酵解 无 升 脂质氧化 无 升 氨基酸分解 无 升 铜代谢 无 升 HIF1α 无 升 能量消耗 升 无 -
[1] MOORE J X,CHAUDHARY N,AKINYEMIJU T F. Metabolic syndrome prevalence by race/ethnicity and sex in the United States,national health and nutrition examination survey,1988-2012[J]. Preventing Chronic Disease,2017,14:E24 doi: 10.5888/pcd14.160287
[2] LU J L,WANG L M,LI M,et al. Metabolic syndrome among adults in China:The 2010 China noncommunicable disease surveillance[J]. The Journal of Clinical Endocrinology & Metabolism,2017,102(2):507-515
[3] MASRI S,SASSONE-CORSI P. The emerging link between cancer,metabolism,and circadian rhythms[J]. Nature Medicine,2018,24(12):1795-1803 doi: 10.1038/s41591-018-0271-8
[4] AOYAMA S,SHIBATA S. Time-of-day-dependent physiological responses to meal and exercise[J]. Frontiers in Nutrition,2020,7:18 doi: 10.3389/fnut.2020.00018
[5] SATO S,BASSE A L,SCHÖNKE M,et al. Time of exercise specifies the impact on muscle metabolic pathways and systemic energy homeostasis[J]. Cell Metabolism,2019,30(1):92-110 doi: 10.1016/j.cmet.2019.03.013
[6] SAVIKJ M,GABRIEL B M,ALM P S,et al. Afternoon exercise is more efficacious than morning exercise at improving blood glucose levels in individuals with type 2 diabetes:A randomised crossover trial[J]. Diabetologia,2019,62(2):233-237 doi: 10.1007/s00125-018-4767-z
[7] TEO S Y,KANALEY J A,GUELFI K J,et al. The impact of exercise timing on glycemic control:A randomized clinical trial[J]. Medicine & Science in Sports & Exercise,2020,52(2):323-334
[8] HUANG W Y,RAMSEY K M,MARCHEVA B,et al. Circadian rhythms,sleep,and metabolism[J]. The Journal of Clinical Investigation,2011,121(6):2133-2141 doi: 10.1172/JCI46043
[9] GABRIEL B M,ZIERATH J R. Circadian rhythms and exercise:Re-setting the clock in metabolic disease[J]. Nature Reviews Endocrinology,2019,15(4):197-206 doi: 10.1038/s41574-018-0150-x
[10] ROENNEBERG T,MERROW M. The circadian clock and human health[J]. Current Biology,2016,26(10):R432-R443 doi: 10.1016/j.cub.2016.04.011
[11] TAKAHASHI J S. Molecular components of the circadian clock in mammals[J]. Diabetes, Obesity & Metabolism, 2015, 17 Suppl 1(1): 6-11
[12] SCHIBLER U. Oxidation of CLOCK boosts circadian rhythms[J]. Nature Cell Biology,2019,21(12):1464-1465 doi: 10.1038/s41556-019-0430-2
[13] PERRIN L,LOIZIDES-MANGOLD U,CHANON S,et al. Transcriptomic analyses reveal rhythmic and CLOCK-driven pathways in human skeletal muscle[J]. eLife,2018,7:e34114 doi: 10.7554/eLife.34114
[14] 王静,侯婉婷,秦雪梅,等. 昼夜节律的相关研究进展[J]. 中国中药杂志,2021,46(13):3240-3248 doi: 10.19540/j.cnki.cjcmm.20210308.601 [15] JOHNSON D A,REID M,VU T H T,et al. Associations of sleep duration and social jetlag with cardiometabolic risk factors in the study of Latino youth[J]. Sleep Health,2020,6(5):563-569 doi: 10.1016/j.sleh.2020.02.017
[16] VETTER C. Circadian disruption:What do we actually mean?[J]. The European Journal of Neuroscience,2020,51(1):531-550 doi: 10.1111/ejn.14255
[17] MANOHAR S,THONGPRAYOON C,CHEUNGPASIT-PORN W,et al. Associations of rotational shift work and night shift status with hypertension:A systematic review and meta-analysis[J]. Journal of Hypertension,2017,35(10):1929-1937 doi: 10.1097/HJH.0000000000001442
[18] PROPER K I,VAN DE LANGENBERG D,RODENBURG W,et al. The relationship between shift work and metabolic risk factors:A systematic review of longitudinal studies[J]. American Journal of Preventive Medicine,2016,50(5):e147-e157 doi: 10.1016/j.amepre.2015.11.013
[19] EZAGOURI S,ZWIGHAFT Z,SOBEL J,et al. Physiological and molecular dissection of daily variance in exercise capacity[J]. Cell Metabolism,2019,30(1):78-91 doi: 10.1016/j.cmet.2019.03.012
[20] PÉREZ J G. Exercise and type 2 diabetes mellitus[J]. Atencion Primaria,2012,44(3):178 doi: 10.1016/j.aprim.2011.10.006
[21] BASS J,LAZAR M A. Circadian time signatures of fitness and disease[J]. Science,2016,354(6315):994-999 doi: 10.1126/science.aah4965
[22] YOUNGSTEDT S D,O'CONNOR P J,DISHMAN R K. The effects of acute exercise on sleep:A quantitative synthesis[J]. Sleep,1997,20(3):203-214 doi: 10.1093/sleep/20.3.203
[23] VETTER C,DASHTI H S,LANE J M,et al. Night shift work,genetic risk,and type 2 diabetes in the UK biobank[J]. Diabetes Care,2018,41(4):762-769 doi: 10.2337/dc17-1933
[24] BESCOS R,BODEN M J,JACKSON M L,et al. Four days of simulated shift work reduces insulin sensitivity in humans[J]. Acta Physiologica ,2018,223(2):e13039 doi: 10.1111/apha.13039
[25] HANSEN J,TIMMERS S,MOONEN-KORNIPS E,et al. Synchronized human skeletal myotubes of lean,obese and type 2 diabetic patients maintain circadian oscillation of clock genes[J]. Scientific Reports,2016,6:35047 doi: 10.1038/srep35047
[26] BUXTON O M,LEE C W,L'HERMITE-BALERIAUX M,et al. Exercise elicits phase shifts and acute alterations of melatonin that vary with circadian phase[J]. American Journal of Physiology. Regulatory,Integrative and Comparative Physiology,2003,284(3):R714-R724 doi: 10.1152/ajpregu.00355.2002
[27] VAN CAUTER E,BLACKMAN J,ROLAND D,et al. Modulation of glucose regulation and insulin secretion by circadian rhythmicity and sleep[J]. The Journal of Clinical Investigation,1991,88(3):934-942 doi: 10.1172/JCI115396
[28] SONNIER T,ROOD J,GIMBLE J M,et al. Glycemic control is impaired in the evening in prediabetes through multiple diurnal rhythms[J]. Journal of Diabetes and Its Complications,2014,28(6):836-843 doi: 10.1016/j.jdiacomp.2014.04.001
[29] SAAD A,DALLA MAN C,NANDY D K,et al. Diurnal pattern to insulin secretion and insulin action in healthy individuals[J]. Diabetes,2012,61(11):2691-2700 doi: 10.2337/db11-1478
[30] YOSHINO J,ALMEDA-VALDES P,PATTERSON B W,et al. Diurnal variation in insulin sensitivity of glucose metabolism is associated with diurnal variations in whole-body and cellular fatty acid metabolism in metabolically normal women[J]. The Journal of Clinical Endocrinology & Metabolism,2014,99(9):E1666-E1670
[31] 陈筵明,龚维坤,孙英芬,等. 昼夜节律紊乱与2型糖尿病关系的研究进展[J]. 中国细胞生物学学报,2020,42(9):1684-1693 [32] STENVERS D J,JONGEJAN A,ATIQI S,et al. Diurnal rhythms in the white adipose tissue transcriptome are disturbed in obese individuals with type 2 diabetes compared with lean control individuals[J]. Diabetologia,2019,62(4):704-716 doi: 10.1007/s00125-019-4813-5
[33] MCQUAID S E,HODSON L,NEVILLE M J,et al. Down regulation of adipose tissue fatty acid trafficking in obesity:A driver for ectopic fat deposition?[J]. Diabetes,2011,60(1):47-55 doi: 10.2337/db10-0867
[34] DING G L,LI X,HOU X G,et al. REV-ERB in GABAergic neurons controls diurnal hepatic insulin sensitivity[J]. Nature,2021,592(7856):763-767 doi: 10.1038/s41586-021-03358-w
[35] MANCILLA R,KROOK A,SCHRAUWEN P,et al. Diurnal regulation of peripheral glucose metabolism:Potential effects of exercise timing[J]. Obesity (Silver Spring,Md.),2020,28(Suppl 1):S38-S45
[36] DIRK,MOORSEL V. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity[J]. Molecular Metabolism,2016,5(8):635-645 doi: 10.1016/j.molmet.2016.06.012
[37] MARCHEVA B,RAMSEY K M,BUHR E D,et al. Disruption of the clock components CLOCK and BMAL1 leads to hypoinsulinaemia and diabetes[J]. Nature,2010,466(7306):627-631 doi: 10.1038/nature09253
[38] HARFMANN B D,SCHRODER E A,KACHMAN M T,et al. Muscle-specific loss of Bmal1 leads to disrupted tissue glucose metabolism and systemic glucose homeostasis[J]. Skeletal Muscle,2016,6:12 doi: 10.1186/s13395-016-0082-x
[39] FRANCOIS M E,BALDI J C,MANNING P J,et al. 'Exercise snacks' before meals:A novel strategy to improve glycaemic control in individuals with insulin resistance[J]. Diabetologia,2014,57(7):1437-1445 doi: 10.1007/s00125-014-3244-6
[40] IWAYAMA K,KURIHARA R,NABEKURA Y,et al. Exercise increases 24-h fat oxidation only when it is performed before breakfast[J]. EBioMedicine,2015,2(12):2003-2009 doi: 10.1016/j.ebiom.2015.10.029
[41] GOMEZ A M,GOMEZ C,ASCHNER P,et al. Effects of performing morning versus afternoon exercise on glycemic control and hypoglycemia frequency in type 1 diabetes patients on sensor-augmented insulin pump therapy[J]. Journal of Diabetes Science and Technology,2015,9(3):619-624 doi: 10.1177/1932296814566233
[42] HEDEN T D,WINN N C,MARI A,et al. Postdinner resistance exercise improves postprandial risk factors more effectively than predinner resistance exercise in patients with type 2 diabetes[J]. Journal of Applied Physiology,2015,118(5):624-634 doi: 10.1152/japplphysiol.00917.2014
[43] KOWALSKI G M,MOORE S M,HAMLEY S,et al. The effect of ingested glucose dose on the suppression of endogenous glucose production in humans[J]. Diabetes,2017,66(9):2400-2406 doi: 10.2337/db17-0433
[44] MANCILLA R,BROUWERS B,SCHRAUWEN-HINDERLING V B,et al. Exercise training elicits superior metabolic effects when performed in the afternoon compared to morning in metabolically compromised humans[J]. Physiological Reports,2021,8(24):e14669
[45] MOHOLDT T,PARR E B,DEVLIN B L,et al. The effect of morning vs evening exercise training on glycaemic control and serum metabolites in overweight/obese men:A randomised trial[J]. Diabetologia,2021,64(9):2061-2076 doi: 10.1007/s00125-021-05477-5
[46] THOSAR S S,BERMAN A M,HERZIG M X,et al. Circadian rhythm of vascular function in midlife adults[J]. Arteriosclerosis,Thrombosis,and Vascular Biology,2019,39(6):1203-1211 doi: 10.1161/ATVBAHA.119.312682
[47] 周玉彬. 不同时段进行高强度间歇运动对久坐年青成人糖脂代谢影响的研究[D]. 上海: 上海体育学院, 2021: 14-33 [48] RUSSELL B M,FRANCOIS M E. Toward personalizing exercise to support circadian entrainment of glycemia in type 2 diabetes[J]. Medicine and Science in Sports and Exercise,2020,52(5):1235
[49] PODOBED P,ACKLOO S,et al. The day/night proteome in the murine heart[J]. American Journal of Physiology. Regulatory,Integrative and Comparative Physiology,2014,307(2):R121-R137 doi: 10.1152/ajpregu.00011.2014
[50] MARTINO T A,TATA N,BELSHAM D D,et al. Disturbed diurnal rhythm alters gene expression and exacerbates cardiovascular disease with rescue by resynchronization[J]. Hypertension,2007,49(5):1104-1113 doi: 10.1161/HYPERTENSIONAHA.106.083568
[51] PORTALUPPI F, SMOLENSKY M H. Circadian rhythmic and environmental determinants of 24-hour blood pressure regulation in normal and hypertensive conditions[M]//Blood pressure monitoring in cardiovascular medicine and therapeutics. Totowa, NJ: Humana Press, 2007: 135-158
[52] GRASSI G,BOMBELLI M,SERAVALLE G,et al. Diurnal blood pressure variation and sympathetic activity[J]. Hypertension Research,2010,33(5):381-385 doi: 10.1038/hr.2010.26
[53] TAYLOR C E,ATKINSON G,WILLIE C K,et al. Diurnal variation in the mechanical and neural components of the baroreflex[J]. Hypertension ,2011,58(1):51-56 doi: 10.1161/HYPERTENSIONAHA.111.171512
[54] SCHEER F A J L,HORST G J T,VAN DER VLIET J,et al. Physiological and anatomic evidence for regulation of the heart by suprachiasmatic nucleus in rats[J]. Heart and Circulatory Physiology,2001,280(3):H1391-H1399 doi: 10.1152/ajpheart.2001.280.3.H1391
[55] HU K,SCHEER F A J L,LAKER M,et al. Endogenous circadian rhythm in vasovagal response to head-up tilt[J]. Circulation,2011,123(9):961-970 doi: 10.1161/CIRCULATIONAHA.110.943019
[56] THOSAR S S,BERMAN A M,HERZIG M X,et al. Morning impairment in vascular function is unrelated to overnight sleep or the inactivity that accompanies sleep[J]. Regulatory,Integrative and Comparative Physiology,2018,315(5):R986-R993 doi: 10.1152/ajpregu.00143.2018
[57] CUGINI P,LUCIA P. Circadian rhythm of the renin-angiotensin-aldosterone system:A summary of our research studies[J]. La Clinica Terapeutica,2004,155(7/8):287-291
[58] KANABROCKI E L,GEORGE M,HERMIDA R C,et al. Day-night variations in blood levels of nitric oxide,T-TFPI,and E-selectin[J]. Clinical and Applied Thrombosis/Hemostasis,2001,7(4):339-345 doi: 10.1177/107602960100700417
[59] MANFREDINI R,BOARI B,SMOLENSKY M H,et al. Circadian variation in stroke onset:Identical temporal pattern in ischemic and hemorrhagic events[J]. Chronobiology International,2005,22(3):417-453 doi: 10.1081/CBI-200062927
[60] HELLSTEN Y,NYBERG M. Cardiovascular adaptations to exercise training[J]. Comprehensive Physiology,2015,6(1):1-32
[61] BRITO L C,AZEVÊDO L,PEÇANHA T,et al. Effects of ACEi and ARB on post-exercise hypotension induced by exercises conducted at different times of day in hypertensive men[J]. Clinical and Experimental Hypertension,2020,42(8):722-727 doi: 10.1080/10641963.2020.1783546
[62] BRITO L C,PEÇANHA T,FECCHIO R Y,et al. Comparison of morning versus evening aerobic-exercise training on heart rate recovery in treated hypertensive men:A randomized controlled trial[J]. Blood Pressure Monitoring,2021,26(5):388-392 doi: 10.1097/MBP.0000000000000545
[63] BRITO L C,PEÇANHA T,FECCHIO R Y,et al. Morning versus evening aerobic training effects on blood pressure in treated hypertension[J]. Medicine and Science in Sports and Exercise,2019,51(4):653-662 doi: 10.1249/MSS.0000000000001852
[64] BRITO L C,REZENDE R A,DA SILVA JUNIOR N D,et al. Post-exercise hypotension and its mechanisms differ after morning and evening exercise:A randomized crossover study[J]. PLoS One,2015,10(7):e0132458 doi: 10.1371/journal.pone.0132458
[65] ATKINSON G,JONES H,AINSLIE P N. Circadian variation in the circulatory responses to exercise:Relevance to the morning peaks in strokes and cardiac events[J]. European Journal of Applied Physiology,2010,108(1):15-29 doi: 10.1007/s00421-009-1243-y
[66] BRITO L C,FECCHIO R Y,PECANHA T,et al. Postexercise hypotension as a clinical tool:A "single brick" in the wall[J]. Journal of the American Society of Hypertension,2018,12(12):e59-e64 doi: 10.1016/j.jash.2018.10.006
[67] JONES H,PRITCHARD C,GEORGE K,et al. The acute post-exercise response of blood pressure varies with time of day[J]. European Journal of Applied Physiology,2008,104(3):481-489 doi: 10.1007/s00421-008-0797-4
[68] BRITO L C,REZENDE R A,MENDES C,et al. Separate aftereffects of morning and evening exercise on ambulatory blood pressure in prehypertensive men[J]. The Journal of Sports Medicine and Physical Fitness,2018,58(1/2):157-163
[69] HEFFERNAN K S,COLLIER S R,KELLY E E,et al. Arterial stiffness and baroreflex sensitivity following bouts of aerobic and resistance exercise[J]. International Journal of Sports Medicine,2007,28(3):197-203 doi: 10.1055/s-2006-924290
[70] BARRETT-O'KEEFE Z,KAPLON R E,HALLIWILL J R. Sustained post exercise vasodilatation and histamine receptor activation following small muscle-mass exercise in humans[J]. Experimental Physiology,2013,98(1):268-277 doi: 10.1113/expphysiol.2012.066605
[71] BRITO L C,ELY M R,SIECK D C,et al. Effect of time of day on sustained post exercise vasodilation following small muscle-mass exercise in humans[J]. Frontiers in Physiology,2019,10:762 doi: 10.3389/fphys.2019.00762
[72] TIBANA R A,DE SOUSA N M F,DA CUNHA NASCIMENTO D,et al. Correlation between acute and chronic 24-hour blood pressure response to resistance training in adult women[J]. International Journal of Sports Medicine,2015,36(1):82-89
[73] DOS SANTOS E S,ASANO R Y,FILHO I G,et al. Acute and chronic cardiovascular response to 16 weeks of combined eccentric or traditional resistance and aerobic training in elderly hypertensive women:A randomized controlled trial[J]. Journal of Strength and Conditioning Research,2014,28(11):3073-3084 doi: 10.1519/JSC.0000000000000537
[74] MOREIRA S R,CUCATO G G,TERRA D F,et al. Acute blood pressure changes are related to chronic effects of resistance exercise in medicated hypertensives elderly women[J]. Clinical Physiology and Functional Imaging,2016,36(3):242-248 doi: 10.1111/cpf.12221
[75] BRITO L,PEÇANHA T,TINUCCI T,et al. Time of day affects heart rate recovery and variability after maximal exercise in pre-hypertensive men[J]. Chronobiology International,2015,32(10):1385-1390 doi: 10.3109/07420528.2015.1096277
[76] JONES H,ATKINSON G,LEARY A,et al. Reactivity of ambulatory blood pressure to physical activity varies with time of day[J]. Hypertension,2006,47(4):778-784 doi: 10.1161/01.HYP.0000206421.09642.b5
[77] ARCIERO P J,IVES S J,MOHR A E,et al. Morning exercise reduces abdominal fat and blood pressure in women; evening exercise increases muscular performance in women and lowers blood pressure in men[J]. Frontiers in Physiology,2022,13:893783 doi: 10.3389/fphys.2022.893783
[78] LUTTRELL M J,HALLIWILL J R. Recovery from exercise:Vulnerable state,window of opportunity,or crystal ball?[J]. Frontiers in Physiology,2015,6:204
[79] SYLOW L,RICHTER E A. Current advances in our understanding of exercise as medicine in metabolic disease[J]. Current Opinion in Physiology,2019,12:12-19 doi: 10.1016/j.cophys.2019.04.008
[80] KJØBSTED R,PEDERSEN A J,HINGST J R,et al. Intact regulation of the AMPK signaling network in response to exercise and insulin in skeletal muscle of male patients with type 2 diabetes:Illumination of AMPK activation in recovery from exercise[J]. Diabetes,2016,65(5):1219-1230 doi: 10.2337/db15-1034
[81] LAMIA K A,SACHDEVA U M,DITACCHIO L,et al. AMPK regulates the circadian clock by cryptochrome phosphorylation and degradation[J]. Science,2009,326(5951):437-440 doi: 10.1126/science.1172156
[82] JORDAN S D,KRIEBS A,VAUGHAN M,et al. CRY1/2 selectively repress PPARδ and limit exercise capacity[J]. Cell Metabolism,2017,26(1):243-255 doi: 10.1016/j.cmet.2017.06.002
[83] DOMINY J E Jr,LEE Y,GERHART-HINES Z,et al. Nutrient-dependent regulation of PGC-1alpha’s acetylation state and metabolic function through the enzymatic activities of Sirt1/GCN5[J]. Biochimica et Biophysica Acta,2010,1804(8):1676-1683 doi: 10.1016/j.bbapap.2009.11.023
[84] KJØBSTED R,MUNK-HANSEN N,BIRK J B,et al. Enhanced muscle insulin sensitivity after contraction/exercise is mediated by AMPK[J]. Diabetes,2017,66(3):598-612 doi: 10.2337/db16-0530
[85] VIEIRA E,NILSSON E C,NERSTEDT A,et al. Relationship between AMPK and the transcriptional balance of clock-related genes in skeletal muscle[J]. Endocrinology and Metabolism,2008,295(5):E1032-E1037 doi: 10.1152/ajpendo.90510.2008
[86] TREEBAK J T,BIRK J B,ROSE A J,et al. AS160 phosphorylation is associated with activation of alpha2beta2gamma1- but not alpha2beta2gamma3-AMPK trimeric complex in skeletal muscle during exercise in humans[J]. Endocrinology and Metabolism,2007,292(3):E715-E722 doi: 10.1152/ajpendo.00380.2006
[87] LIRA V A,BENTON C R,YAN Z,et al. PGC-1alpha regulation by exercise training and its influences on muscle function and insulin sensitivity[J]. Endocrinology and Metabolism,2010,299(2):E145-E161 doi: 10.1152/ajpendo.00755.2009
[88] SUNDEKILDE U K,KRISTENSEN C M,OLSEN M A,et al. Time-dependent regulation of hepatic cytochrome P450 mRNA in male liver-specific PGC-1α knockout mice[J]. Toxicology,2022,469:153121 doi: 10.1016/j.tox.2022.153121
[89] SCHIAFFINO S,BLAAUW B,DYAR K A. The functional significance of the skeletal muscle clock:Lessons from Bmal1 knockout models[J]. Skeletal Muscle,2016,6(1):33 doi: 10.1186/s13395-016-0107-5
[90] PEEK C B,LEVINE D C,CEDERNAES J,et al. Circadian clock interaction with HIF1α mediates oxygenic metabolism and anaerobic glycolysis in skeletal muscle[J]. Cell Metabolism,2017,25(1):86-92 doi: 10.1016/j.cmet.2016.09.010
[91] LEE Y S,KIM J,OSBORNE O,et al. Increased adipocyte O2 consumption triggers HIF-1α,causing inflammation and insulin resistance in obesity[J]. Cell,2014,157(6):1339-1352 doi: 10.1016/j.cell.2014.05.012
-
期刊类型引用(6)
1. 宋亨国,唐煜昕. 地方体育行政执法及处罚裁量权基准的量化评价研究. 体育学刊. 2025(01): 79-89 .  百度学术
百度学术
2. 张文鹏,陈红,栗千惠. 体育与健康跨学科主题教学何以推进?——基于多模态理论的分析. 体育学研究. 2024(02): 63-71 .  百度学术
百度学术
3. 张文鹏,吴安月,陈一林,谭达顺,高乙. 从问题到实践:体育与健康跨学科主题学习的教学策略研究. 天津体育学院学报. 2024(03): 302-308+317 .  百度学术
百度学术
4. 张文鹏,杨方正,高乙. 体育与健康跨学科主题多模态教学模式的理论构建与实现路径. 武汉体育学院学报. 2024(06): 73-80 .  百度学术
百度学术
5. 杨剑,石孝宇,郭正茂,吴铭,姚松伯,郭彤彤. 新时代我国青少年体育政策注意力配置及演进——基于LDA主题模型的政策文本分析. 体育学研究. 2024(03): 77-88 .  百度学术
百度学术
6. 宣江鑫,张文鹏,谌平. 健康中国战略下青少年体育健康促进政策质量评估实证研究. 天津体育学院学报. 2024(06): 689-697 .  百度学术
百度学术
其他类型引用(7)




 下载:
下载: