Effects of Different Physical Exercise Interventions on the Cognitive Function in Mice with Circadian Rhythm DisordersBased on the Gut Microbiota and Untargeted Metabolomics Analysis
-
摘要:目的
研究不同运动方式干预对昼夜节律紊乱小鼠认知功能的影响,探讨肠道菌群及代谢与认知功能之间的相关性。
方法采用轮回颠倒的光照周期暴露建立昼夜节律紊乱模型,将模型小鼠分为:安静组(DC)、中等强度持续训练(MICT)运动组(DM)和高强度间歇训练(HIIT)运动组(DH),另设对照组(CC),各组15只,经过6周运动干预后,运用HE染色观察结肠组织、Morris水迷宫检测认知功能、16S rRNA高通量测序检测肠道菌群以及LC-MS检测粪便代谢物。
结果①DM组和DH组的腺体破坏程度有所减轻。②DM组和DH组平台潜伏期和初次抵达平台时间显著缩短,游泳距离减少,穿越站台次数和目标象限游泳时间百分比均显著增加。③DC组丰度较高的菌群为柔膜菌门和柔膜菌纲,DM组为瘤胃球菌科,DH组为Lutispora等。④DM组中肌酸、丁酸和甲硫氨酸等代谢物水平显著高于DC组,DH组中花生四烯酸等代谢物水平显著高于DC组。⑤肠道菌群中颤螺菌属、乳酸杆菌属与认知功能相关性显著,代谢物中姜黄素和油酸与认知功能相关性显著。
结论MICT和HIIT可调节昼夜节律紊乱小鼠肠道菌群的结构和丰度,改善其认知功能,相关肠道菌群与代谢物参与运动改善昼夜节律紊乱小鼠认知功能的调节。
Abstract:ObjectiveTo investigate the effect of different physical exercise interventions on the cognitive function in mice with circadian rhythm disorders, and to explore the correlation between gut microbiota and metabolism and cognitive function.
MethodsA circadian rhythm disorder model was established by a reversed light cycle exposure, and the model mice were divided into three groups: quiet group (DC), MICT exercise group (DM) and HIIT exercise group (DH), and another control group (CC), with 15 mice in each group. After 6 weeks of exercise intervention, the colon tissue was observed by HE staining; cognitive function was detected by Morris water maze and 16S rRNA high-throughput sequencing for detection of gut microbiota and LC-MS to detect fecal metabolites.
Results① The degree of glandular destruction was reduced in the DM and DH groups. ② Platform latency and initial arrival time at the platform were significantly shorter, swimming distance was reduced, and the number of crossing stations and percentage of swimming time in the target quadrant were significantly increased in the DM and DH groups. ③ The groups with higher abundance in the DC group were the phylum Tenericutes and Mollicutes; the DM group was the family Ruminococcaceae; the DH group was the genus Lutispora, etc. ④ Metabolite levels of creatine, butyric acid and methionine were significantly higher in the DM group than in the DC group, and metabolite levels of arachidonic acid were significantly higher in the DH group than in the DC group. ⑤ The correlation between Treponema spp. and Lactobacillus spp. in the intestinal flora and cognitive function was significant, so was the correlation between curcumin and oleic acid in metabolites and cognitive function.
ConclusionMICT and HIIT modulate the structure and abundance of intestinal flora and improve cognitive function in mice with circadian rhythm disorders; related gut microbiota and metabolites are involved in the regulation of exercise to improve cognitive function in mice with circadian rhythm disorders.
-
Keywords:
- HIIT /
- circadian rhythm disorder /
- cognitive function /
- gut microbiota /
- metabolomics
-
外部环境节律与机体内部生物节律失调会引起机体昼夜节律紊乱[1]。昼夜节律紊乱会导致认知功能下降,影响复杂认知任务的完成[2-4]。昼夜节律紊乱与胃肠道功能密切相关[5],这可能是由于通过脑和肠互动引起的胃肠运动、分泌等功能发生改变[6-7],肠道菌群的结构和丰度被破坏,有益菌的比例降低,多种代谢物之间存在差异[8]。中等强度持续训练(MICT)是指在运动过程中,人体吸入的氧气与需求基本相等,达到生理上的平衡状态的一种中等强度训练方法[9]。随着国内外运动训练的科学化发展,运动方式不再局限于单纯的MICT,高强度间歇训练(HIIT)也逐渐成为重要的运动训练方式[10],HIIT本质上是重复多组的剧烈运动+恢复。长期规律的MICT有利于菌群的健康发展,使菌群更丰富[11-12];关于HIIT对肠道菌群影响的研究并不多,但研究结果均表明其可促进肠道菌群多样性及丰度的恢复,改善肠道炎症状态[13-14]。动物实验[15]和人体研究[16]均表明,MICT和HIIT均可改善大脑的认知功能,但哪种运动方式对缓解认知功能下降更有益尚未可知。
肠道菌群被称为人体“第二大脑”,越来越多的研究证据表明肠道菌群的变化可以影响认知功能[17],肠道菌群的异常与认知功能障碍类疾病有显著关联[18]。目前从肠道菌群-肠-脑轴的角度对运动改善昼夜节律紊乱小鼠认知功能的研究较少,因此提出假设:运动和昼夜节律紊乱对于认知功能的影响是通过肠道菌群及其代谢物的改变引起的。本文基于肠道菌群和非靶向代谢组学,探讨不同运动方式干预对昼夜节律紊乱小鼠认知功能的影响,以期为运动改善昼夜节律紊乱导致的肠道菌群紊乱和认知功能受损提供新的研究证据。
1. 研究材料与方法
1.1 实验动物、试剂与仪器
选用60只6周龄SPF级雄性健康KM种小鼠,体质量为(35±2.5) g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2019-0003。适应性喂养1周后,将实验动物随机分为对照组(CC组,n=15),昼夜节律紊乱安静组(DC组,n=15),昼夜节律紊乱MICT组(DM组,n=15),昼夜节律紊乱HIIT组(DH组,n=15)。动物饲养环境:温度保持在22~25 ℃,相对湿度为(50±5)%,分笼饲养(5只/笼), 自由进食水。本实验所有过程中对动物的处理都遵循国家法律法规及动物伦理学要求。
实验仪器选用AB Triple TOF 6600质谱仪(美国SCIEX公司)、Agilent 1290 Infinity LC(美国LC公司)、低温高速离心机(型号5430,德国Eppendorf公司)、PCR扩增仪(型号2720,ABI公司)、电泳仪(型号DYY-6C,北京六一公司)、凝胶成像系统(型号BG-gdsAUTO,北京百晶公司)、Morris水迷宫仪器(型号XR-XM101,上海欣欣公司)等;试剂选用Agarose(型号75510-019,Invitrogen公司)、Marker(型号DL2000,Takara公司)、TAE(型号AM9870,Invitrogen公司)等。
1.2 昼夜节律紊乱模型与运动训练方案
以灯光模拟昼夜节律,光照周期改变诱导中央生物钟紊乱模型[19]。CC组小鼠用正常光周期暴露(12 h光照/12 h黑暗周期,光照:6:00—18:00,黑暗:18:00—6:00),紊乱组小鼠按照文献[20-21]所述方法进行明暗周期调整,采用轮回颠倒的光照周期暴露,即在第1~3 d的光照条件为黑暗:6:00—18:00,光照:18:00—6:00,在第4~6 d调整光照条件为光照:6:00—18:00,黑暗:18:00—6:00,6 d为1个循环,经过7个循环,共6周[22]。用LED灯模拟自然光照,光照强度为200 lux。
采用动物实验跑台,坡度为0°,DM组和DH组进行6周的运动,每周运动6 d,周天休息。在正式干预前进行为期1周的适应性训练,测试最大跑速。根据孟宪欣等[23]使用的老鼠跑速与最大摄氧量(VO2max)关系制定运动训练方案。采用递增负荷动物跑台测试,初始速度为10 m/min,每2 min递增2 m/min,直到小鼠力竭。记录力竭时的速度,以此速度上一级速度作为最大摄氧量对应的速度。每2周测定1次最大跑速,在最大速度提高时进行相应的调整。正式训练前后以6 m/min(40%VO2max)的速度进行5 min热身和放松,正式训练时DM组以11 m/min(70%VO2max)的速度运动,运动时间为44 min,DH组起始速度为8 m/min(50%VO2max),时间为5 min;之后进行高强度运动,速度为14 m/min(90%VO2max),运动4 min,依次交替5个循环,最终保证2个组运动的总距离相同。
由于在运动过程中拒跑、受伤等,共剔除5只小鼠,最终样本量n=55,其中,CC组n=15、DC组n=15、DM组n=13和DH组n=12。
1.3 动物取材与结肠组织HE染色
每组6只小鼠通过Morris水迷宫检测认知功能,对剩余小鼠通过直肠按摩手法促使小鼠排便,用2 mL无菌EP管直接收集动物粪便2~3粒,−80 ℃保存,以便检测粪便代谢物,然后麻醉后打开腹腔,取出结肠,用0.9%氯化钠溶液冲洗干净,测量结肠长度后,截取中段结肠2块,每块约0.6 cm,其中,一块置于液氮保存后转入−80 ℃冰箱,另一块置于4%多聚甲醛固定液中保存。
取4%多聚甲醛灌注固定的结肠组织,然后进行石蜡切片脱蜡至水、苏木素染色、伊红染色、脱水封片、显微镜镜检、图像采集分析。用苏木素-伊红(HE)对结肠组织进行染色以观察结肠组织形态是否完整,是否有炎性细胞浸润。
1.4 Morris水迷宫检测认知功能
Morris水迷宫是对啮齿动物空间学习和记忆能力的一种测试。Morris水迷宫选用小鼠通用型圆桶,水中加白色染料,在水池壁的边沿均匀分布4个几何标记,由此将水池等分为4个象限,选第4象限(目标象限)正中位置放置没入水下0.02 m的平台。实验共分为6 d,前5 d是定位航行实验,通过小鼠的平台潜伏期和游泳距离来评价小鼠的学习能力。最后1 d是空间探索实验,通过小鼠穿越站台次数、在目标象限游泳时间百分比和初次抵达平台时间来评价小鼠的空间记忆能力。
1.5 16S rRNA检测肠道菌群
微生物总DNA提取:采用OMEGA Soil DNA Kit(D5635-02, USA)试剂盒提取DNA。对抽提完成的DNA以0.8%琼脂糖凝胶电泳进行分子大小判断,利用Nanodrop对DNA进行定量分析。
PCR扩增:细菌项目选用长度约为480 bp的细菌16S rRNA基因的高度可变的V3-V4区来测序。PCR扩增选用细菌16S rRNA V3-V4区特异性引物338F(5′-barcode+ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。PCR采用NEBQ5 DNA高保真聚合酶,体系有0.25 μLQ5 high-fidelity DNA polymerase、5 μL5×Reaction Buffer、5 μL5× High GC Buffer、2 μLdNTP(10 mM)、1 μL正向和反向引物(10 uM)、8.75 μL水和2 μLDNA 模板组成。进行以下参数循环:在 PCR 仪上于 98 ℃预变性 5 min,然后进入扩增循环。25个循环(98 ℃ 30 s、53 ℃ 30 s、72 ℃ 45 s),后在 72 ℃保持 5 min,12 ℃保存。扩增结果进行2%琼脂糖凝胶电泳,切取目的片段然后用 Axygen 凝胶回收试剂盒回收目的片段。
测序数据处理:在 Illumina NovaSeq 机器上利用 NovaSeq 6000 SP Reagent Kit (500 cycles)对合格的文库进行 2×250 bp 的双端测序。首先将需要上机的文库(Index不可重复)梯度稀释到2 nM,然后按所需数据量比例混样。混好的文库经0.1 N NaOH变性成单链进行上机测序。所上文库量的多少可根据实际情况控制在15~18 pM。
1.6 LC-MS检测粪便代谢物
代谢物提取:样本在4 ℃环境下缓慢解冻后,取适量样本加入预冷甲醇/乙腈/水溶液,涡旋混合,低温超声30 min,−20 ℃静置 10 min,14000 g 4 ℃离心20 min,取上清真空干燥,质谱分析时加入100 μL乙腈水溶液复溶,涡旋,14000 g 4 ℃离心 15 min,取上清液进样分析。
代谢物检测:色谱条件仪器采用 Agilent 1290 Infinity LC 超高效液相色谱系统(UHPLC)HILIC 色谱柱进行分离,柱温 25 ℃,流速 0.5 mL/min,进样量 2 μL,流动相组成 A:水+25 mM乙酸铵+25 mM氨水。B:乙腈。梯度洗脱程序:0~0.5 min,95% B;0.5~7 min,B从95%线性变化至65%;7~8 min,B从 65%线性变化至40%;8~9 min,B 维持在 40% ;9~9.1 min,B从40%线性变化至95%;9.1~12 min,B维持在 95%;整个分析过程中样品置于4 ℃自动进样器中。样本队列中插入QC样品,用于监测和评价系统的稳定性及实验数据的可靠性,样品经用Agilent 1290 Infinity LC超高效液相色谱系统分离后,用 Triple TOF 6600 质谱仪进行质谱分析,分别采用电喷雾电离(ESI)正离子和负离子模式进行检测。
数据分析流程:原始数据经ProteoWizard转换成.mzXML格式,然后采用XCMS软件进行峰对齐、保留时间校正和提取峰面积。对XCMS提取得到的数据首先进行代谢物结构鉴定、数据预处理,然后进行实验数据质量评价,最后再进行数据分析。
1.7 统计分析
实验数据采用SPSS 25.0软件进行统计学处理,各组的相关指标值用均值±标准差(x±s)表示。在Morris水迷宫实验中,对来自定位航行训练的数据通过重复测量方差分析进行处理,空间探索实验采用单因素方差分析,多重比较分析则采用LSD法。P<0.05表示差异有统计学意义。使用QIIME软件对肠道菌群进行Alpha和Beta多样性分析,使用R语言工具绘制Alpha多样性指数图和主坐标分析(PCoA)的结果图,组间差异采用Wilcoxon秩和检验。物种差异分析采用线性判别分析(LEfSe)。在代谢组学分析中,采用单变量统计分析(火山图)、多维统计分析中的主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA)对不同组别昼夜节律紊乱小鼠的代谢物进行分析,将筛选出的关键差异性代谢物导入MetaboAnalyst 5.0中进行通路分析,并与京都基因与基因组百科全书(KEGG)数据库比较确定可能影响的代谢通路。采用斯皮尔曼相关分析(Spearman's correlation analysis)对认知功能、肠道菌群和非靶向代谢组学结果进行相关性分析。
2. 结 果
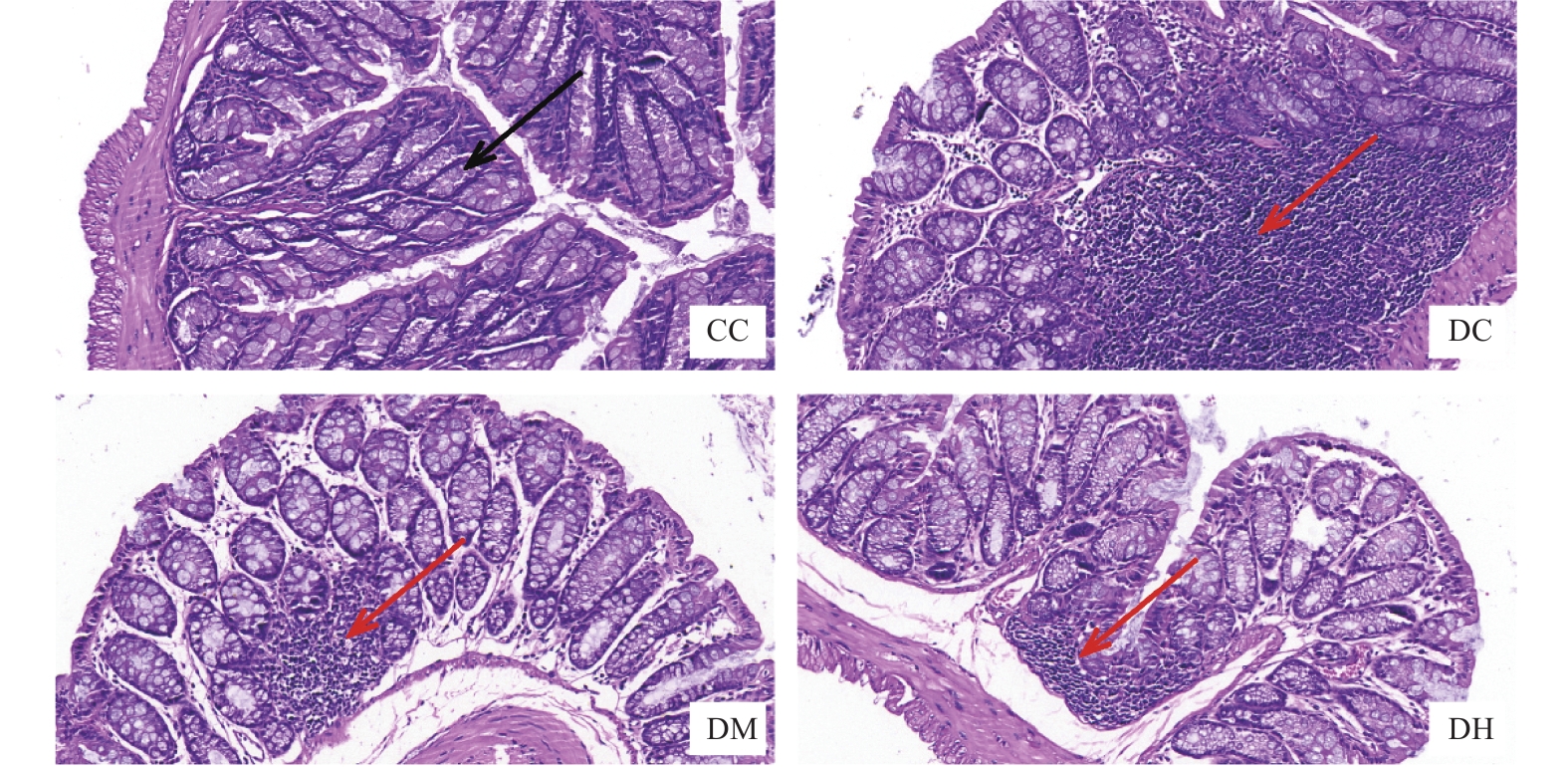
2.1 MICT与HIIT对昼夜节律紊乱小鼠结肠组织形态的影响
如图1黑色箭头所示,CC组小鼠结肠黏膜上皮细胞排列整齐,结构清晰,组织形态基本正常,无炎性细胞浸润。如图1红色箭头所示,与CC组相比,DC组小鼠腺体排列紊乱,多数不完整甚至消失,大量炎性细胞浸润,溃疡形成。与DC组相比,DM组和DH组可见腺体破坏程度及炎性细胞浸润程度有所改善,腺体排列较为整齐,且DM组与DH组之间无显著差异。
2.2 MICT与HIIT对昼夜节律紊乱小鼠认知功能的影响
2.2.1 Morris水迷宫定位航行训练结果
定位航行训练通过小鼠的逃避潜伏期和游泳距离来评价小鼠的学习能力。分析各组小鼠在定位航行训练中平均逃避潜伏期的变化。由表1可知,DC组小鼠的平均逃避潜伏期显著长于CC组(P<0.01),DM组和DH组的平均逃避潜伏期显著短于DC组(P<0.01)。图2结果显示,在历时5 d的水迷宫定位航行训练过程中,随着定位航行训练次数增加,各组小鼠平均逃避潜伏期显著缩短,只有DM组在第3天后趋于稳定。对各组小鼠平均逃避潜伏期分析发现,第1天4组均未出现显著性差异(P>0.05),但从第2天开始到训练结束,在每天的定位航行训练中,DC组小鼠平均逃避潜伏期均显著长于CC组(P<0.05或P<0.01),DH组小鼠平均逃避潜伏期均显著短于DC组(P<0.05或P<0.01)。
表 1 Morris水迷宫实验各指标比较Table 1. Comparison of each index in Morris water maze experiment组别 逃避潜伏期/s 游泳距离/cm 穿越平台次数/次 目标象限游泳时间百分比/% 初次抵达平台时间/s CC 22.26±2.73 504.67±67.25 4.75±0.96 36.54±4.84 21.29±2.61 DC 32.97±3.16** 620.79±83.46* 2.75±0.81** 24.39±3.24** 32.82±3.82** DM 24.93±2.92◆◆ 555.04±79.39◆ 4.25±0.58◆ 30.64±3.51◆ 24.41±2.86◆◆ DH 24.48±2.89◆◆ 548.19±75.83◆ 4.05±0.52◆ 29.75±3.87◆ 23.86±2.39◆◆ 注:与CC组相比,*表示P<0.05,**表示 P<0.01;与DC组相比,◆表示P<0.05,◆◆表示P<0.01。 各组小鼠在定位航行训练中游泳距离的变化如表1所示。DC组小鼠平均游泳距离显著长于CC组(P<0.05),DM组和DH组小鼠平均游泳距离显著短于DC组(P<0.05),说明昼夜节律紊乱对小鼠的学习能力造成了一定影响,运动对昼夜节律紊乱导致的学习能力下降起到改善作用。
2.2.2 Morris水迷宫空间探索实验结果
空间探索实验通过小鼠穿越平台次数、在目标象限游泳时间百分比和初次抵达平台时间来评价小鼠的记忆能力(表1,图3)。
对各组小鼠在空间探索实验中的变化进行分析可知,在第6天撤出平台后,小鼠60 s内均表现出对原有平台的记忆,刚放进水中就表现出对原有平台的搜索。DC组穿越平台次数和目标象限游泳时间百分比显著少于CC组(P<0.01),初次抵达平台时间显著长于CC组(P<0.01)。DM组和DH组穿越平台次数和目标象限游泳时间百分比显著多于DC组(P<0.05),初次抵达平台时间显著短于DC组(P<0.01)。上述结果表明,昼夜节律紊乱会破坏小鼠的空间记忆能力,运动干预会对昼夜节律紊乱导致的空间记忆能力下降起到改善作用。
2.3 MICT与HIIT对昼夜节律紊乱小鼠肠道菌群的影响
2.3.1 OTU Venn图分析
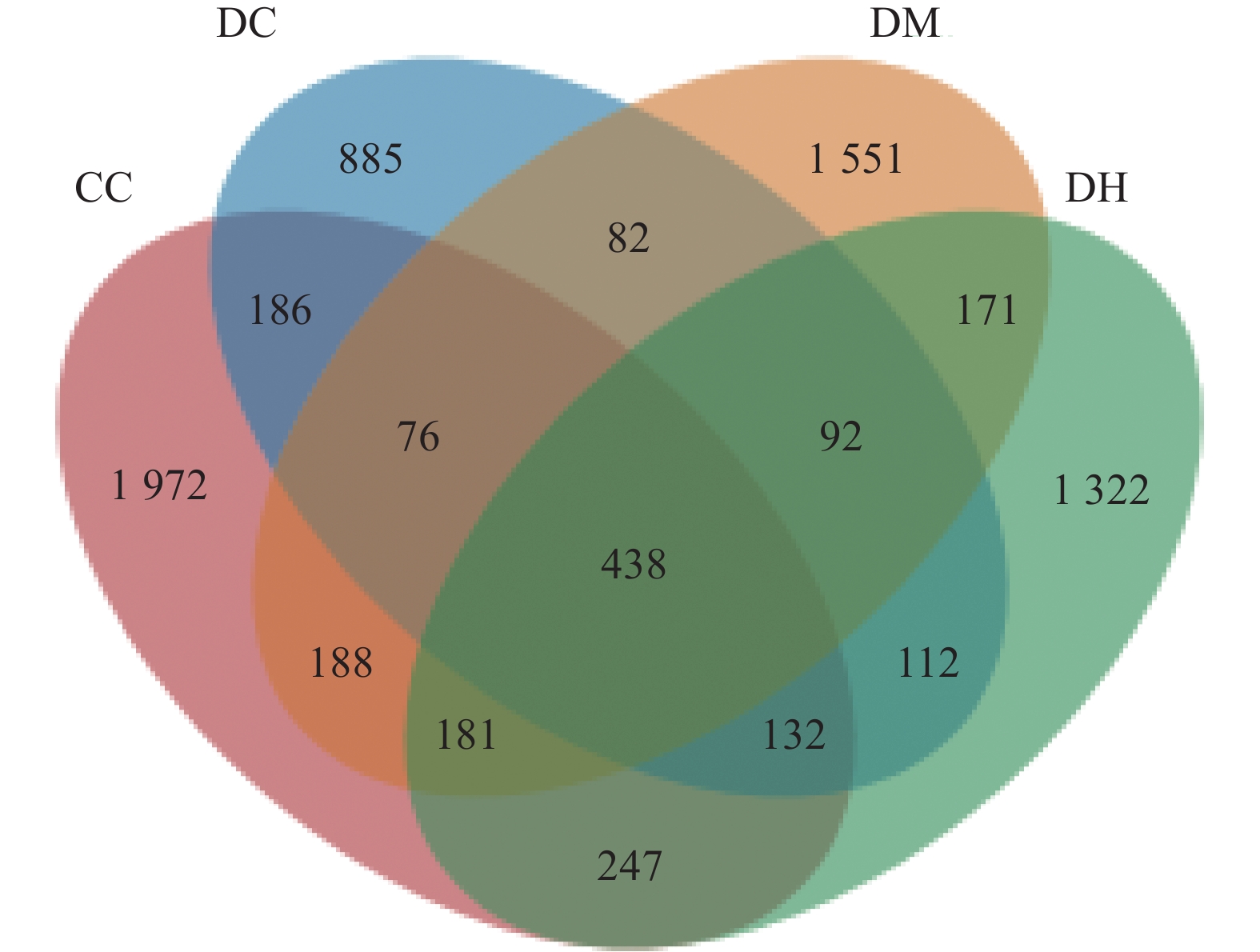
把相似度设置为97%进行聚类分析,获得OTU并绘制Venn图(图4),Venn图可直观反映样本中物种的组成相似性及重叠情况。4组样本共得到10907个OTUs,CC组、DC组、DM组和DH组小鼠OTUs数目分别为3420、2003、2779和2705个,其中共有OTUs为438个,CC组、DC组、DM组和DH组小鼠特有OTUs数目分别为1972、885、1551和1322个。
2.3.2 Alpha多样性分析
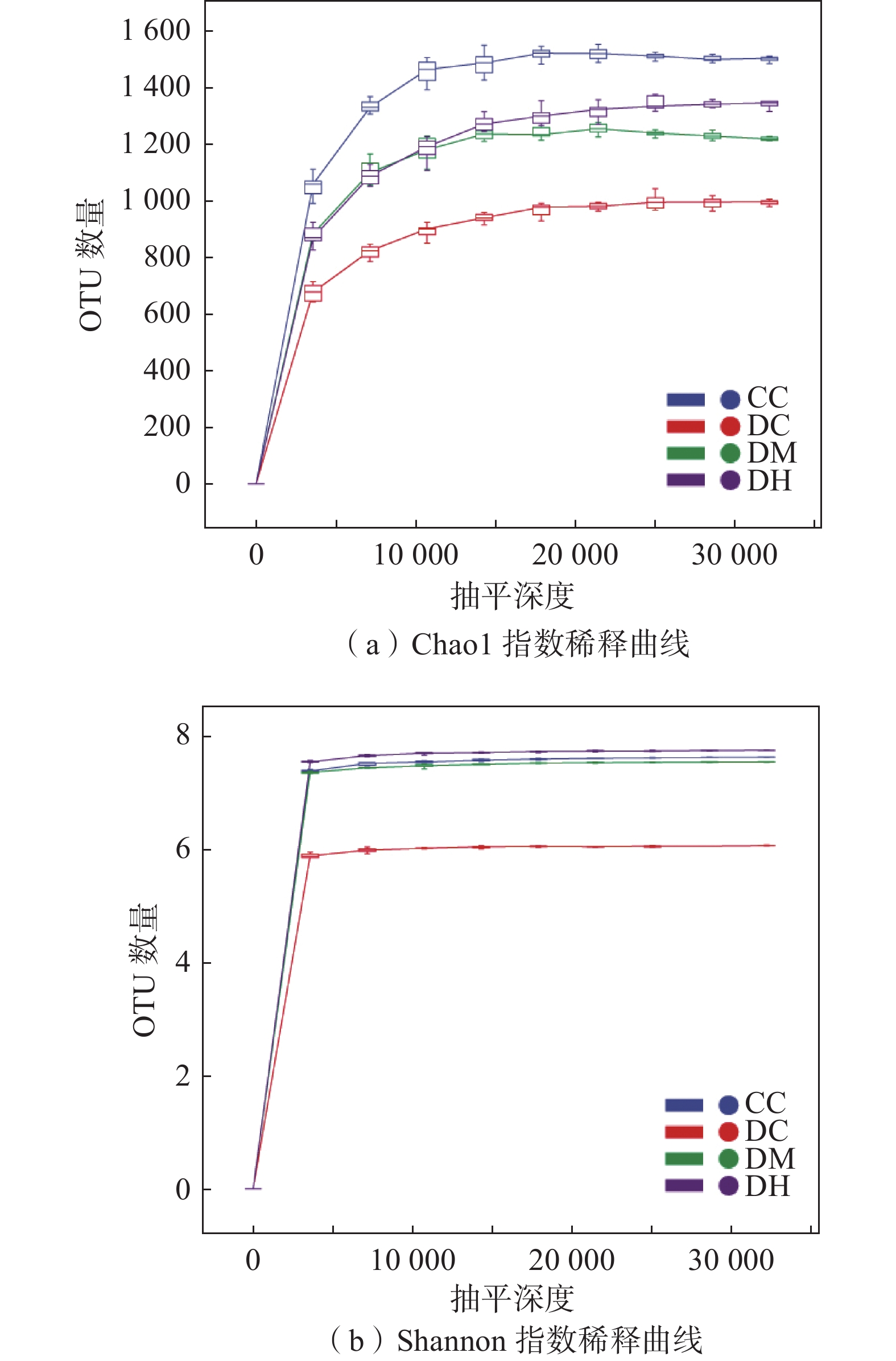
Alpha多样性指数与OTU表的抽平深度有关,为了探究样本Alpha多样性随抽平深度的变化趋势,可绘制稀释曲线。稀释曲线的平缓程度反映了测序深度对观测样本多样性的影响,曲线越平缓,表明测序结果反映当前样本所包含多样性的程度越高,继续增加测序深度无法检测到大量尚未发现的新OTU[24]。如图5所示,Chao1指数稀释曲线和Shannon指数稀释曲线随着测序数量的增加都趋于平坦,表明测序数据量足够大,可以反映样本中绝大多数的微生物多样性信息。
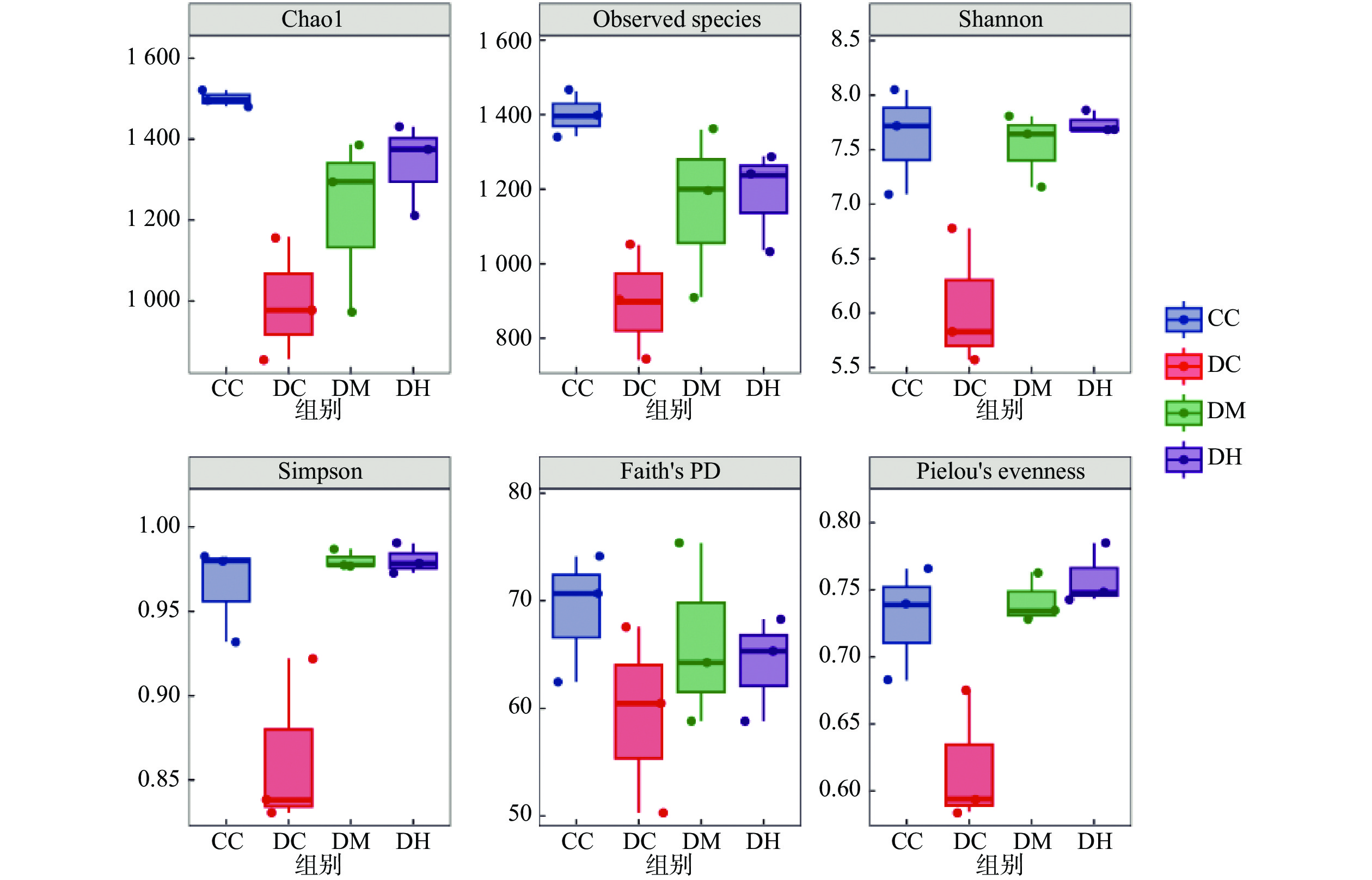
为了能较为全面地评估肠道菌群的Alpha多样性,以Chao1指数[25]和Observed species指数代表菌群的丰富度,DC组Chao1指数和Observed species指数均显著低于CC组(P<0.01),DH组的Chao1指数显著高于DC组(P<0.05)。以Shannon指数[26]和Simpson指数[27]反映群落的多样性,DC组的Shannon指数和Simpson指数最低,CC组、DM组和DH组均显著高于DC组(P<0.01)。以Faith's PD指数[28]表征基于进化的多样性,各组间不具有统计学意义(P>0.05)。以Pielou's evenness指数[29]表征均匀度,DC组的Pielou's evenness指数最低,CC组、DM组和DH组均显著高于DC组(P<0.01)。见图6、表2。
表 2 肠道菌群Alpha多样性分析Table 2. Alpha diversity analysis of gut microbiota指数 CC组 DC组 DM组 DH组 Chao1 1499.91±20.78 997.48±151.94** 1217.42±218.97 1339.81±112.63◆ Observed species 1401.37±60.67 897.63±154.26** 1157.8±227.62 1188.37±133.57 Shannon 7.62±0.49 6.06±0.64** 7.54±0.34◆◆ 7.74±0.1◆◆ Simpson 0.96±0.03 0.86±0.05** 0.98±0.01◆◆ 0.98±0.01◆◆ Faith's PD 69.13±6 59.47±8.69 66.18±8.44 64.17±4.85 Pielou's evenness 0.73±0.04 0.62±0.05** 0.74±0.02◆◆ 0.76±0.02◆◆ 注:与CC组相比,*表示P<0.05,**表示P<0.01;与DC组相比,◆表示P<0.05,◆◆表示P<0.01。 2.3.3 Beta多样性分析
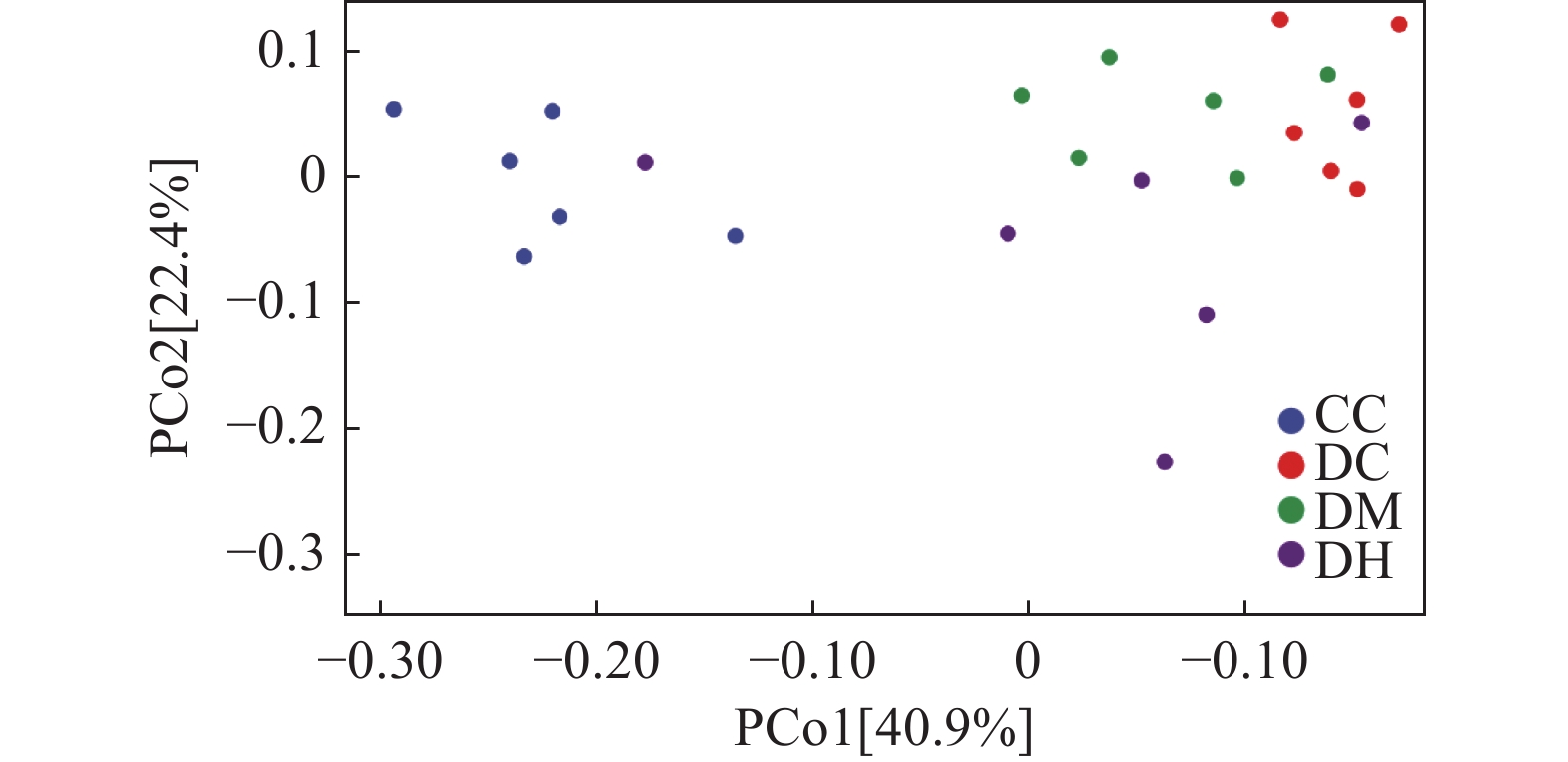
Beta多样性分析可以评估不同组间微生物群落间的差异,本文主要通过主坐标分析(PCoA)方法进行。采用Weighted Unifrac距离算法,距离越近,相似性越高。如图7所示,通过多元方差分析(Adonis)得出P=0.019<0.05,差异具有显著性。各组样本位置区分明显:CC组分布于左上象限,DC组和DM组分布于右上象限,DH分布于右侧象限,其中1个样品靠近CC组样品,应该是个体差异所致;DC组、DM组和DH组在位置上比较近且有交叉分布,距离CC组位置较远。
2.3.4 分类学组成分析
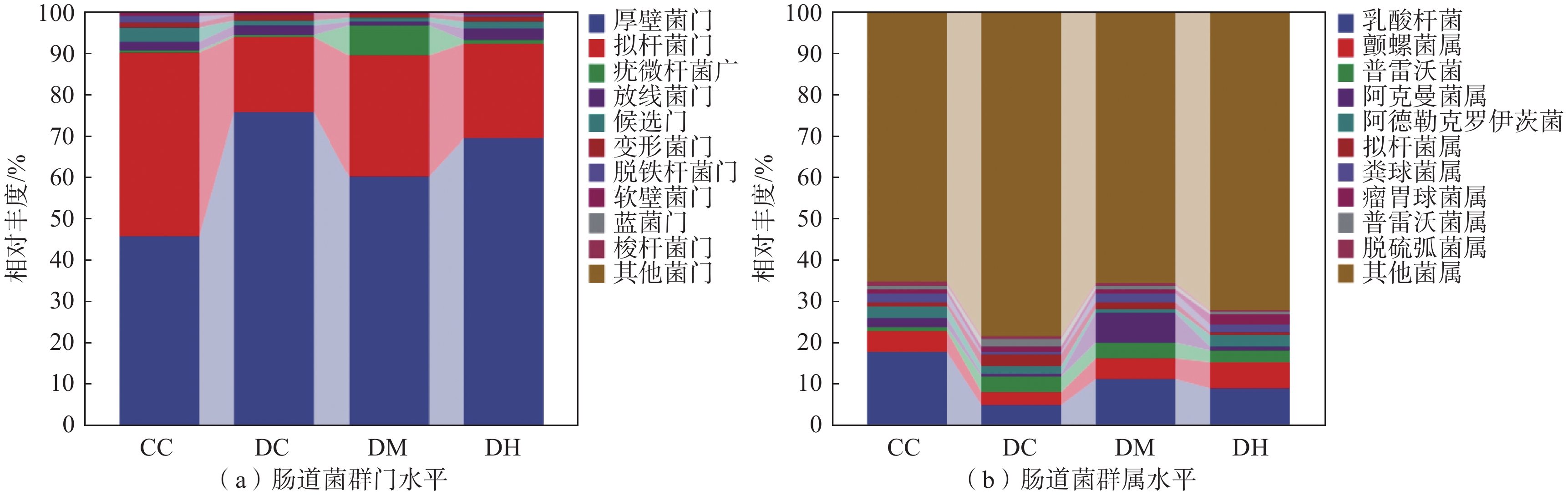
从门和属水平考察运动对昼夜节律紊乱小鼠肠道菌群种类和丰度的影响门水平的相对丰度如图8(a)所示,肠道中最常见的2种微生物就是厚壁菌门和拟杆菌门,在结肠内,占据90%以上的肠道菌群为主要优势菌门。肠道菌群失调时厚壁菌门和拟杆菌门的丰度比值(Firmicutes/Bacteroidetes,F/B)升高[30]。CC组F/B为1.02,DC组F/B比值增加,DM组和DH组F/B比值有一定程度下调。
如图8(b)所示,在属分类水平上,4个分组中相对丰度排名前4位的菌群为乳酸杆菌(Lactobacillus)、颤螺菌属(Oscillospira)、普雷沃菌(Prevotella)和阿克曼菌属(Akkermansia)。与CC组相比,DC组小鼠肠道菌群中乳酸杆菌、颤螺菌属和阿克曼菌属相对丰度下降,普雷沃菌相对丰度升高。与DC组相比,DM组和DH组乳酸杆菌、颤螺菌属和阿克曼菌属相对丰度升高,普雷沃菌相对丰度下降。
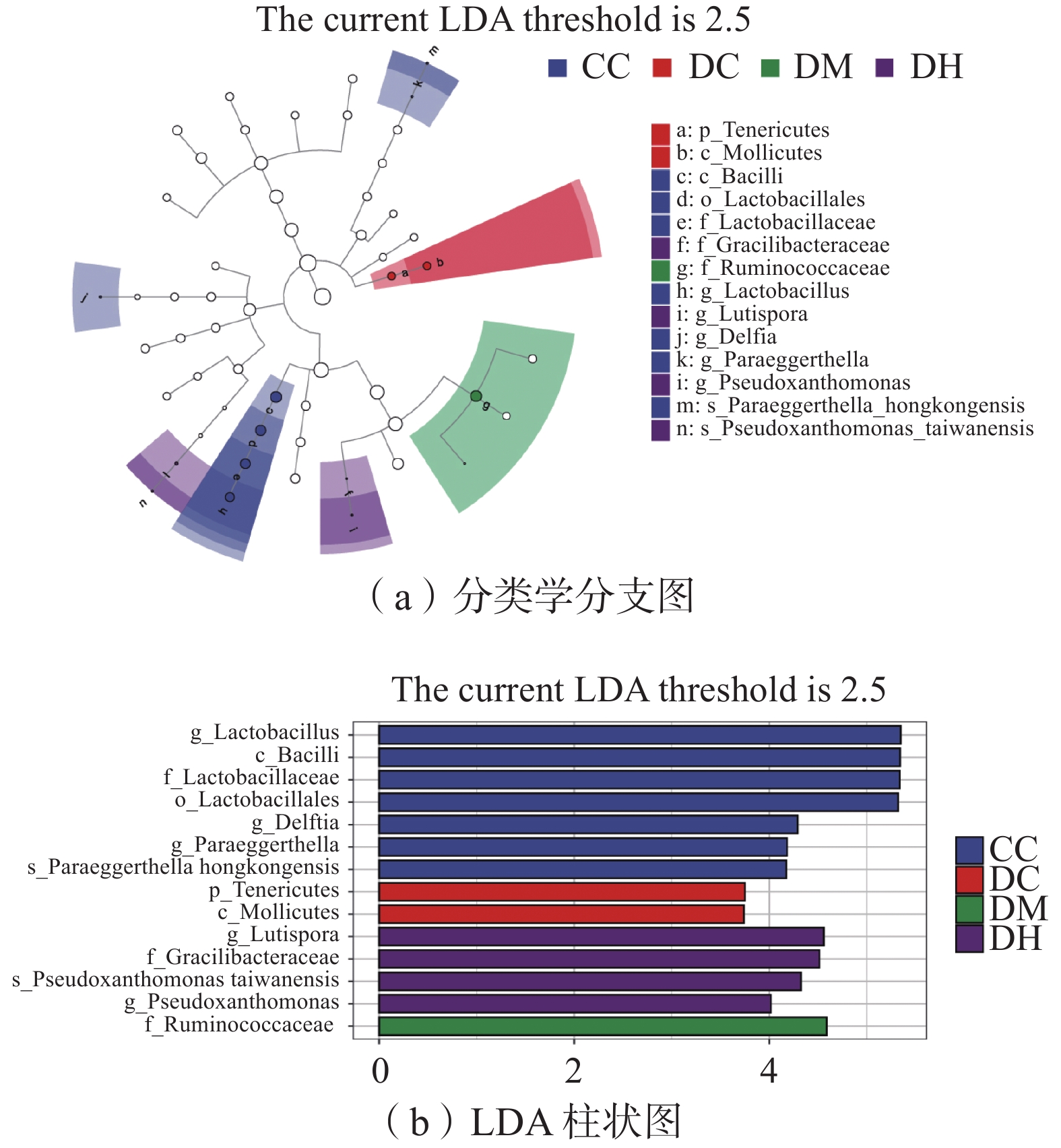
2.3.5 组间差异物种鉴定
利用线性判别分析效应量(LEfSe)发现组间丰度有显著差异的物种。设定线性判别分析(LDA)值为2.5,共筛选出14个生物标志物,包括1个门、2个纲、1个目、3个科、5个属水平、2个种水平。如图9所示,在CC组丰度显著较高的肠道菌群中,纲水平上有芽孢杆菌纲(Bacilli,P=0.038),目层级上有乳杆菌目(Lactbacillales,P=0.038),科水平上有乳酸杆菌科(Lactobacillaceae,P=0.038),属水平上有乳酸杆菌属(Lactobacillus,P=0.037)和代尔夫特菌属(Delftia,P=0.013)等,种水平上有细菌放线菌种(Paraeggerthella hongkongensis,P=0.025)。DC组丰度较高的菌群为软壁菌门(Tenericutes,P=0.041)和柔膜菌纲(Mollicutes,P=0.041),DM组丰度较高的菌群为瘤胃球菌科(Ruminococcaceae,P=0.031),DH组丰度较高的菌群为Lutispora和假黄单胞菌属(Pseudoxanthomomas,P=0.025)等。
2.4 MICT与HIIT对昼夜节律紊乱小鼠代谢组学的影响
2.4.1 代谢物化学分类归属统计
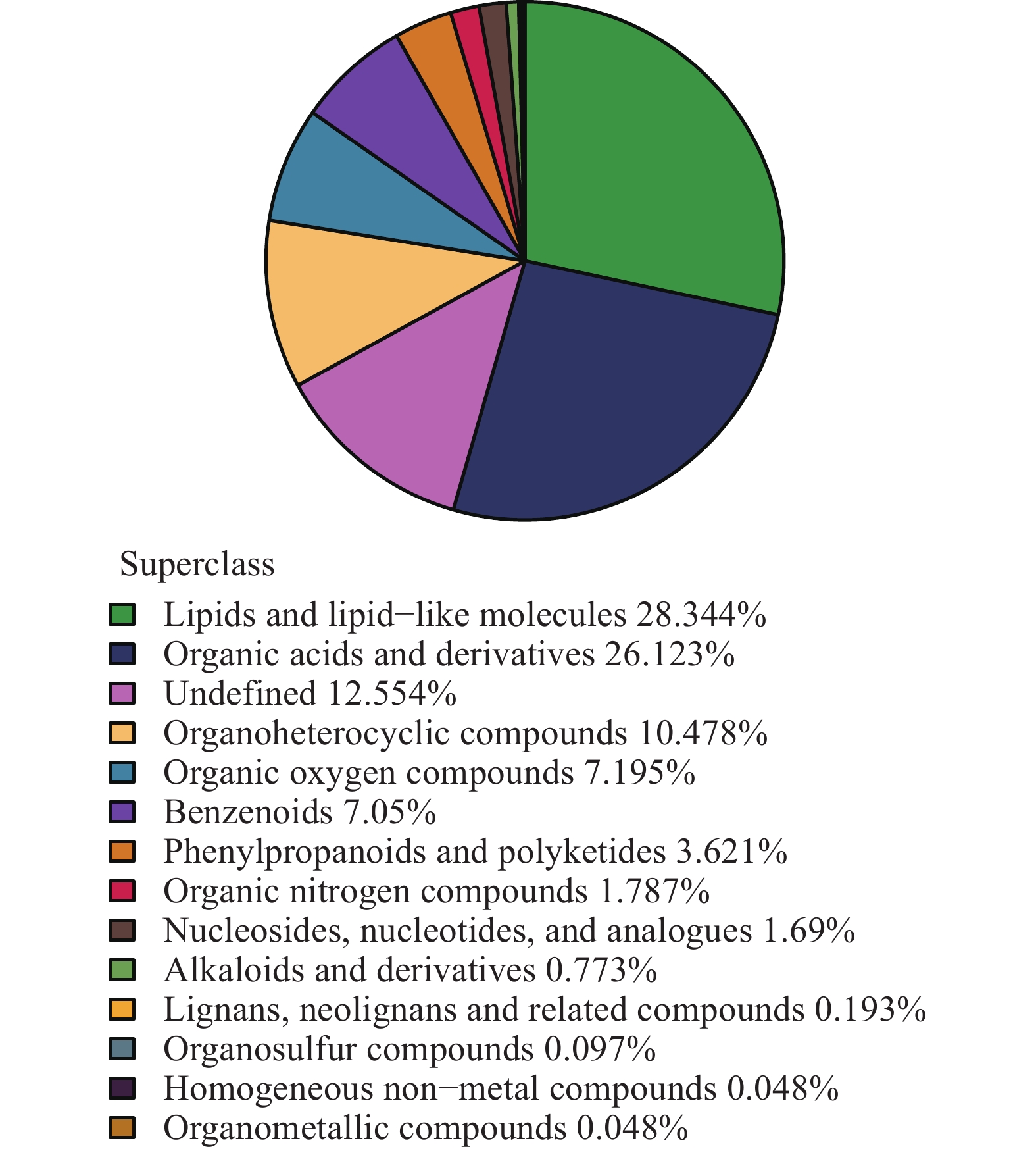
将鉴定到的所有代谢物根据化学分类进行归属统计,各类代谢物数量所占比例如图10所示。其中,脂类和类脂分子最多,占28.34%;有机酸及其衍生物次之,占26.12%;没有化学分类归属的代谢物占12.55%,除此之外,主要代谢物还有有机杂环化合物、有机含氧化合物和苯类化合物等其他化合物。
2.4.2 代谢物统计学分析
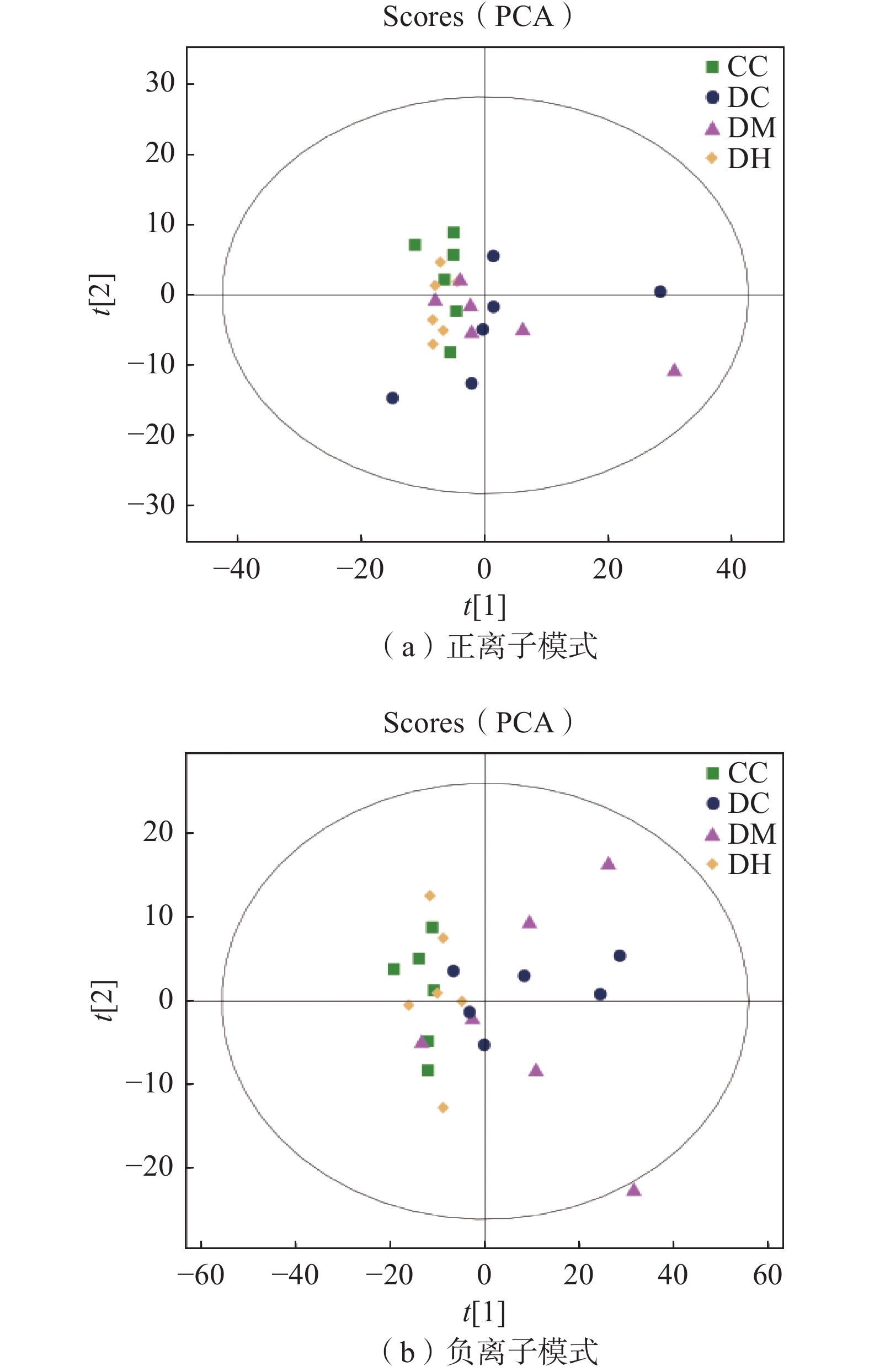
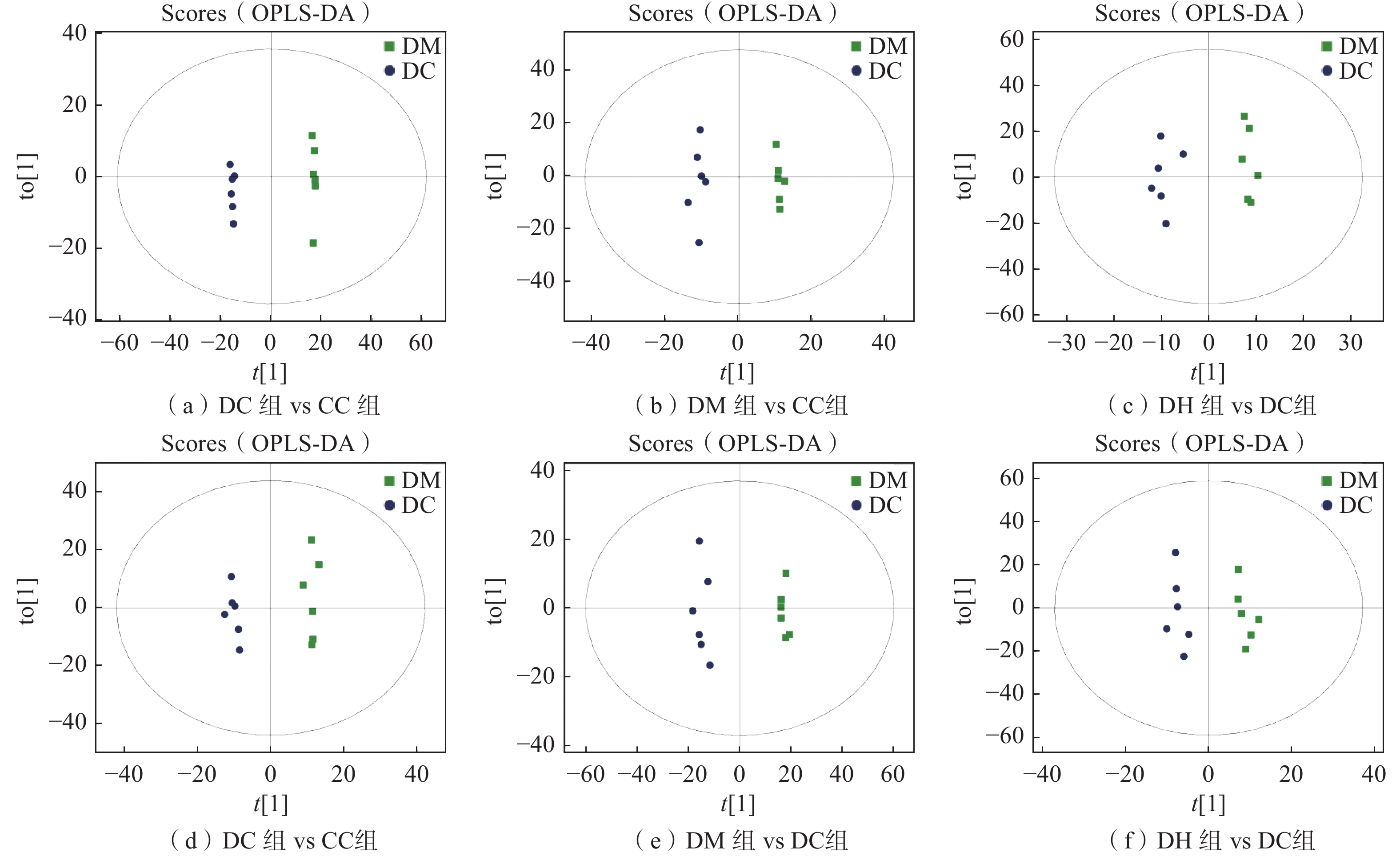
首先使用PCA模型观察各个分组间的变化趋势。其中DC组vs CC组、DM组vs DC组、DH组vs DC组在正离子模式下的模型解释率(R2X)分别为0.698、0.644、0.625,在负离子模式下的模型R2X分别为0.744、0.709、0.67。如图11所示,在正离子模式下各组样本均位于95%置信区间内,可以看出各组样本基本上可以区分开,在负离子模式下各组趋势没有在正离子模式下明显。为进一步了解各组间的代谢差异物,引入OPLS-DA模型。
OPLS-DA得分如图12所示,不管是在正离子模式还是负离子模式下,各组样本内部均未分散,样本间有明确划分。其中:DC组vs CC组、DM组vs DC组、DH组vs DC组的验证参数R2X、R2Y、Q2在正离子模式下分别为0.804、0.994、0.876,0.751、0.997、0.825,0.514、0.978、0.294;在负离子模式下分别为0.734、0.998、0.813,0.793、0.96、0.925;0.597、0.972、0.262。由此说明,在正离子模式和负离子模式下模型均有较好的可靠性。
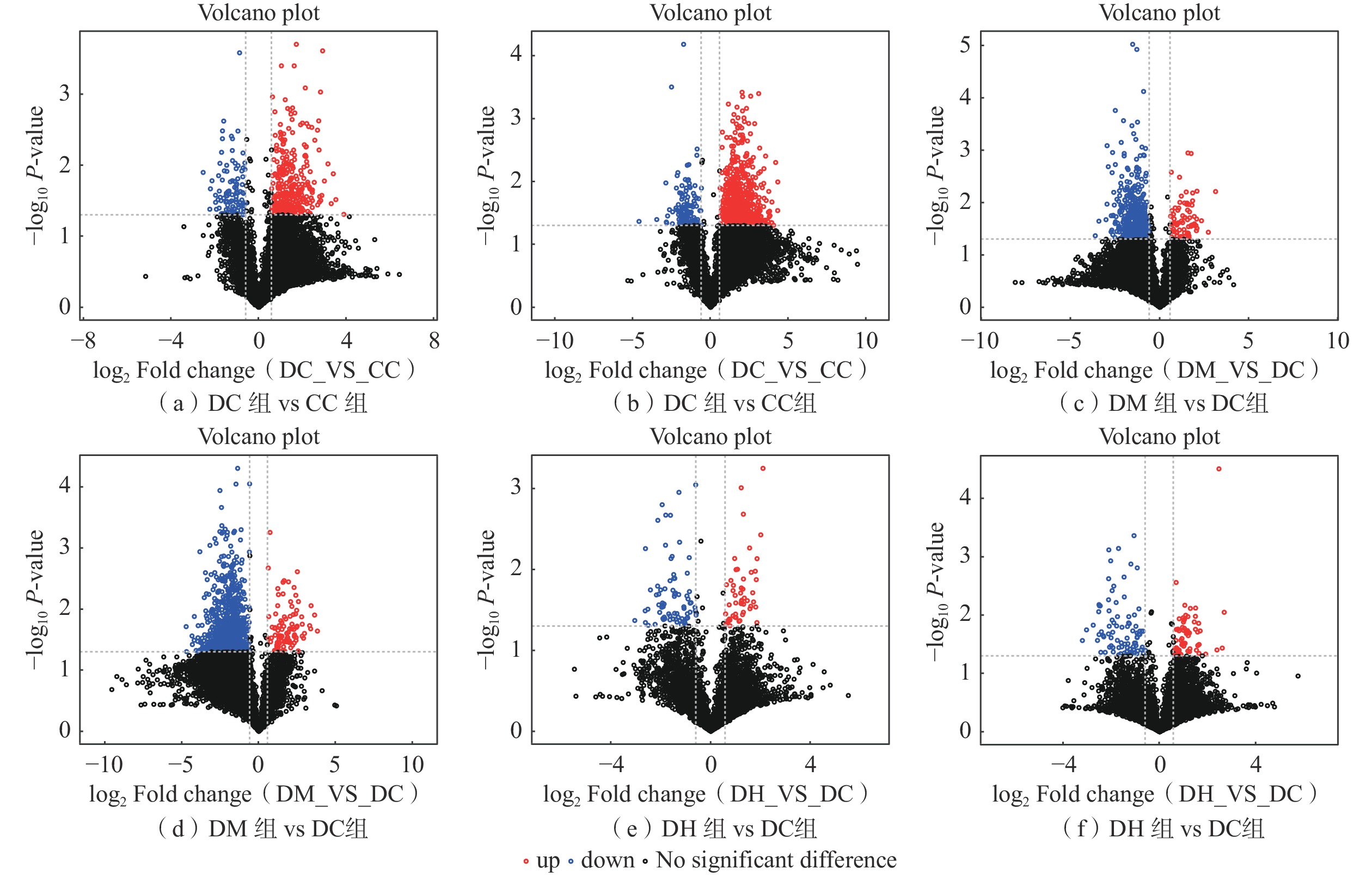
2.4.3 差异代谢物筛选
鉴定到的所有正负离子模式共有2071种代谢物,其中,正离子模式下鉴定到的代谢物有1308种,负离子模式下鉴定到的代谢物有763种。对正离子和负离子模式下鉴定到的代谢物进行差异筛选,首先采用t检验,阈值为P< 0.01,执行VIP> 1,以FC≥1.5或FC≤0.5为显著差异代谢物筛选标准,共筛选到12种有显著差异的代谢物(表3)。将筛选出的差异代谢物用火山图进行可视化处理,如图13所示,其中,红色代表上调的代谢物,蓝色代表下调的代谢物,黑色代表非显著性差异代谢物。
表 3 各比较组组间显著差异代谢物Table 3. Significantly different metabolites between groups in each comparison group分组 名称 采集模式 VIP 差异倍数 P 趋势 DC vs CC 姜黄素(Curcumin) ESI+ 1.23 0.21 0.00391 ↓ 花生四烯酸(Arachidonic Acid) ESI− 3.53 0.23 0.00424 ↓ 去氧皮质酮乙酸酯(Deoxycorticosterone acetate) ESI+ 1.14 0.43 0.00425 ↓ 油酸(Oleic acid) ESI− 18.11 0.25 0.00611 ↓ 苯丙氨酸(Phenylalanine) ESI− 7.26 7.57 0.00622 ↑ 色氨酸(Tryptophan) ESI− 3.68 0.25 0.00759 ↓ 2'-脱氧肌苷(2'-deoxyinosine) ESI+ 1.59 6.73 0.00111 ↑ DM vs DC 丁酸(Butanoic acid) ESI− 6.53 3.15 0.00904 ↑ 肌酸(Creatine) ESI+ 7.12 2.66 0.00994 ↑ 甲硫氨酸(Methionine) ESI− 1.16 4.07 0.00115 ↑ 替米沙旦(Telmisartan) ESI− 2.67 0.10 0.00330 ↓ 二十二碳五烯酸n-6(DPAn-6) ESI− 1.71 0.39 0.00410 ↓ DH vs DC 花生四烯酸(Arachidonic acid) ESI− 3.53 2.03 0.00072 ↑ 胞嘧啶核苷(Cytidine) ESI+ 5.89 3.59 0.00681 ↑ 尿嘧啶(Uracil) ESI− 5.25 0.67 0.00111 ↓ 2.4.4 代谢通路分析
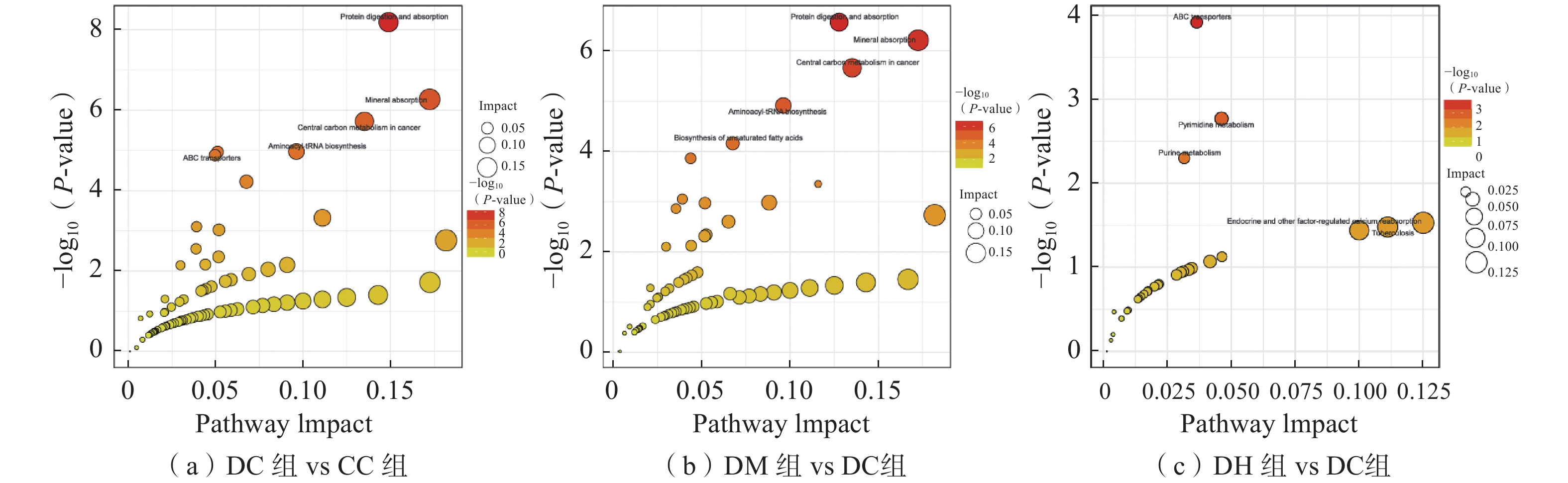
使用MetaboAnalyst 5.0对筛选出的差异代谢物进行通路分析,结果如图14所示。KEGG通路分析前,先合并正负离子模式筛选到的差异代谢物。结果显示,3个比较组中重要代谢通路均有ABC transporters(ABC转运蛋白)。气泡越大表示影响因子越大,气泡颜色越深表示富集程度越显著。
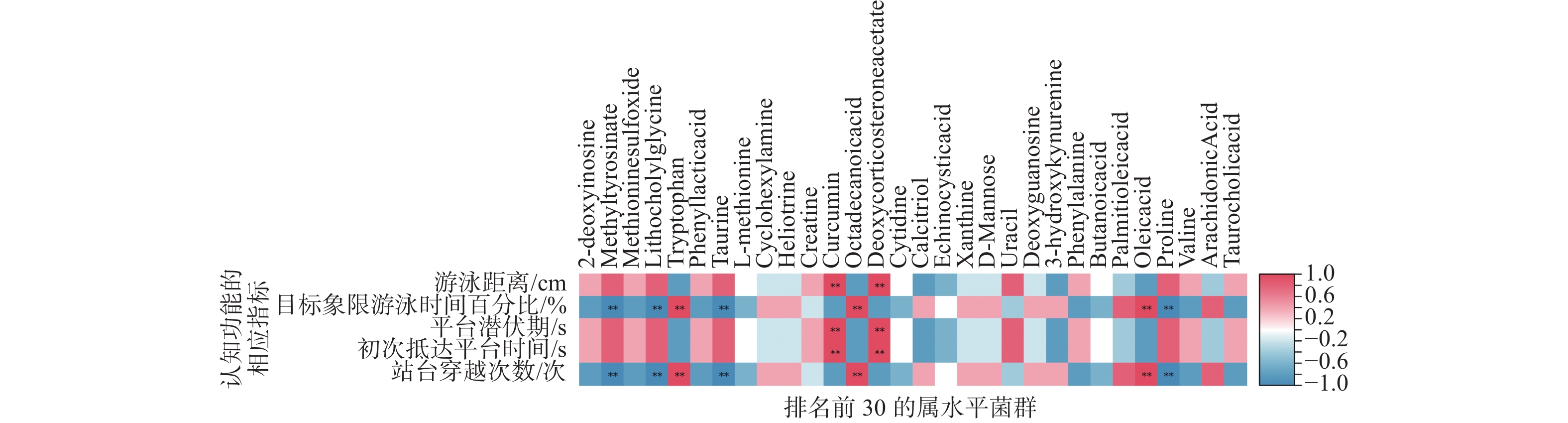
2.5 认知功能与肠道菌群及肠道代谢物的相关性
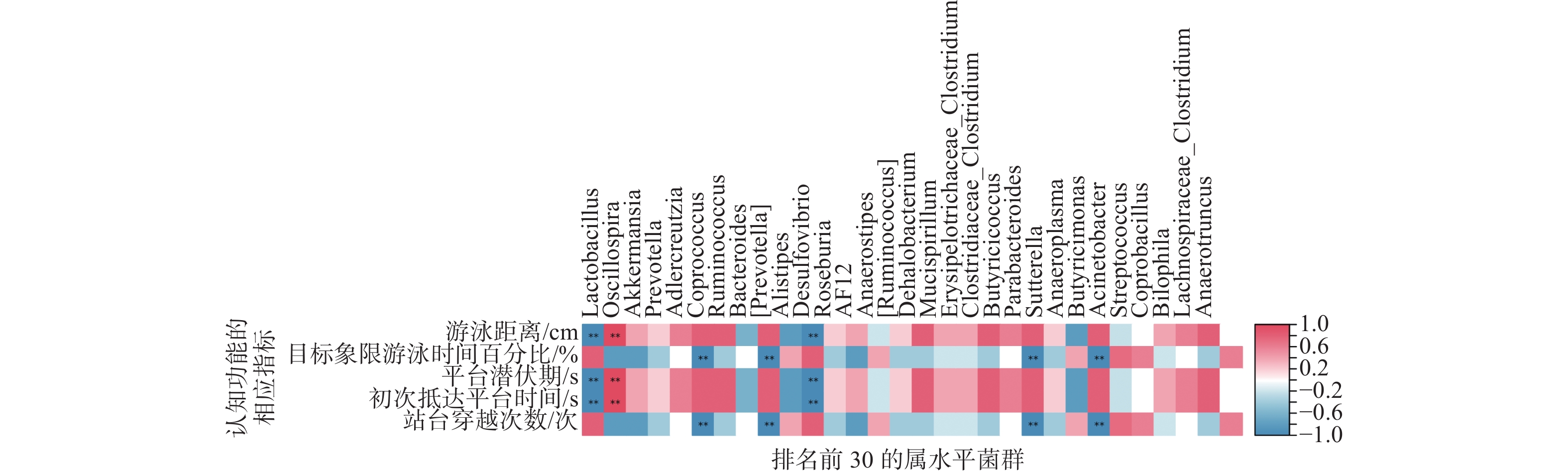
2.5.1 认知功能与肠道菌群的相关性
将认知功能与肠道菌群进行相关性分析,结果如图15所示。与学习能力(游泳距离、平台潜伏期)呈显著正相关的细菌有颤螺菌属(Oscillospira,P<0.01),呈显著负相关的有乳酸杆菌属(Lactobacillus,P<0.01)和脱硫弧菌属(Desulfovibrio,P<0.01);与空间记忆能力(目标象限游泳时间百分比、站台穿越次数)呈显著负相关的细菌有普雷沃菌属(Prevptella,P<0.01)和副拟杆菌属(Parabacteroides,P<0.01)等;与空间记忆能力(初次抵达平台时间)呈显著正相关的细菌有颤螺菌属(Oscillospira,P<0.01),呈显著负相关的有乳酸杆菌属(Lactobacillus,P<0.01)和脱硫弧菌属(Desulfovibrio,P<0.01)。
2.5.2 认知功能与肠道代谢物的相关性
将认知功能与代谢物进行相关性分析,结果如图16所示。与学习能力(游泳距离、平台潜伏期)呈显著正相关的差异代谢物有姜黄素(Curcumin,P<0.01)和去氧皮质酮乙酸酯(Deoxycorticosterone acetate,P<0.01);与空间记忆能力(目标象限游泳时间百分比、站台穿越次数)呈显著负相关的差异代谢物有牛磺酸(Taurine,P<0.01)和脯氨酸(Proline,P<0.01)等,呈显著正相关的有色氨酸(Tryptophan,P<0.01)和油酸(Oleic acid,P<0.01)等;与空间记忆能力(初次抵达平台时间)呈显著正相关的差异代谢物有去氧皮质酮乙酸酯(Deoxycorticosteron-e acetate,P<0.01)和姜黄素(Curcumin,P<0.01)。
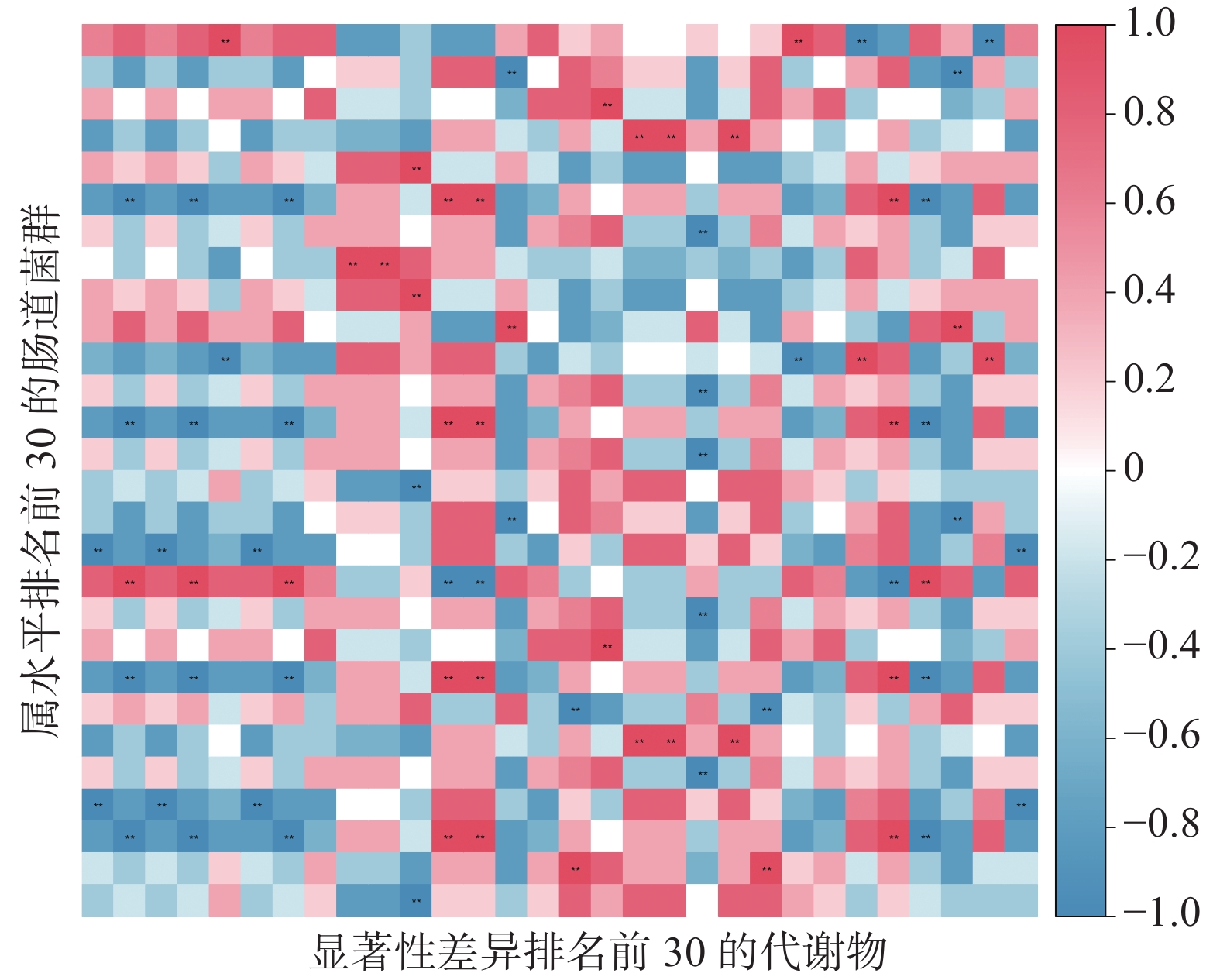
2.5.3 肠道菌群与肠道代谢物的相关性
将肠道菌群和代谢物进行相关性分析,结果如图17所示。在与认知有关的代谢物中,色氨酸(Tryptophan)与乳酸杆菌属呈显著正相关(P<0.01),与穆齐螺旋菌属(Mucispirillum)呈显著负相关(P<0.01);肌酸(Creatine)与拟杆菌属(Bacteroides)等呈显著正相关(P<0.01),与低嗜盐细菌属(Dehalobacterium)等呈显著负相关(P<0.01);尿嘧啶(Uracil)与粪球球菌属(Coprococcus)等呈显著负相关(P<0.01);脯氨酸(Proline)与瘤胃球菌属(Ruminococcus)等呈显著负相关(P<0.01),与厌氧原体属(Anaeroplasma)呈显著正相关(P<0.01)。
3. 讨 论
3.1 昼夜节律紊乱损害小鼠肠道菌群、代谢组学及认知功能
昼夜节律指生物体为适应地球自转而进化出约24 h的周期性振荡,主时钟位于大脑视交叉上核(SCN)的核团,利用电信号、多肽、激素等将环境的时间信号通过神经、体液的变化传递给心、肝、脾、肺、肾等外周时钟,使体内的时间与天文时间保持一致,当体内的时间与天文时间不一致时就发生了昼夜节律紊乱。昼夜节律紊乱成为现代社会一个普遍的现象,其发生往往与熬夜和睡眠障碍有关。昼夜节律主要依靠生物钟基因调控,目前发现的主要生物钟基因有PER1、PER2、PER3、CRY1、CRY2、CLOCK、BMAL1等[31]。
通过16S rRNA高通量测序发现昼夜节律紊乱会导致结肠菌群的丰度和多样性降低,且在门水平上厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)丰度比值升高,这一比值作为判断肠道菌群失衡的重要指标之一[32],结合Morris水迷宫实验和HE染色结果,可以证明昼夜节律紊乱小鼠模型的建立成功与否。在属水平上,DC组小鼠普雷沃菌(Prevotella)丰度高于CC组,CC组小鼠肠道菌群中乳酸杆菌(Lactobacillus)、颤螺菌属(Oscillospira)和阿克曼菌属(Akkermansia)丰度高于DC组。乳酸杆菌是肠道的益生菌,其生理作用在于维持肠道的生态平衡[33]。另有研究[34]证实,普雷沃菌定殖会使微生物群代谢发生变化,导致全身自身免疫。可见,昼夜节律紊乱后肠道菌群中有害菌丰度增加,有益菌丰度减少,肠道微生态平衡遭到破坏。
代谢组学是对生物样本中的代谢物进行全面检测和定量测定,以及对生物体受到某种刺激时引起代谢物发生的动态变化分析。利用LC-MS非靶向代谢组学分析对肠道代谢物进行检测发现,在已知与认知有关的代谢物中,DC组姜黄素(Curcumin)、花生四烯酸(Arachidonic Acid)、油酸(Oleic acid)和色氨酸(Tryptophan)等代谢物含量显著低于CC组,苯丙氨酸(Phenylalanine)等代谢物含量显著高于CC组。相关研究[35]证实,补充花生四烯酸可以改善健康老年男性与年龄相关的认知功能下降。还有文献[36]表明,色氨酸与认知功能呈复杂的非线性关系,色氨酸的实验操作以相反的方式分别介导时间和额叶认知功能。在进行昼夜节律紊乱干预后,DC组与CC组之间存在显著差异代谢物,认知功能也存在显著性差异。据此猜测,昼夜节律紊乱通过影响某些代谢物水平的变化进而影响认知功能。
昼夜节律紊乱容易引起神经性疾病,如认知功能障碍。睡眠参与认知过程,睡眠内稳态或昼夜节律紊乱可能导致与认知障碍相关的临床和生理变化[37]。夜间工作引起的昼夜节律紊乱可能会产生严重的即时负面影响,特别是对与注意力、记忆和反应抑制相关的认知领域。此外,认知能力会在连续节律紊乱后逐渐恶化[38]。人体研究[39-40]发现昼夜节律会影响更复杂的认知任务,且动物实验[41-42]发现,昼夜节律紊乱可导致小鼠海马神经元结构损伤和认知功能损害,这与本文研究结果一致。
3.2 MICT与HIIT改善昼夜节律紊乱对小鼠肠道菌群、代谢组学及认知功能的损害
肠道菌群处于动态平衡中,往往受遗传、环境、健康状况、饮食和运动等多种因素影响。运动对肠道菌群的影响逐渐成为研究的热点问题[43]。在Alpha多样性方面与大多数研究结果一致,运动组菌群Chao1指数与Shannon指数均显著高于非运动组[44-45]。但有研究[46-47]发现Alpha多样性没有发生显著变化,这可能与运动时间和运动强度有关。通过Beta多样性分析可以观察到,运动对昼夜节律紊乱造成的菌群差异有一定程度的回调作用。在属水平上,各组相对丰度排名前几位的菌群均为乳酸杆菌、颤螺菌属、普雷沃菌、阿克曼菌属,说明昼夜节律紊乱和运动不会对肠道菌群的主要优势菌结构有显著影响。DM组和DH组乳酸杆菌、颤螺菌属等相对丰度高于DC组,且DC组普雷沃菌相对丰度高于DM组和DH组。可见,通过运动干预可以提高有益菌的丰度,降低有害菌的丰度,改善小鼠肠道菌群紊乱状态。
肠道菌群本身就具有昼夜节律,有研究[20]发现肠道菌群在菌群结构和功能上也存在昼夜节律,超过15%的小鼠肠道细菌数量有周期性波动,以乳杆菌目为主,并且白天休息时乳杆菌菌群丰度高,夜间活动时厚壁菌和拟杆菌菌群丰度高,这些菌群主要参与能量代谢、DNA修复和细胞生长。
利用LC-MS非靶向代谢组学对肠道代谢物进行分析检测发现,丁酸(Butanoic acid)、肌酸(Creatine)和二十二碳五烯酸n-6(DPAn-6)等代谢物可以作为区分DM组与DC组的特征代谢物,花生四烯酸(Arachidonic acid)、胞嘧啶核苷(Cytidine)和尿嘧啶(Uracil)等代谢物可以作为区分DH组与DC组的特征代谢物。丁酸是主要的短链脂肪酸,短链脂肪酸作为肠道菌群发酵的终产物之一, 被人体消化道内黏膜所吸收,通过一系列相互作用可对机体能量稳态和内分泌进行调节[48]。丁酸还具有消除肠道炎症促进肠道微生态平衡等作用。研究[49]证实,运动也能够调节肠道菌群对这些短链脂肪酸的分泌,从而有效防治肠道炎症的发生。口服肌酸可改善健康个体的短期记忆和智力能力[50],这与本文研究结果一致——运动可以提升肌酸含量,促进认知功能的发展。但董玮仲等[51]发现,认知能力较差的无运动习惯组体内的肌酸含量更高,这可能是被试饮食习惯或其他影响因素导致的。本文发现,运动干预后与认知有关的代谢物的含量与DC组存在显著差异,说明代谢物差异可能是导致认知差异的重要因素之一。
对筛选出的差异代谢物进行通路分析,富集了最关键的2条代谢通路:蛋白质的消化吸收通路(Protein digestion and absorption)和ABC转运蛋白信号通路(ABC transporters)。蛋白质是人体细胞、组织的重要组成成分,参与体内重要的生命活动。ABC转运蛋白家族是最大的转运蛋白家族,主要生理作用是负责特定分子跨脂质膜的运输。动物研究[52]证实,花青素可能通过影响ABC转运蛋白和蛋白质消化吸收代谢途径来增强抗氧化和抗炎防御,维持海马的正常功能,从而减轻衰老大鼠的认知障碍。还有研究[53]发现,定位于脑内皮细胞表面的ABC转运蛋白可能参与了阿尔兹海默病的发病,始于记忆丧失,后发展成严重的认知障碍。综上,运动通过影响代谢物影响代谢通路,代谢通路与认知功能密切相关,据此猜测代谢物和代谢通路的变化可能是运动促进认知功能的重要影响因素。
运动对认知功能存在改善作用[54]。随着大健康教育观和全民健身观念的发展,人们的健身和锻炼意识空前高涨。近年来,间歇性和持续性运动哪种对缓解认知功能下降更有益成为研究的热点问题。为了比较MICT和HIIT在改善认知功能下降方面的优势,Baker等[55]通过12周的MICT和HIIT干预发现两者均能改善阿尔茨海默病小鼠的认知障碍。一项有关HIIT与认知功能的文献综述[56]指出,在57项认知功能指标中有35项(61%)显示HIIT对其有积极影响,可见运动在一定程度上可以改善认知功能。本文结果显示,DM组和DH组逃避潜伏期、游泳距离和初次抵达平台时间显著短于DC组,穿越平台次数和目标象限游泳时间百分比显著高于DC组,说明运动对昼夜节律紊乱导致的认知功能下降有改善作用。需要指出的是,运动影响昼夜节律紊乱小鼠认知功能改变的大脑神经机制并不明确,尚需进一步探讨。
3.3 昼夜节律紊乱小鼠肠道菌群及其代谢物与认知功能相关
肠道菌群通过肠-脑轴影响宿主神经系统活动,最终导致认知功能的变化[17]。特定的肠道微生物特征与认知障碍密切相关[57]。不同菌群对认知功能的影响不同,脱硫弧菌属的丰度被证实与认知功能相关,丰度越高认知功能水平越低下[58]。动物实验[59]证实,乳酸杆菌属缓解小鼠认知功能下降,抑制β淀粉样蛋白表达。还有研究[60]表明,补充龙葵多糖显著降低了副拟杆菌属的相对丰度,可能在认知功能中发挥调节作用。本文结果显示,脱硫弧菌属和瘤胃球菌属等菌群与学习能力呈显著负相关,副拟杆菌属与记忆能力呈显著负相关,证明脱硫弧菌属、瘤胃球菌属、副拟杆菌属与认知功能存在负相关关系。
肠道菌群代谢物被证实与认知功能有关。色氨酸与认知能力呈复杂的非线性关系[61]。胞嘧啶核苷参与认知功能的调节,动物实验[62]证实,口服鲑鱼粉水解提取物可增加海马中胞嘧啶和胞嘧啶的核苷浓度,增强小鼠的物体识别和物体位置。另有研究[63]表明,每天摄入油酸对日本老年人的认知能力下降存在有益影响。本文结果验证了肠道菌群代谢物与认知功能之间的关系:色氨酸、胞嘧啶核苷、油酸与认知功能呈显著正相关,脯氨酸与认知功能呈显著负相关。
对肠道菌群和肠道代谢物进行相关性分析发现,乳酸杆菌属与色氨酸呈显著正相关。利用乳酸杆菌对肝性脑病大鼠进行治疗可显著降低其色氨酸水平,恢复认知功能[36]。肠道微生物直接或间接地影响色氨酸代谢,从而导致行为和认知的相应变化[64]。补充β-葡聚糖还可促进肠道菌群组成的变化,从而改变肠道内容物中的代谢产物,通过脑-肠轴降低大脑皮层激活[65]。结合现有研究,色氨酸受到乳酸杆菌属等菌群的调控并对认知功能产生一定影响,这便于在肠道菌群-肠-脑轴视角下理解肠道菌群及其代谢物参与运动改善昼夜节律紊乱小鼠认知功能的调节。
4. 结论与展望
MICT和HIIT可缓解昼夜节律紊乱对结肠组织的损害,调节昼夜节律紊乱小鼠肠道菌群的结构和丰度,改善其认知功能。肠道菌群及肠道代谢物与认知功能密切相关,相关肠道菌群及其代谢物会参与运动改善昼夜节律紊乱小鼠认知功能的调节过程。
本文构建的昼夜节律紊乱小鼠模型不能完全模拟现代人的生活方式,且仅采用横断面设计探讨了不同运动方式对昼夜节律紊乱小鼠认知功能、肠道菌群和代谢组学的影响。未来可开展纵向研究,验证肠道菌群和代谢组学在运动改善昼夜节律紊乱小鼠认知功能中的中介作用,并深入探讨不同运动方式对肠道微生物-肠-脑轴的调节效应及其潜在的生物学机制。
作者贡献声明:丁博:提出论文选题,设计、执行实验,撰写、修改论文;作者贡献声明:张爱新:调研文献,执行实验,核实数据;作者贡献声明:韩雅洁:调研文献,执行实验;作者贡献声明:王茂叶:提出论文选题,审核、指导修改论文。 -
表 1 Morris水迷宫实验各指标比较
Table 1 Comparison of each index in Morris water maze experiment
组别 逃避潜伏期/s 游泳距离/cm 穿越平台次数/次 目标象限游泳时间百分比/% 初次抵达平台时间/s CC 22.26±2.73 504.67±67.25 4.75±0.96 36.54±4.84 21.29±2.61 DC 32.97±3.16** 620.79±83.46* 2.75±0.81** 24.39±3.24** 32.82±3.82** DM 24.93±2.92◆◆ 555.04±79.39◆ 4.25±0.58◆ 30.64±3.51◆ 24.41±2.86◆◆ DH 24.48±2.89◆◆ 548.19±75.83◆ 4.05±0.52◆ 29.75±3.87◆ 23.86±2.39◆◆ 注:与CC组相比,*表示P<0.05,**表示 P<0.01;与DC组相比,◆表示P<0.05,◆◆表示P<0.01。 表 2 肠道菌群Alpha多样性分析
Table 2 Alpha diversity analysis of gut microbiota
指数 CC组 DC组 DM组 DH组 Chao1 1499.91±20.78 997.48±151.94** 1217.42±218.97 1339.81±112.63◆ Observed species 1401.37±60.67 897.63±154.26** 1157.8±227.62 1188.37±133.57 Shannon 7.62±0.49 6.06±0.64** 7.54±0.34◆◆ 7.74±0.1◆◆ Simpson 0.96±0.03 0.86±0.05** 0.98±0.01◆◆ 0.98±0.01◆◆ Faith's PD 69.13±6 59.47±8.69 66.18±8.44 64.17±4.85 Pielou's evenness 0.73±0.04 0.62±0.05** 0.74±0.02◆◆ 0.76±0.02◆◆ 注:与CC组相比,*表示P<0.05,**表示P<0.01;与DC组相比,◆表示P<0.05,◆◆表示P<0.01。 表 3 各比较组组间显著差异代谢物
Table 3 Significantly different metabolites between groups in each comparison group
分组 名称 采集模式 VIP 差异倍数 P 趋势 DC vs CC 姜黄素(Curcumin) ESI+ 1.23 0.21 0.00391 ↓ 花生四烯酸(Arachidonic Acid) ESI− 3.53 0.23 0.00424 ↓ 去氧皮质酮乙酸酯(Deoxycorticosterone acetate) ESI+ 1.14 0.43 0.00425 ↓ 油酸(Oleic acid) ESI− 18.11 0.25 0.00611 ↓ 苯丙氨酸(Phenylalanine) ESI− 7.26 7.57 0.00622 ↑ 色氨酸(Tryptophan) ESI− 3.68 0.25 0.00759 ↓ 2'-脱氧肌苷(2'-deoxyinosine) ESI+ 1.59 6.73 0.00111 ↑ DM vs DC 丁酸(Butanoic acid) ESI− 6.53 3.15 0.00904 ↑ 肌酸(Creatine) ESI+ 7.12 2.66 0.00994 ↑ 甲硫氨酸(Methionine) ESI− 1.16 4.07 0.00115 ↑ 替米沙旦(Telmisartan) ESI− 2.67 0.10 0.00330 ↓ 二十二碳五烯酸n-6(DPAn-6) ESI− 1.71 0.39 0.00410 ↓ DH vs DC 花生四烯酸(Arachidonic acid) ESI− 3.53 2.03 0.00072 ↑ 胞嘧啶核苷(Cytidine) ESI+ 5.89 3.59 0.00681 ↑ 尿嘧啶(Uracil) ESI− 5.25 0.67 0.00111 ↓ -
[1] BHADRA U,THAKKAR N,DAS P,et al. Evolution of circadian rhythms:From bacteria to human[J]. Sleep Medicine,2017,35:49-61 doi: 10.1016/j.sleep.2017.04.008
[2] BARNER C,SCHMID S R,DIEKELMANN S. Time-of-day effects on prospective memory[J]. Behavioural Brain Research,2019,376:112179 doi: 10.1016/j.bbr.2019.112179
[3] NING S,JORFI M. Beyond the sleep-amyloid interactions in Alzheimer's disease pathogenesis[J]. Journal of Neurophysiology,2019,122(1):1-4 doi: 10.1152/jn.00118.2019
[4] XING F,FANG X,GONG X D,et al. Photoacoustic treatment mitigates cognitive dysfunction in a model of sleep-wake rhythm disturbance[J]. Neural Regeneration Research,2020,15(6):1094-1101 doi: 10.4103/1673-5374.270415
[5] RIJO-FERREIRA F,TAKAHASHI J S. Genomics of circadian rhythms in health and disease[J]. Genome Medicine,2019,11(1):1-16 doi: 10.1186/s13073-018-0611-9
[6] TEICHMAN E M,O'RIORDAN K J,GAHAN C G M,et al. When rhythms meet the blues:Circadian interactions with the microbiota-gut-brain axis[J]. Cell Metabolism,2020,31(3):448-471 doi: 10.1016/j.cmet.2020.02.008
[7] DUBOC H,COFFIN B,SIPROUDHIS L. Disruption of circadian rhythms and gut motility[J]. Journal of Clinical Gastroenterology,2020,54(5):405-414 doi: 10.1097/MCG.0000000000001333
[8] ZHANG L, YAN R N, WU Z F. Metagenomics analysis of intestinal flora modulatory effect of green tea polyphenols by a circadian rhythm dysfunction mouse model[J]. Journal of Food Biochemistry, 2020, 44(10): e13430
[9] 田麦久. 运动训练学[M]. 2版. 北京: 人民体育出版社, 2000 [10] FEITO Y,HEINRICH K M,BUTCHER S J,et al. High-intensity functional training (HIFT):Definition and research implications for improved fitness[J]. Sports,2018,6(3):76 doi: 10.3390/sports6030076
[11] 邓畅,陈丹凤,仇蓉蓉,等. 有氧运动训练对血管性痴呆大鼠肠道菌群结构的影响[J]. 中国康复医学杂志,2022,37(4):443-450 [12] ZHU Q W,JIANG S F,DU G K. Effects of exercise frequency on the gut microbiota in elderly individuals[J]. MicrobiologyOpen,2020,9(8):e1053 doi: 10.1002/mbo3.1053
[13] DUPUIT M,RANCE M,MOREL C,et al. Effect of concurrent training on body composition and gut microbiota in postmenopausal women with overweight or obesity[J]. Medicine and Science in Sports and Exercise,2022,54(3):517-529 doi: 10.1249/MSS.0000000000002809
[14] DOWD A J, KRONLUND L, PARMAR C, et al. A 12-week pilot exercise program for inactive adults with celiac disease: Study protocol[J]. Global Advances in Health and Medicine, 2019, 8: 2164956119853777
[15] LI Q,ZHANG L,ZHANG Z G,et al. A shorter-bout of HIIT is more effective to promote serum BDNF and VEGF-A levels and improve cognitive function in healthy young men[J]. Frontiers in Physiology,2022,13:898603 doi: 10.3389/fphys.2022.898603
[16] QUINTERO A P,BONILLA-VARGAS K J,CORREA-BAUTISTA J E,et al. Acute effect of three different exercise training modalities on executive function in overweight inactive men:A secondary analysis of the BrainFit study[J]. Physiology & Behavior,2018,197:22-28
[17] ZHANG Y T,CHENG L,LIU Y N,et al. Dietary flavonoids:A novel strategy for the amelioration of cognitive impairment through intestinal microbiota[J]. Journal of the Science of Food and Agriculture,2023,103(2):488-495 doi: 10.1002/jsfa.12151
[18] GHAISAS S,MAHER J,KANTHASAMY A. Gut microbiome in health and disease:Linking the microbiome–gut–brain axis and environmental factors in the pathogenesis of systemic and neurodegenerative diseases[J]. Pharmacology & Therapeutics,2016,158:52-62
[19] 刘薇薇,于洋,闻德亮. 慢性昼夜节律紊乱实验动物造模及其致病机制研究进展[J]. 实验动物科学,2022,39(4):59-63,68 [20] THAISS C,ZEEVI D,LEVY M,et al. TransKingdom control of microbiota diurnal oscillations promotes metabolic homeostasis[J]. Cell,2014,159(3):514-529 doi: 10.1016/j.cell.2014.09.048
[21] 赵国杰,卢悦,崔博,等. 昼夜节律紊乱对大鼠肠道菌群及肠道屏障的影响[J]. 现代预防医学,2022,49(8):1495-1500 [22] 宋霄鹏. 大黄素对骨关节炎治疗作用效果的观察[D]. 哈尔滨: 东北农业大学, 2018: 1 [23] 孟宪欣,管泽毅,葛吉生,等. 间歇运动干预自发性高血压大鼠病理性心脏肥大:运动强度与健康效应的关系[J]. 体育科学,2019,39(6):73-82 [24] HECK K L Jr,VAN BELLE G,SIMBERLOFF D. Explicit calculation of the rarefaction diversity measurement and the determination of sufficient sample size[J]. Ecology,1975,56(6):1459-1461 doi: 10.2307/1934716
[25] CHAO A. Nonparametric estimation of the number of classes in a population[J]. Scandinavian Journal of Statistics,1984,11:265-270
[26] SHANNON C E. A mathematical theory of communication[J]. The Bell System Technical Journal,1948,27(3):379-423 doi: 10.1002/j.1538-7305.1948.tb01338.x
[27] SIMPSON E H. Measurement of diversity[J]. Nature,1949,163(4148):688 doi: 10.1038/163688a0
[28] FAITH D P. Conservation evaluation and phylogenetic diversity[J]. Biological Conservation,1992,61(1):1-10 doi: 10.1016/0006-3207(92)91201-3
[29] PIELOU E C J. The measurement of diversity in different types of biological collections[J]. Journal of Theoretical Biology,1966,13(1):131-144
[30] MAGNE F,GOTTELAND M,GAUTHIER L,et al. The firmicutes/bacteroidetes ratio:A relevant marker of gut dysbiosis in obese patients?[J]. Nutrients,2020,12(5):1474 doi: 10.3390/nu12051474
[31] BISHEHSARI F,VOIGT R M,KESHAVARZIAN A. Circadian rhythms and the gut microbiota:From the metabolic syndrome to cancer[J]. Nature Reviews Endocrinology,2020,16(12):731-739 doi: 10.1038/s41574-020-00427-4
[32] LIU Y,JIN Y,LI J,et al. Small bowel transit and altered gut microbiota in patients with liver cirrhosis[J]. Frontiers in Physiology,2018,9:470 doi: 10.3389/fphys.2018.00470
[33] YU Z H,CAO M,PENG J S,et al. Lacticaseibacillus casei T1 attenuates Helicobacter pylori-induced inflammation and gut microbiota disorders in mice[J]. BMC Microbiology,2023,23(1):1-13 doi: 10.1186/s12866-023-02782-4
[34] PLISSONNEAU C,CAPEL F,CHASSAING B,et al. High-intensity interval training and α-linolenic acid supplementation improve DHA conversion and increase the abundance of gut mucosa-associated Oscillospira bacteria[J]. Nutrients,2021,13(3):788 doi: 10.3390/nu13030788
[35] TOKUDA H,KONTANI M,KAWASHIMA H,et al. Arachidonic acid-enriched triacylglycerol improves cognitive function in elderly with low serum levels of arachidonic acid[J]. Journal of Oleo Science,2014,63(3):219-227 doi: 10.5650/jos.ess13195
[36] RIEDEL W J, SOBCZAK S, SCHMITT J A J. Tryptophan modulation and cognition[M]//Advances in experimental medicine and biology. Boston, MA: Springer US, 2003: 207-213
[37] PÉREZ-CARBONELL L,IRANZO A. Sleep-related changes prior to cognitive dysfunction[J]. Current Neurology and Neuroscience Reports,2023,23(4):177-183 doi: 10.1007/s11910-023-01258-2
[38] LESO V,FONTANA L,CATURANO A,et al. Impact of shift work and long working hours on worker cognitive functions:Current evidence and future research needs[J]. International Journal of Environmental Research and Public Health,2021,18(12):6540 doi: 10.3390/ijerph18126540
[39] REID K J, MCGEE-KOCH L L, ZEE P C. Cognition in circadian rhythm sleep disorders[M]//Progress in Brain Research. Amsterdam: Elsevier, 2011, 190: 3-20
[40] YALÇIN M,MUNDORF A,THIEL F,et al. It's about time:The circadian network as time-keeper for cognitive functioning,locomotor activity and mental health[J]. Frontiers in Physiology,2022,13:873237 doi: 10.3389/fphys.2022.873237
[41] LI S B,LI S Z,LI Y H,et al. Influence of circadian disorder on structures and functions of neurons in hippocampus of mice[J]. Biological Rhythm Research,2017,48(4):639-645 doi: 10.1080/09291016.2017.1299368
[42] WU Y S,NIU X H,LI P F,et al. Lactobacillaceae improve cognitive dysfunction via regulating gut microbiota and suppressing Aβ deposits and neuroinflammation in APP/PS1 mice[J]. Archives of Microbiology,2023,205(4):1-15
[43] SUN Q Y,HO C T,ZHANG X,et al. Strategies for circadian rhythm disturbances and related psychiatric disorders:A new cue based on plant polysaccharides and intestinal microbiota[J]. Food & Function,2022,13(3):1048-1061
[44] KERN T,BLOND M B,HANSEN T H,et al. Structured exercise alters the gut microbiota in humans with overweight and obesity:A randomized controlled trial[J]. International Journal of Obesity,2020,44(1):125-135 doi: 10.1038/s41366-019-0440-y
[45] 田浩冬,黄丽,刘昊为,等. T2DM患者运动响应与肠道菌群代谢:关系探究与机制推断[J]. 上海体育学院学报,2023,47(4):24-38 [46] ZHONG F,WEN X,YANG M,et al. Effect of an 8-week exercise training on gut microbiota in physically inactive older women[J]. International Journal of Sports Medicine,2021,42(7):610-623 doi: 10.1055/a-1301-7011
[47] RETTEDAL E A,CREE J M E,ADAMS S E,et al. Short-term high-intensity interval training exercise does not affect gut bacterial community diversity or composition of lean and overweight men[J]. Experimental Physiology,2020,105(8):1268-1279 doi: 10.1113/EP088744
[48] KUWAHARA A. Contributions of colonic short-chain Fatty Acid receptors in energy homeostasis[J]. Frontiers in Endocrinology,2014,5:144
[49] ALLEN J M,MAILING L J,NIEMIRO G M,et al. Exercise alters gut microbiota composition and function in lean and obese humans[J]. Medicine & Science in Sports & Exercise,2018,50(4):747-757
[50] AVGERINOS K I,SPYROU N,BOUGIOUKAS K I,et al. Effects of creatine supplementation on cognitive function of healthy individuals:A systematic review of randomized controlled trials[J]. Experimental Gerontology,2018,108:166-173 doi: 10.1016/j.exger.2018.04.013
[51] 董玮仲,宋刚,罗炯,等. 尼古丁依赖男大学生运动习惯与认知功能的关联研究:基于肠道菌群和非靶向代谢的联合组学分析[J]. 体育科学,2022,42(6):67-79 [52] CHEN S S,HU N,WANG H L,et al. The major anthocyanin of Lycium ruthenicum Murr. Relieves cognitive deficits,oxidative stress,neuroinflammation,and hippocampal metabolome alterations in aging rats[J]. Journal of Functional Foods,2022,94:105104 doi: 10.1016/j.jff.2022.105104
[53] ABUZNAIT A H,KADDOUMI A. Role of ABC transporters in the pathogenesis of Alzheimer's disease[J]. ACS Chemical Neuroscience,2012,3(11):820-831 doi: 10.1021/cn300077c
[54] WON J,CALLOW D D,PENA G S,et al. Evidence for exercise-related plasticity in functional and structural neural network connectivity[J]. Neuroscience & Biobehavioral Reviews,2021,131:923-940
[55] BAKER L D,FRANK L L,FOSTER-SCHUBERT K,et al. Effects of aerobic exercise on mild cognitive impairment[J]. Archives of Neurology,2010,67(1):71-79
[56] AI J Y,CHEN F T,HSIEH S S,et al. The effect of acute high-intensity interval training on executive function:A systematic review[J]. International Journal of Environmental Research and Public Health,2021,18(7):3593 doi: 10.3390/ijerph18073593
[57] LIANG X X,FU Y Q,CAO W T,et al. Gut microbiome,cognitive function and brain structure:A multi-omics integration analysis[J]. Translational Neurodegeneration,2022,11(1):49 doi: 10.1186/s40035-022-00323-z
[58] ZHAO C C,MO L,LI J J,et al. Oxidized milk induces spatial learning and memory impairment by altering gut microbiota in offspring mice during pregnancy and lactation[J]. Journal of Agricultural and Food Chemistry,2021,69(34):9934-9946 doi: 10.1021/acs.jafc.1c02716
[59] LEE H J,HWANG Y H,KIM D H. Lactobacillus plantarum C29-fermented soybean (DW2009) alleviates memory impairment in 5XFAD transgenic mice by regulating microglia activation and gut microbiota composition[J]. Molecular Nutrition & Food Research,2021,65(12):e2170024
[60] FU L Y,ZHU W L,TIAN D M,et al. Dietary supplement of anoectochilus roxburghii (wall.) lindl. polysaccharides ameliorates cognitive dysfunction induced by high fat diet via "gut-brain" axis[J]. Drug Design,Development and Therapy,2022,16:1931-1945 doi: 10.2147/DDDT.S356934
[61] GAO Y C,SUN C,GAO T,et al. Taurine ameliorates volatile organic compounds-induced cognitive impairment in young rats via suppressing oxidative stress,regulating neurotransmitter and activating NMDA receptor[J]. Frontiers in Veterinary Science,2022,9:999040 doi: 10.3389/fvets.2022.999040
[62] NAKAMICHI N,NAKAO S,MASUO Y,et al. Hydrolyzed salmon milt extract enhances object recognition and location memory through an increase in hippocampal cytidine nucleoside levels in normal mice[J]. Journal of Medicinal Food,2019,22(4):408-415 doi: 10.1089/jmf.2018.4285
[63] SAKURAI K,SHEN C T,SHIRAISHI I,et al. Consumption of oleic acid on the preservation of cognitive functions in Japanese elderly individuals[J]. Nutrients,2021,13(2):284 doi: 10.3390/nu13020284
[64] ROTH W,ZADEH K,VEKARIYA R,et al. Tryptophan metabolism and gut-brain homeostasis[J]. International Journal of Molecular Sciences,2021,22(6):2973 doi: 10.3390/ijms22062973
[65] ZHANG Q W,ZHAO W,HOU Y,et al. β-Glucan attenuates cognitive impairment of APP/PS1 mice via regulating intestinal flora and its metabolites[J]. CNS Neuroscience & Therapeutics,2023,29:1690-1704




 下载:
下载: