Inducing a "Crosstalk" Between Organs (Tissues): A New Interpretive Framework for Exercise Health Promotion
-
摘要:
运动对健康的有益影响已得到循证医学的充分证明,运动健康促进至少部分归因于运动过程中器官(组织)释放到循环中的运动因子引起器官(组织)间的“对话”或“交互作用”。总结运动因子的分类、功能和作用机制,阐释由运动诱导释放的肌因子、脂因子、骨因子、肝因子与疾病发生发展之间的联系,认为运动诱导的肌因子、脂因子、骨因子、肝因子可通过“自对话”和器官(组织)与器官(组织)之间“对话”等形式对人体的形态、结构、功能和代谢产生广泛影响,参与个体的健康维护和全身多种疾病的发生发展过程,这种“对话”作用的效果取决于运动形式、运动强度、运动持续时间、运动频度等因素,这为理解运动健康促进机制提供了一个全新的视角。
Abstract:The beneficial effects of exercise on health are well documented by evidence-based medicine, and it has been suggested that the health promotion of exercise is at least in part attributable to the "crosstalk" or "interaction" between organs (tissues) caused by exerkines released into the circulation by organs (tissues) during exercise. The classification, function and mechanism of exerkines are summarized, and the relationship between the myokines, adipokines, osteokines and hepatokines released by exercise and the occurrence and development of diseases is explained. It is believed that exercise-induced myokines, adipokines, osteokines and hepatokines can have a wide range of effects on the shape, structure, function and metabolism of the human body through "self-crosstalk" and "crosstalk" between organs (tissues) and organs (tissues), and participate in the maintenance of individual health. The effect of this crosstalk depends on the form of exercise, exercise intensity, exercise duration, exercise frequency and other factors. The conclusions can provide a new perspective for the understanding of the mechanism of exercise health promotion.
-
Keywords:
- crosstalk /
- exerkines /
- myokines /
- adipokines /
- osteokines /
- hepatokines /
- extracellular vesicles /
- metabolic homeostasis
-
尽管近百年来运动裨益健康已得到累积证据的充分证明,但对其分子机制仍不十分清楚。为什么运动过程中局部肌肉收缩能够引起全身健康效应,骨骼肌如何与身体其他器官进行沟通和交流,身体所有的器官/组织/细胞如何对运动作出响应,组织细胞对运动的响应如何转化为健康益处,一直是学者们感兴趣的科学问题。传统观点认为,神经—内分泌—免疫网络在健身运动中的整合调控机制在维持机体代谢稳态方面起重要作用[1],但难以解释运动器官——骨和骨骼肌为什么能对全身各系统器官发挥调控作用,器官与器官之间如何产生相互影响。近20年来的研究表明,运动能够引起骨骼肌和身体其他器官分泌运动因子(exerkines),并通过特定的信号网络系统在全身器官或组织之间进行“对话”(crosstalk),进而产生健康效应。运动因子、器官(组织)“对话”概念的提出为理解运动健康促进机制提供了全新的视角。基于此,本文对运动因子的概念、类别、作用进行梳理、定义,并就器官(组织)“对话”的形式,以及运动因子如何从骨骼肌或其他器官(组织)中分泌、如何释放到循环并被携带到其他器官(组织)中、如何在其他器官(组织)中发挥调节作用等生理功能进行讨论,旨在为认识运动健康促进机制提供一个新的解释框架,为充实、完善运动健身理论提供参考。
1. 核心概念释义
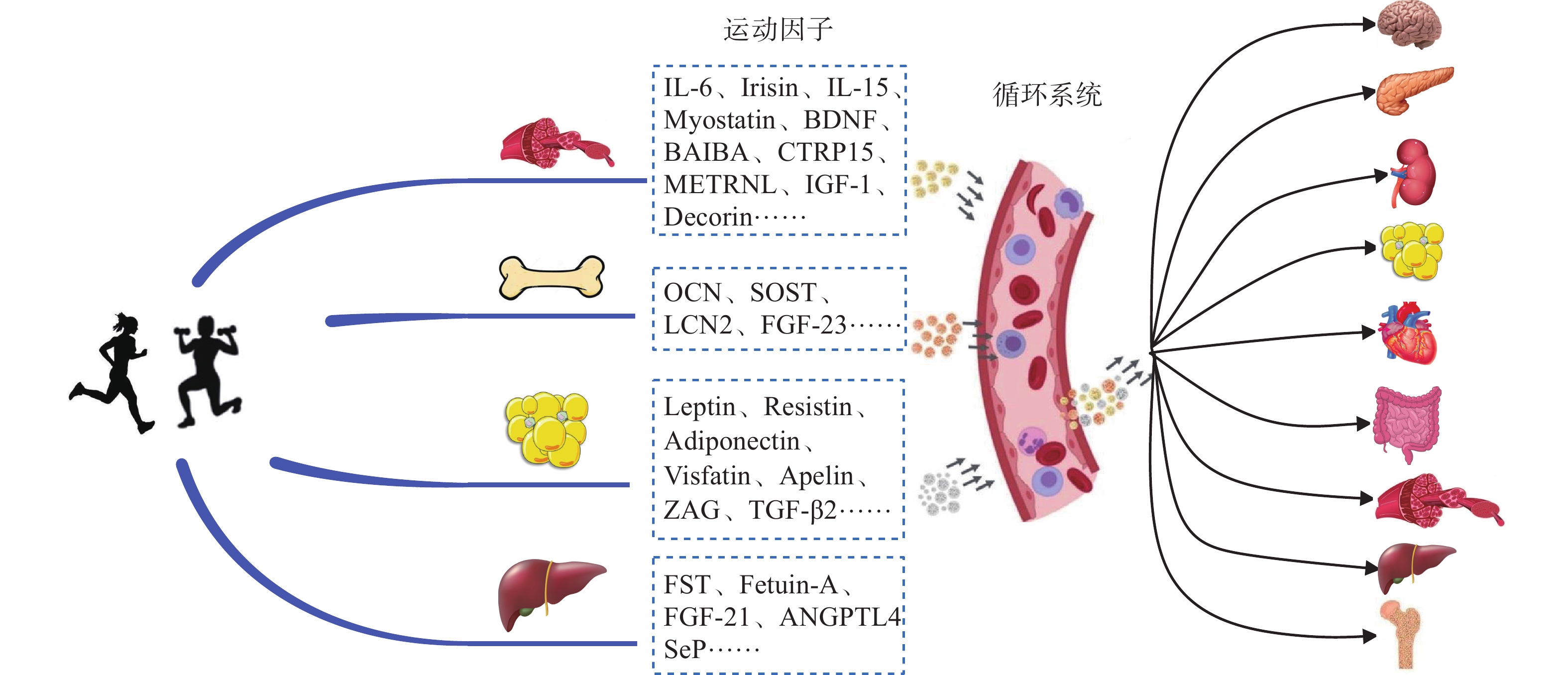
(1)运动因子。运动因子是Safdar等[2]在2016年引入运动生理学的一个概念,主要指任何因运动(或响应运动)而释放到循环中的生物活性物质[肽、核糖核酸(RNA)、微核糖核酸(miRNA)]。运动因子除可由骨骼肌分泌外,也可由其他器官或组织(如脂肪、骨、肝)分泌。运动因子可以自分泌信号机制作用于细胞自身,实现“自我对话”,也可与邻近(旁分泌信号)和远处(内分泌信号)器官(组织)的细胞交互作用。例如,运动引致骨骼肌分泌的 IL-6既可介导肌组织,增加肌肉中的葡萄糖摄取和脂肪酸氧化,也可作为内分泌因子作用于脂肪组织(Adipose Tissue),以增加脂肪组织的分解。目前对运动因子的定义比较混乱,张星等[3] 认为,作为运动因子必须同时具备3个条件:①运动时产生或运动促进释放的生物活性物质;②从组织细胞释放作用于邻近细胞或进入血液循环作用于其他器官或组织细胞;③可影响接受细胞的生长或功能活动,通常介导运动所引起的健康效应。此外,运动因子可以直接分泌到循环中,也可以通过外泌体等细胞外囊泡(Extracellular Vesicles,EVs)运输,其分子靶点和受体遍布全身,包括骨骼肌、脂肪组织、肝脏、胰腺、骨骼、心脏、免疫细胞和脑等[4]。
(2)细胞外囊泡和外泌体。细胞外囊泡是一种由细胞释放的各种囊泡结构的统称,包括凋亡小体、微囊泡和外泌体。外泌体是体积最小的细胞外囊泡,封装有核酸、肽、信使核糖核酸(mRNA)、miRNA和线粒体脱氧核糖核酸(mtDNA)[5],并能将运动因子携带至受体细胞,与受体细胞膜蛋白和受体相互作用[4],诱导其他细胞发生生物反应和多种生理适应过程[6]。研究[7]发现,在运动过程中,循环中细胞外囊泡数量可增加2~4倍,并在运动后4 h恢复到运动前的水平。
(3)对话。对话的字面意思是指2个或2个以上的人之间的谈话、交流和沟通。人体细胞之间的信息既可通过相邻细胞的直接接触来实现,也可通过细胞分泌各种化学物质对其他器官进行调节,而这一切是通过信息(信号)转导通路实现的。对哺乳动物(包括人类)而言,信息(信号)转导通路通常由分泌释放信息物质的特定细胞、信息物质(包括细胞间与细胞内的信息物质和运载体、运输路径等)以及靶细胞(包括特异受体)等构成。目前已知运动诱导的肌因子(myokines)、脂因子(adipokines)、骨因子(osteokines)、肝因子(hepatokines)均可作为信号分子与其他器官(组织)进行交流,并通过与体内受体(包括骨骼肌、脂肪组织、骨骼、肝脏、肾脏、脑和胰腺等)结合发挥全身生物学效应[7],进而对代谢稳态和疾病进展产生积极或消极影响,这种过程被称为“对话”。事实上,身体活动时骨骼肌收缩释放的肌因子会引起全身几乎所有组织的变化,其他器官释放的细胞因子也会作用于骨骼肌,以维持全身稳态。如此复杂的过程在很大程度上依赖于器官(组织)间的“对话”,这种机制为理解运动健康促进原理建立了新的框架。
2. 运动因子分类
2.1 按结构分类
(1)肽。肽由一个氨基酸分子中的氨基与另一个氨基酸分子中的羧基缩合形成,相对分子质量在50~5000。运动诱导的属于肽类的运动因子包括IL-6、IL-8、IL-15、脑源性神经营养因子(BDNF)、白血病抑制因子(LIF)、成纤维细胞生长因子21(FGF-21)、卵泡抑素样1(FSTL1)、肌联蛋白15(CTRP15)、血管内皮生长因子A(VEGF-A)、鸢尾素(Irisin)等[8]。其功能将在2.2详述。
(2)miRNA。miRNA是近年来发现的单链、内源性、非编码分子,在各种生理情况下具有调节转录后基因表达的作用。研究[9]表明,单个miRNA可以靶向数百个基因,又可以被多个miRNA靶向,从而使其调控潜力具有巨大的复杂性和灵活性。miRNA参与生命中的一系列重要过程,包括早期胚胎发育、细胞死亡和增殖、细胞凋亡、细胞分化和肿瘤发展[6]。其中,运动诱导的miR-29a、miR-29c、miR-1、miR-214和miR-26a具有心脏保护作用[10],miR-378、miR-132、miR-184、miR-338-3p与增强胰腺β细胞功能相关[11]。
(3)代谢物。在运动科学研究中,对动物和人类血液的分析揭示了代谢物各种子集的变化,包括乳酸、支链氨基酸的副产物、三羧酸循环中间体、葡萄糖-6-磷酸、琥珀酸、苹果酸、富马酸、甘油和泛酸[2, 12]。尽管部分报告描述了耐力运动对全身循环代谢物变化的影响,但只有少数研究认识到这些代谢物具有激素样功能的信号调节作用[13]。
2.2 按来源分类
(1)肌因子。肌因子又称肌肉因子、肌细胞因子、肌动蛋白或肌动因子,指骨骼肌响应运动由肌纤维产生、表达和释放并发挥自分泌、旁分泌或内分泌作用的细胞因子和其他肽[5]。迄今为止,虽然使用靶向和探索性蛋白质组学方法鉴定出的细胞因子已达 600 多种,但其中绝大多数仍未得到充分表征。Murphy等[14]提出,作为肌因子必须满足以下条件:①来自骨骼肌细胞;②通过经典途径或细胞外囊泡分泌;③以内分泌和/或旁分泌方式诱导生物学功能。目前定义比较明确、与运动有明确循证关系的肌因子如表1所示。
表 1 运动诱导的肌因子及其功能Table 1. Exercise-induced myokines and their functions肌因子 主要功能 “对话”的器官或组织 运动类型 IL-6* 诱导肌肉肥大、葡萄糖摄取、糖原分解和脂肪分解;增加脂肪细胞中的脂肪分解和 FFA 氧化,诱导脂肪细胞褐变 肝、脂肪组织、胰腺、骨骼 耐力运动、抗阻运动 Irisin 刺激葡萄糖摄取和脂质代谢,诱导肌肉肥大;增强成骨细胞分化,诱导脂肪细胞褐变和脂肪分解,刺激糖异生并减少肝脏中的糖异生 脑、骨骼、心脏、血管组织、肾脏 抗阻运动 肌肉生长抑制素(Myostatin)* 促进肌肉蛋白降解,诱导肌肉结构基因和生肌因子下调,减轻肥胖和胰岛素抵抗,诱导能量消耗和脂肪细胞褐变 脂肪组织、肝脏、骨骼、肌肉组织 耐力运动、抗阻运动 IL-15 诱导肌肉肥大和葡萄糖摄取;增强脂肪细胞中的 FFA 氧化和脂肪分解;增强线粒体活性;有助于骨骼形成 脂肪组织、骨骼 抗阻运动、耐力运动 BDNF 增强 FFA 氧化和葡萄糖摄取;诱导脂肪细胞褐变;提高学习记忆力,调节骨骼肌代谢 脑、脂肪组织 抗阻运动、有氧运动 β-氨基异丁酸(BAIBA) 增加线粒体功能,增强抗炎作用,减少脂肪堆积,改善葡萄糖/脂质代谢紊乱,诱导脂肪细胞褐变,保持骨细胞活力 脂肪组织、肝脏、脑 耐力运动 CTRP15 靶向脂肪组织,增强葡萄糖摄取并刺激脂肪酸氧化 心脏、肝脏、脂肪组织 耐力运动 镍纹样蛋白(METRNL) 刺激能量消耗,增强葡萄糖耐量,增加米色脂肪细胞产热,提升抗炎细胞因子水平 脂肪组织 抗阻运动 核心蛋白聚糖(Decorin) 抑制血管生成和肿瘤发生,参与骨骼肌肥大 骨骼肌、骨骼 耐力运动 胰岛素样生长因子1(IGF-1) 促进骨骼发育和肌肉生长,增强神经精神功能 骨骼肌、骨骼、脑 急性运动、有氧运动 注:*表示除由骨骼肌分泌外,也可由脂肪组织分泌,又称为“脂肪肌因子”。 (2)脂因子。脂因子指由脂肪细胞响应运动分泌的细胞因子,在脂质积累、脂肪代谢、能量稳态以及炎症和胰岛素敏感性方面发挥调节作用(表2)。
表 2 运动诱导的脂因子及其功能Table 2. Exercise-induced adipokines and their functions脂因子 主要功能 “对话”的器官或组织 运动类型 瘦素(Ieptin) 参与调节进食行为和能量平衡,刺激脂肪酸氧化,调节脂肪细胞的大小和体积,参与白色脂肪组织(WAT)褐变 脑、骨骼肌 有氧运动、耐力运动 抵抗素(Resistin) 促进氧化应激,改变胰岛素受体底物1和Akt1功能,减少基础和胰岛素刺激的葡萄糖摄取、氧化和糖原合成 血管组织、胰腺 抗阻运动 脂联素(Adiponectin) 防止胰岛素抵抗,调节免疫反应,调节巨噬细胞增殖和极化 免疫器官、肝、胰腺、骨骼肌 抗阻运动、耐力运动 内脂素(Visfatin) 胰岛素模拟物,促炎/免疫调节 骨、骨骼肌 耐力运动 爱帕琳(Apelin) 控制血压和心脏收缩力,减轻心脏肥大,增加葡萄糖摄取,增强认知功能,防治肌减少症 骨骼肌、心、胰腺 耐力运动、抗阻运动 锌-α2-糖蛋白(ZAG) 刺激脂肪组织分解并抑制脂肪生成,参与WAT褐变 皮下脂肪 有氧运动、耐力运动 转化生长因子-β2(TGF-β2) 调节葡萄糖和脂肪酸代谢,增加脂肪酸摄取和氧化,并刺激骨骼肌、心脏和棕色脂肪组织(BAT)的葡萄糖摄取 骨骼肌、心、肾 耐力运动 (3)骨因子。骨因子是骨细胞响应运动分泌的激素样活性物质,在能量代谢、减少炎症因子、维持骨量和肌肉质量方面发挥调节作用(表3)。
表 3 运动诱导的骨因子及其功能Table 3. Exercise-induced osteokines and their functions骨因子 主要功能 “对话”的器官或组织 运动类型 骨钙素(OCN) 促进糖原分解,增加脂肪酸的吸收和分解,改善胰岛素敏感性,减少脂肪积累,增加能量消耗 骨骼肌、脂肪组织、肝脏、胰腺 急性运动 硬化蛋白(SOST) 抑制Wnt/β-连环蛋白信号通路,在胰岛素抵抗、炎症因子减少和代谢紊乱中发挥核心作用,防止骨量和肌肉丢失 骨骼肌 抗阻运动 运载蛋白2(LCN2) 促进胰岛素分泌,调节食欲和葡萄糖代谢 胰腺、脑 耐力运动 成纤维细胞生长因子23(FGF-23) 通过下调1α-羟化酶调节肾中的磷酸盐排泄和肠道磷酸盐的吸收,参与炎症、红细胞生成,与肿瘤诱导的骨软化和骨质疏松症有关 骨骼肌、肾脏 急性运动、慢性运动 (4)肝因子。肝因子是肝脏响应运动释放的激素样细胞因子,在减少炎症因子、胰岛素抵抗、能量稳态和代谢性疾病中发挥调节作用(表4)。
表 4 运动诱导的肝因子及其功能Table 4. Exercise-induced hepatokines and functions肝因子 主要功能 “对话”的器官或组织 运动类型 卵泡抑素(Follistatin,FST) 刺激葡萄糖摄取,促进内皮细胞功能,刺激血运重建,增强β细胞功能,增加心肌细胞数量和血管生成 心脏、胰腺、骨骼肌 力量训练、耐力运动 硒蛋白P(SeP) 解毒、抗炎、抗氧化,对神经细胞有保护作用,减少肥胖 肾脏、脑、脂肪组织 抗阻运动 胎球蛋白甲A(Fetuin-A) 诱导胰岛素抵抗,抑制脂肪细胞产生脂联素,诱导胰腺β细胞毒性,促进炎性因子活化,结合游离脂肪酸 脂肪组织、胰腺 有氧运动 FGF-21 与能量稳态、葡萄糖和脂质代谢以及胰岛素敏感性调节密切相关,可降低葡萄糖和甘油三酯水平,增强胰岛素敏感性和脂肪分解反应 脂肪组织、骨骼肌 有氧运动、耐力运动 血管生成素样蛋白4(ANGPTL4) 诱导甘油三酯脂肪酶刺激脂肪分解,抑制胰脂肪酶,减少膳食脂肪的吸收,抑制内脏脂肪组织中的脂质积累 脂肪组织、骨骼肌 有氧运动、抗阻运动 3. 器官(组织)间“对话”
运动/身体活动作为一种强大的生理刺激,可以引起身体多个器官释放运动因子,以旁分泌和内分泌形式对靶器官产生影响(图1)。例如,在中枢神经系统内可促进神经再生、增强突触可塑性、重塑树突形态和增强认知功能[15],在代谢系统中可改善全身糖脂代谢和外周胰岛素敏感性[16]等。
3.1 骨骼肌—器官(组织)“对话”
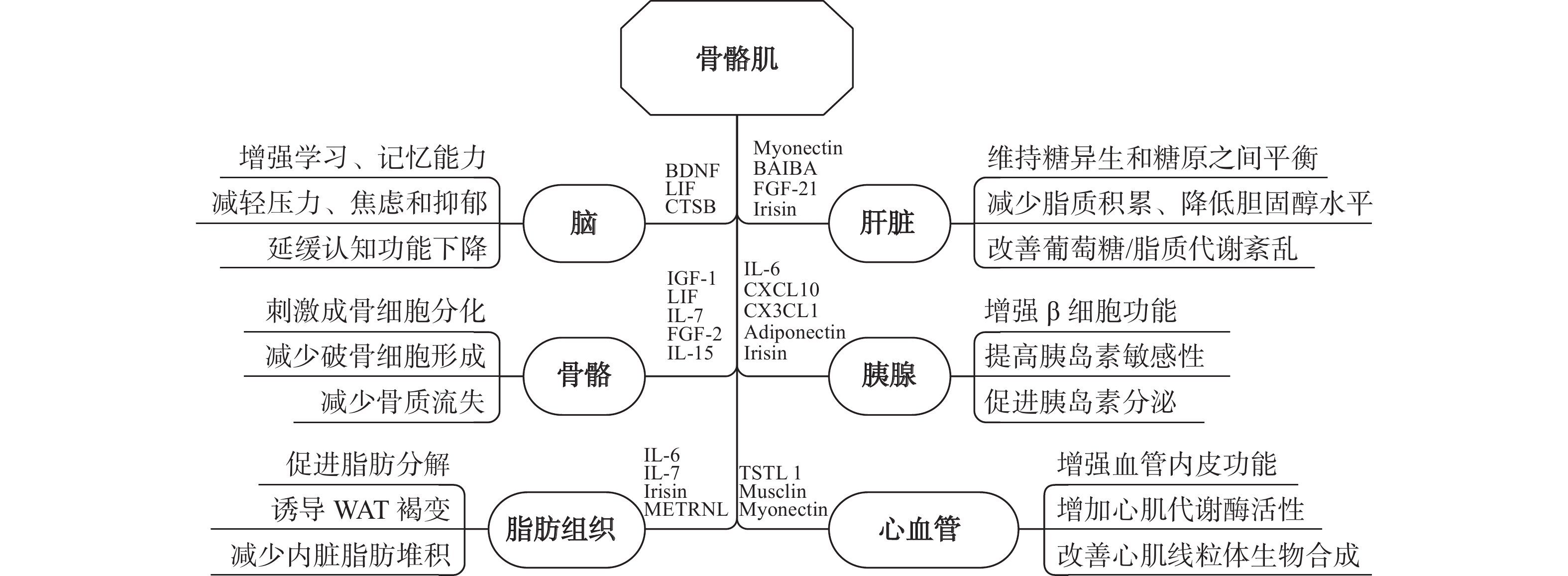
运动诱导的肌因子可以作为信使通过不同的信号转导途径与身体多个器官或组织进行“对话”(图2),对机体的代谢稳态和疾病发生发展产生积极影响,包括减少肥胖、增强心肺功能、增加脑血流量、调节全身葡萄糖稳态和脂质代谢、提高胰岛素敏感性、诱导WAT褐变、改善脑功能、刺激成骨细胞分化、防止氧化应激以及控制血压和增强心脏收缩力等。
3.1.1 骨骼肌—骨骼肌“自对话”
人在40岁左右会出现持续的肌肉萎缩,导致肌肉质量和力量发生退行性变化。此外,废用/失重(如石膏固定、住院/卧床休息、太空飞行)或创伤(如脊髓损伤)、疾病(如神经退行性变性和肌萎缩侧索硬化症)会加速肌肉的丢失。经常参加体育锻炼可促进肌纤维变粗、肌肉发达、力量增加,而这一切与运动过程中骨骼肌分泌的肌因子对自身的作用有关。在运动过程中,骨骼肌收缩会以自分泌方式释放肌因子,并参与肌肉质量的调节[5]。其中:肌肉素(Musclin)、LIF、IL-4、IL-6、IL-7和IL-15可直接参与控制肌肉质量、肌肉增殖和修复过程;IL-6可通过调节卫星细胞诱导骨骼肌肥大;IL-1可通过AMPK(AMP活化蛋白激酶)和Akt途径减少肥胖和增加瘦体质量。最近的研究综述[17]表明,在运动过程中,IL-6、IL-10、IL-15会以肌因子的形式分泌,通过PI3K/Akt和JAK/STAT通路,在减少炎症因子、增加肌肉肥大和促进蛋白质合成方面发挥作用。LIF作为一种多效性细胞因子,具有增加成肌细胞存活率的作用,对肌生成有积极影响。另外,有研究[18]发现,间歇运动可增加肌肉中LIF/LIFR的表达,并刺激STAT3信号以逆转小鼠的肌肉萎缩。Myostatin作为一种肌因子,具有抑制骨骼肌生长的作用[19],并与骨骼肌质量成反比[20]。阻力和耐力训练可降低老年男性的Myostatin,进而逆转或延缓老年性肌肉丢失[21]。
3.1.2 骨骼肌—脂肪组织“对话”
研究[5]表明,肌因子可通过内分泌的方式靶向人体的脂肪组织,参与与运动相关的脂质代谢调节,具有促进脂肪分解、诱导WAT褐变、减少内脏脂肪组织质量的功能。缺乏身体活动会导致内脏脂肪组织质量增加,而运动锻炼/训练会减少内脏脂肪组织的体积和质量。研究[5]表明:运动诱导的IL-6 可以通过AMPK激活机制增强脂肪分解和脂肪氧化,刺激脂肪组织的脂肪分解和脂质动员,为肌肉收缩提供能量并节省葡萄糖[22];Irisin可刺激解耦联蛋白1(UCP1)表达,促进WAT褐变[23]; METRNL能够刺激与米色脂肪细胞产热相关的基因表达[24],并进一步刺激能量消耗,改善葡萄糖耐量[25]。此外,运动过程中还有一些其他肌因子也参与了WAT褐变,如BAIBA、Follistatin、FGF-21等[26]。运动还可以间接调节Leptin和Adiponectin水平,进而影响脂肪组织代谢[27]。
3.1.3 骨骼肌—骨骼“对话”
骨骼肌与骨骼在发生学上密切相关,在解剖生理学上相互联系、相互影响,对人体的运动和新陈代谢起着至关重要的作用。既往研究[28]显示,肌肉和骨骼之间的耦合通过机械转导完成,机械转导要求施加到肌肉的机械力传递到骨以启动骨形成。近年来研究[28]表明,骨骼肌与骨骼之间也可通过肌因子、骨因子进行“对话”。其中运动诱导的肌因子IL-6、Irisin、Myostatin和FGF-21对骨骼的合成/分解代谢具有不可替代的作用[28]。因此,肌肉废用和/或肌肉萎缩导致的骨质疏松症也可通过运动时骨骼肌衍生的肌肉因子来调节[5]。同时,骨因子OCN和SOST已被证明分别诱导肌肉合成代谢和分解代谢[29]。
运动诱导的肌因子多以旁分泌方式对骨骼产生靶向作用[30]。对动物和人体的研究证实:肌因子IL-6可刺激成骨细胞分化,激活骨骼系统中多种信号级联反应,并在病理状态和炎症条件下维持骨骼的正常生长[31];BAIBA作为一种骨保护因子,可防止活性氧诱导的骨细胞死亡和骨质流失[32]。运动诱导的Myostatin表达下调可减少破骨细胞形成和骨质破坏,促进骨骼修复和愈合[33]。Irisin可以促进SOST的生成[34],对保持皮质和小梁骨矿物质密度、防止小梁骨体积分数急剧下降、防止后肢悬吊小鼠肌肉质量下降和保持纤维横截面积具有有益作用[35]。肌肉来源的IGF-1可以作用于表达IGF-1受体局部的成骨细胞,从而促进骨形成[36];睫状神经营养因子(CNTF)以性别特异性方式抑制成骨细胞分化和骨质形成[37]。此外,包括IL-6、IL-7和MCP-1在内的其他肌因子也可以各种方式影响骨代谢[38]。
3.1.4 骨骼肌—肝脏“对话”
来自肝脏的循环葡萄糖和从脂肪组织释放的游离脂肪酸(FFA)被认为是骨骼肌的主要燃料[5]。因此,骨骼肌—肝脏“对话”可能在调节全身代谢稳态方面发挥作用。有报道[5]称,IL-6在运动期间会增加肝脏葡萄糖的产生和输出。Irisin被认为是影响肝脏代谢最重要的肌因子之一,可通过抑制肝细胞中的甾醇调节结合蛋白2(SREBP2)以减少脂质积累和降低胆固醇水平,进而抑制脂肪生成[38];也可通过维持糖异生和糖原之间的平衡,在控制葡萄糖稳态方面发挥作用[39];还可通过PI3K-Akt-Foxo1途径减少糖异生,通过 PI3K-Akt-糖原合酶激酶(GSK3)途径增加糖生成,增强葡萄糖稳态,进而提高胰岛素敏感性[39]。CTRP15可通过控制细胞自噬发挥维持能量稳态的生理功能,还可通过上调脂肪酸转运蛋白基因表达增加肝脏脂肪酸摄取,改善全身脂质代谢[40]。FGF-21能通过抑制糖尿病动物肝脏中的糖异生,刺激葡萄糖吸收并减少葡萄糖释放[41]。BAIBA可通过激活过氧化物酶增殖物激活受体α(PPAR-α)减少肝脏脂肪生成,通过AMPK 途径减弱肝内质网应激和细胞凋亡,从而改善2型糖尿病(T2DM)小鼠的葡萄糖/脂质代谢紊乱[42]。这些发现表明,肌因子主要通过肝细胞中的不同途径调节葡萄糖吸收、糖异生、糖生成、胆固醇合成、脂质摄取和脂肪生成,在调节肝脏葡萄糖和脂质代谢中发挥重要作用。
3.1.5 骨骼肌—脑“对话”
脑在全身传入信号(神经递质、激素、营养素以及运动背景下的肌肉信号)的整合中起着核心作用,并能将下游传出信息发送到外周代谢器官。研究[43]发现,肌因子中的组织蛋白酶B(CTSB)、Irisin、BDNF和FGF-21等在骨骼肌—脑“对话”中具有重要作用,可能是运动引发的神经保护作用、增强神经可塑性、改善情绪和认知的关键介质。
越来越多的证据表明,运动释放的肌因子(CTSB、Irisin、IL-6)可以调控大脑认知功能(包括学习、记忆和情绪),对减轻压力、焦虑和抑郁也有积极影响[44]。从病理生理学上看,运动可影响齿状回的神经发生,增加突触可塑性[45],可在增强脑组织抗氧化能力、改变神经营养因子状态、减少氧化应激方面发挥积极作用[46],而这一切都可能与运动诱发的肌因子在骨骼肌和大脑之间的直接“对话”有关。其中:运动诱导的IL-6增加可能会抑制食欲,进而改善葡萄糖稳态;CTSB可穿过血脑屏障(BBB)进入脑中,刺激BDNF产生,并具有调节神经发生、改善记忆、学习、情绪等认知功能的作用[47]。运动可诱导骨骼肌中的 PGC1 α上调,增强神经元Ⅲ型纤连蛋白域蛋白5(FNDC5)的表达,刺激海马中BDNF的生成,改善学习、记忆[47]。Irisin可刺激神经元增殖和分化,通过激活Akt和ERK1/2信号通路对脑神经起保护作用[48];LIF可影响大脑疾病和损伤中的中枢神经系统发育和功能[49]。VEGF具有促进脑血管生成、增加齿状回的微血管密度、增加脑血流量以及增强向大脑输送富氧血液的作用 [50]。
3.1.6 骨骼肌—胰腺“对话”
现有证据表明,骨骼肌诱导的肌因子在胰岛素刺激的葡萄糖代谢中发挥关键作用[51],其机制可能与运动诱导的肌因子参与了β细胞的运动适应过程有关。研究[5]表明,IL-6是在运动环境中产生的最具特征的肌因子之一,它能与胰岛β细胞进行“对话”,增强原代胰岛β细胞增殖和葡萄糖介导的胰岛素分泌。早在2011年,Ellingsgaard等[52]观察到肌肉收缩释放的IL-6可诱导肠L细胞和胰腺α细胞分泌胰高血糖素样肽1(GLP-1),从而促进胰岛素分泌。近年来研究[53]发现,Apelin作为一种肌因子,不仅可以提高胰岛素敏感性和葡萄糖处理能力,也可以促进T2DM大鼠内源性胰腺β细胞增殖,还可以通过减少中性粒细胞募集和胰腺星状细胞活性减少炎症和纤维化。运动诱导的趋化因子C-X3-C基序趋化因子配体1(CX3CL1)对培养β细胞中葡萄糖刺激的胰岛素分泌有正向调节作用[54]。此外,过氧化物酶体增殖物激活受体γ共激活因子1-α(PGC1α),Irisin可以增强人和大鼠胰腺β细胞中的胰岛素生物合成和葡萄糖刺激的胰岛素分泌[55];运动诱导的肌因子FST可在T2DM模型的胰腺中高度表达,并可通过中和激活素(Activin)和Myostatin刺激胰岛增殖、维持胰岛质量,以保护胰腺β细胞的功能[56]。
3.1.7 骨骼肌—心血管“对话”
研究[57]发现,肌肉质量和功能与心血管疾病风险有关。体育锻炼/运动可通过肌肉释放肌因子增强血管内皮功能,改善线粒体生物合成,并增加骨骼肌和心肌中代谢酶活性等以改善心血管健康,降低心血管疾病风险。研究表明:运动诱导的肌因子Dermcidin可通过控制心肌细胞凋亡调节心肌细胞的存活和功能[58];FSTL1可通过减弱心内膜形成,促进内皮细胞功能并刺激血运重建;CTRP15负责保护心脏免受缺血再灌注损伤;Apelin可以同时支持心脏功能并防止心肌肥大向心力衰竭转变[59]。此外,运动诱导的肌因子还具有调节全身毛细血管的功能。例如,ANGPTL4具有调节血管生成和血管通透性的作用[60],FSTL1会对血管修复过程产生有益影响[61]。运动能上调miR-342-5p、miR-119的循环水平,这有助于其对心肌缺血/再灌注损伤的心脏保护作用[4] 。来自啮齿动物的数据表明,运动也能对脂肪组织中的内皮功能和血管生物学指标产生积极影响[62]。
3.1.8 骨骼肌—皮肤“对话”
Crane等[63]研究发现:耐力运动可以改善小鼠和人类与年龄相关的皮肤变化;运动可通过骨骼肌AMPK途径调节肌肉IL-15的表达;肌肉AMPK的降低可导致皮肤结构发生变化,而IL-15注射模拟了运动对小鼠皮肤的一些抗衰老作用。该研究支持运动通过涉及肌肉IL-15的机制延缓皮肤衰老的观点。
3.2 脂肪组织—器官(组织)“对话”
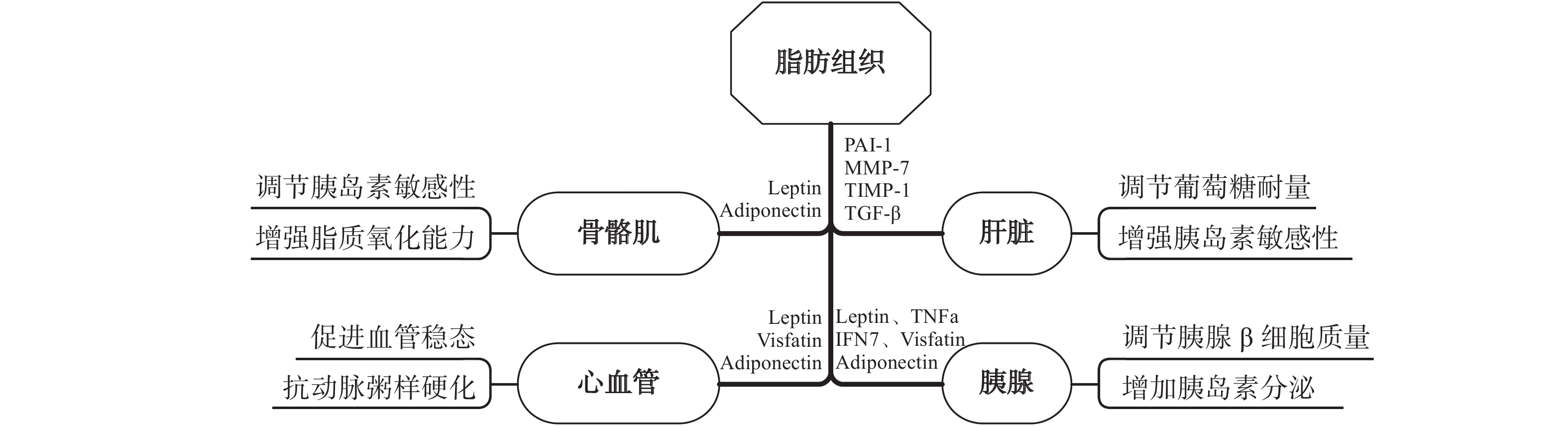
在过去20年里,人们对脂肪组织的理解发生了根本性变化。脂肪组织已经从能量储存组织(主要储存甘油三酯)演变为活跃的内分泌组织。研究表明,脂肪组织作为一种高度活跃的内分泌组织能响应运动/身体活动产生和分泌多种脂肪因子(如Adiponectin、Visfatin、Leptin、MCP-1、TNF-α、IL-6、IL-1β、IL-10、TGF-β等),并以旁分泌/内分泌的方式将信息传递到身体的其他器官[64],通过改变脂肪因子谱,调节脂肪组织稳态,干扰肝脏的正常信号通路对周围组织和远距离器官进行调节,对改善身体的能量和代谢稳态至关重要[65]。见图3。
3.2.1 脂肪组织—脂肪组织“自对话”
脂肪组织由不同的细胞类型组成。除了成熟的脂肪细胞外,脂肪组织中还存在其他细胞类型,如前脂肪细胞、内皮细胞、肥大细胞、成纤维细胞和巨噬细胞等。其分泌的脂因子不仅可通过旁分泌和内分泌的形式影响身体其他器官(组织),也可通过自分泌的形式对脂肪组织自身产生影响。
众所周知,巨噬细胞分泌的细胞因子(如TNF-α)会影响脂肪细胞的代谢和分泌功能,且这种“对话”和“沟通”是双向的,因为脂肪细胞衍生因子(如Leptin)也可调节脂肪组织中的免疫细胞功能。研究[66]表明,脂肪生成中的关键转录因子是PPAR-c和CCAAT增强子结合蛋白(C/EBPs)。肥胖发生中促炎性脂因子的分泌不仅会损害其他器官,还会损害脂肪组织内的脂肪生成。从巨噬细胞和脂肪细胞释放的细胞因子(如TNF-α和IL-6)已被证明可抑制脂肪细胞分化。
运动诱导的脂因子变化在多种生物过程中具有重要作用,包括但不限于食欲和饱腹感、胰岛素作用、脂质代谢、血压、凝血和繁殖[64]。高脂肪饮食和久坐生活方式可改变脂肪组织形态(即脂肪细胞肥大和增生),进而导致脂肪组织低灌注、炎症细胞浸润和炎症脂肪因子异常分泌。运动可激活中枢神经系统并刺激肌因子释放,影响脂肪组织的质量、功能和代谢表型[67]。
此外,在哺乳动物中,脂肪组织主要以2种形式存在:WAT和BAT。WAT的主要功能是储存和释放能量,而BAT的主要功能是产生热量以维持核心体温。在BAT中,热量产生是UCP1介导ATP合成解偶联发生的[68]。运动会增加能量消耗和热量产生,进而下调BAT活性和WAT褐变,而这一切与运动诱导的调节BAT活性和/或WAT褐变的脂因子有关。研究[63]表明,12周的力量和耐力运动干预可增加正常体质量参与者和糖尿病前期患者皮下WAT中UCP1的mRNA表达。
3.2.2 脂肪组织—骨骼肌“对话”
作为胰岛素刺激葡萄糖处理的主要目标,骨骼肌在胰岛素敏感性中起关键作用。脂肪组织质量增加与胰岛素抵抗密切相关。在代谢疾病中,骨骼肌胰岛素抵抗是脂肪组织功能障碍导致的促炎性脂肪因子、细胞因子和趋化因子以及FFA释放增加所致[66]。此外,脂肪细胞衍生的miR-27a可以通过PPAR-γ抑制诱导骨骼肌中的胰岛素抵抗,表明脂肪组织来源的miR-27a可能在肥胖引发的骨骼肌胰岛素抵抗发展中起关键作用[69]。
研究[70]发现,来自脂肪组织的一些miRNA可以调节骨骼肌细胞中的脂质代谢和胰岛素信号传导。肥胖小鼠表现出高水平的miR-130与BMI相关。这种miRNA调节骨骼肌中的脂质代谢,抑制PGC1α的表达,从而促进线粒体脂肪酸氧化和葡萄糖转运蛋白4(GLUT-4)表达,并增加胰岛素刺激的葡萄糖转运[71]。外泌体中的miR-227a和miR-27a能够通过下调PPAR-γ信号传导、改变骨骼肌细胞和脂肪细胞中的 PI3K/Akt活化来降低GLUT-4表达,从而导致胰岛素抵抗[72]。此外,miR-27a已被描述为可介导巨噬细胞浸润和核因子kappa B(NF-κB)的激活,诱导骨骼肌细胞炎症,最终通过改变胰岛素受体底物1抗体(IRS1)和GLUT-4表达来影响胰岛素信号传导[72]。
研究[29]表明,运动诱导的脂肪因子变化可以调节肌肉和骨骼代谢,而运动介导的脂肪分解肌因子(IL-6、Irisin、LIF)的释放可通过促进脂肪细胞褐变来刺激产热,并通过降低全身性低度炎症,改善机体的新陈代谢。
3.2.3 脂肪组织—肝脏“对话”
肝脏是脂因子的主要靶器官。miR-99b或miR-141-3p是从脂肪库中释放的[70],miR-99b能够通过与肝脏中mRNA的3个主要非翻译区(3'UTR)结合调节FGF-21的表达[70]。此外,在全身低度性炎症中,Leptin可以上调IL-6和TNFα,并下调Adiponectin;高瘦素血症会导致瘦素抵抗,从而限制肌肉脂肪酸(FA)氧化并减少脂肪组织中的脂肪分解[73],而这种病理生理学反应可被身体活动有效抵消[74]。
3.2.4 脂肪组织—胰腺“对话”
T2DM是由于胰腺β细胞无法分泌足够的胰岛素来补偿增加的胰岛素抵抗。在疾病的早期阶段,胰岛素抵抗可通过增加β细胞功能和质量得到补偿。随着疾病的发展,由于细胞凋亡加速,β细胞的功能和质量发生恶化。因此,维持β细胞功能和质量是预防T2DM发病的关键[66]。
以前认为脂肪组织和胰腺之间的相互作用仅限于胰岛素介导的葡萄糖摄取,从而导致脂肪细胞中甘油三酯的储存增加。现在公认肥胖个体脂肪组织中的促炎性脂肪因子分泌失调可导致低度慢性炎症和胰岛素抵抗[5]。研究[2]发现,脂肪组织中分泌的脂因子会因急性和慢性耐力运动而发生改变,这些运动可通过内分泌样作用影响胰腺β细胞功能和T2DM的病理生理学变化。
3.2.5 脂肪组织—血管组织“对话”
内皮功能障碍是动脉粥样硬化发展的关键步骤,其特征是抗动脉粥样硬化分子一氧化氮(NO)的生物利用度降低、血管稳态受损导致血管收缩增加、白细胞黏附、血小板活化、平滑肌增殖等病理生理变化[75]。更重要的是,脂因子(如Adiponectin、Leptin和Visfatin等)已被公认为动脉粥样硬化血栓形成疾病的促进剂。研究[76]表明,Adiponectin可靶向血管内皮,通过与T-钙黏蛋白结合而引发器官保护功能。肥胖诱导的T-钙黏蛋白与Adiponectin的结合可减少内皮细胞外囊泡的分泌。这会影响内皮健康和脂肪组织细胞与远处器官之间的细胞间通信,从而影响全身能量稳态[76]。运动诱导的脂因子可激活血管内皮细胞中抗炎信号通路,通过释放经典的血管活性因子(如NO或血管紧张素Ⅱ)、控制纤溶因子(如PAI-1和血管活性脂肪因子)促进血管稳态[77]。运动诱导的Adiponectin可在血管壁中发挥抗炎和抗动脉粥样硬化的作用[66]。
3.2.6 脂肪组织—骨骼“对话”
脂肪细胞和成骨细胞来自共同的祖细胞——多能间充质基质细胞。多能间充质基质细胞可以分化成脂肪细胞或成骨细胞谱系,这取决于存在的调节因子。PPAR-γ通路驱动向脂肪细胞生成通路分化,同时抑制成骨细胞通路,而激活骨转录因子RUNX2(runt-related transcription factor 2)和Osterix(成骨细胞特异基因)则有利于骨细胞的形成[78]。临床研究表明,肥胖和瘦体重的减少与老年肥胖成年人骨矿物质密度(BMD)降低、脂肪因子水平升高和虚弱程度呈正相关,全身性低度炎症与BMD呈负相关[79],肥胖患者骨折发生率的增加源于脂肪组织体积膨胀产生的促炎性细胞因子导致的骨质流失[80]。对931项研究的荟萃分析[81]表明,Leptin与BMD呈正相关,Adiponectin与BMD呈负相关。多变量分析结果显示,Adiponectin是脂肪量与BMD之间关联的重要介质[79],而运动诱导的脂因子(IL-6、C反应蛋白、Adiponectin、Leptin等)的变化则能对骨转换和BMD产生有益影响[29],并且这种表型可以通过体育锻炼恢复[82]。
3.2.7 脂肪组织—脑“对话”
越来越多的证据表明,Leptin、Adiponectin、Apelin、Visfatin等由脂肪组织产生并释放到循环系统的脂因子可以穿过BBB在大脑中广泛表达[65]。Leptin作为一种靶向下丘脑的内分泌激素,可调节能量平衡、饱腹感、新陈代谢和体质量,其信号传导还可参与海马神经的可塑性变化[65]。Adiponectin可促进胰岛素敏感性,而Adiponectin缺乏会加剧胰岛素抵抗[83]。Leptin和Adiponectin途径可以调节细胞增殖、存活和突触可塑性,而Apelin、Visfatin等脂因子对神经炎症机制具有深远影响[65]。研究发现,体育锻炼不仅可以通过诱导这些脂因子分泌,改善血脂、脂肪组织炎症和胰岛素抵抗来有效减轻肥胖和代谢综合征,而且可以有效对抗Leptin抵抗[43],增强海马神经发生[84],改善记忆缺陷和淀粉样蛋白沉积,减少抑郁症状,恢复成人神经发生,改善突触可塑性和认知功能[85]。
3.3 骨骼—器官(组织)“对话”
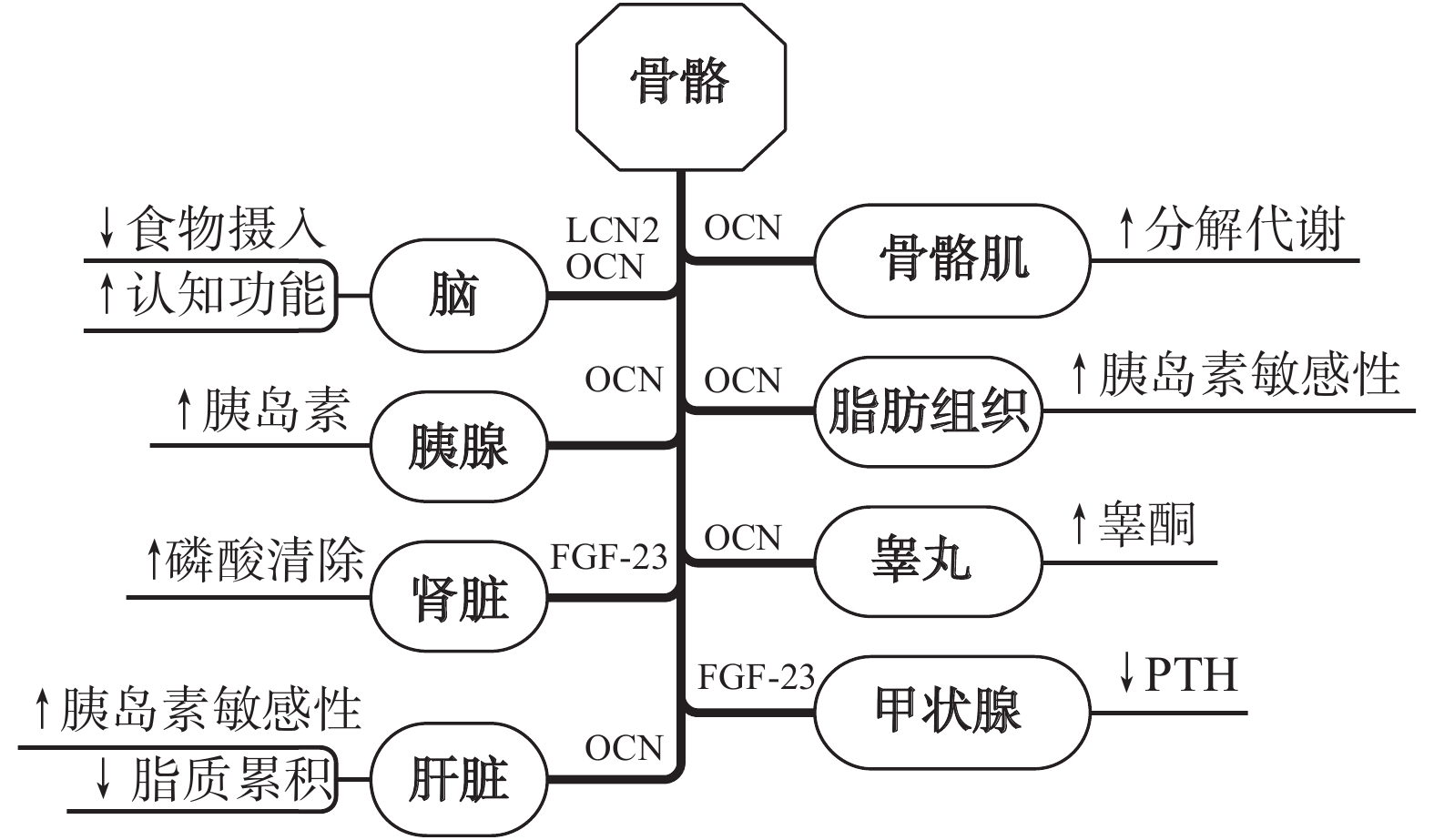
像骨骼肌、脂肪组织一样,骨骼也具有内分泌功能——产生和分泌骨因子。运动诱导的骨因子除了通过自分泌形式调节骨骼稳态、引导骨细胞适应和修复,使整个骨骼系统不断适应变化的外环境外,还可通过内分泌的形式对非骨器官产生影响[86],在调节全身稳态、能量代谢和认知功能等方面发挥重要作用(图4)。
3.3.1 骨骼—骨骼“自对话”
骨骼是一个不断重塑的动态器官。骨组织中的成骨细胞和骨细胞分泌的骨因子可以自分泌的方式对成骨细胞、破骨细胞和血管生成发挥调节作用,从而影响骨的形成[87]。其中,OCN是由骨细胞分泌的一种活性多肽,对羟基磷灰石具有高亲和力,并负责其在骨骼中的钙磷储存[88],在调节骨代谢中起重要作用。FGF-23由成骨细胞和骨细胞产生,可以调节磷酸盐代谢[87]。骨细胞分泌的SOST可抑制Wnt/β-catenin信号通路,进而抑制成骨细胞分化、增殖,具有强有力的抑制骨形成的作用[89]。骨保护素(OPG)通过与核因子κ-B配体受体致活剂(RANKL)结合并阻止其与RANK的相互作用对骨骼起保护作用[34]。
研究[86]表明,骨细胞可通过响应机械刺激机制精细调节SOST水平。免疫组织化学分析发现,机械负荷与SOST阳性骨细胞染色减少、骨形成、骨体积的增加有关[34]。此外,还有证据表明,运动可调节RANK/RANKL/OPG通路,进而对骨骼健康产生有益影响[34]。
3.3.2 骨骼—骨骼肌“对话”
如本文3.1.3所述,骨骼肌响应运动所分泌的肌因子可显著影响骨代谢和修复。同时,骨响应运动所分泌的骨因子也可向骨骼肌细胞发出信号,调控骨骼肌的结构和功能。有研究[34]指出,身体活动通过机械应力可同时调节骨因子和肌因子的分泌,在骨骼—骨骼肌“对话”中发挥核心作用。在运动过程中,一方面,骨因子OCN、OPG和FGF-23释放增加而SOST分泌降低,另一方面身体活动刺激肌肉组织产生的IL-6、IL-7、IL-8、IL-10、IL-15、Irisin和BAIBA增加而Myostatin分泌降低。这些机械和生化信号确保了骨骼和骨骼肌之间的通信[34]。因此,骨骼和骨骼肌不仅在生理学上相互依存(如肌肉发达与高骨量并存),在病理学上也存在相互作用(如骨质疏松症和肌肉减少症)[90]。
骨源性OCN可向骨骼肌细胞发出信号,促进葡萄糖和脂肪酸的摄取和利用,同时刺激骨骼肌分泌 IL-6;IL-6再次反馈给骨细胞以增强OCN的释放[84]。羧化不足的OCN可导致收缩后葡萄糖摄取的胰岛素依赖性增加,而缺乏OCN的小鼠肌肉量减少。OCN有助于运动过程中骨骼肌的营养吸收和分解代谢[88],运动诱导的OCN足以逆转小鼠衰老过程中发生的骨骼肌功能下降[34]。骨骼肌质量的维持取决于合成代谢和分解代谢之间的平衡,它们共同决定了肌肉蛋白质的水平。Mera等[91]观察到,老年小鼠肌肉纤维中的OCN信号可促进蛋白质合成,而其他肌肉合成代谢激素可激活 PI3K/Akt/mTOR通路,从而刺激蛋白质合成和骨骼肌肥大,表明OCN对运动过程中刺激骨骼肌中Akt磷酸化起关键作用[92]。
骨源性FGF-23是FGF家族的独特成员,不仅可以调节磷酸盐和维生素D的代谢,而且参与骨骼肌的多种适应性变化。研究[86]表明,慢性运动可以上调骨骼肌中FGF-23 mRNA的表达,增强骨骼肌中的线粒体功能。此外,FGF-23给药可显著降低骨骼肌中的ROS水平。这些结果表明,FGF-23在骨骼肌健康中起重要作用。
SOST是一种非常有效的成骨Wnt信号传导抑制剂,对骨细胞具有特异性。然而,近年来研究发现,血清SOST水平与骨骼肌质量呈负相关[93],并证明骨骼肌是OCN的新来源。这一令人惊讶的发现将骨骼—骨骼肌“对话”的复杂性提高到一个更高的水平,因为肌肉中产生的SOST可以与骨骼中产生的SOST协同作用,并加剧以骨骼和骨骼肌同时丧失为特征的病理状况的典型脆弱状态,如骨质疏松症[34]。另有研究[90]发现,运动可以下调 SOST和Dkk-1(Dickkopf-1)的血清水平,这标志着骨骼肌和骨骼之间可以通过运动产生重要联系。
3.3.3 骨骼—脑“对话”
作为机械敏感器官,骨骼在生物力学、身体—环境关系和神经系统通信中扮演着重要角色。运动诱导的骨因子不仅能够实现与周围神经系统(PNS)的间接“对话”,而且能穿过BBB与大脑进行直接“对话”。
研究[86]表明,大脑是OCN、LCN2、SOST、Dkk-1和FGF-23等骨因子的重要靶点,运动对大脑产生的一些有益影响可能与这些骨因子与大脑之间的“对话”有关。因此,通过运动刺激骨因子的释放有助于改善大脑的结构和功能。
动物研究[94]表明,OCN是大脑发育和发挥功能所必需的。在怀孕期间,母体循环中的OCN可穿过胎盘并调节胎儿大脑发育。OCN的循环水平和大脑的认知功能与年龄密切相关,这表明OCN可能也是遏制与衰老相关的认知衰退所必需的[86]。有文献[86]报道,OCN可以穿过BBB直接作用于脑干和海马,影响血清素、多巴胺和去甲肾上腺素等神经递质的合成,并抑制主要抑制性神经递质γ-氨基丁酸(GABA)的合成。因此,OCN可能对学习、记忆和认知功能的调节产生积极影响。临床研究[95]发现,血浆OCN、执行功能和认知功能之间存在正相关关系。此外,还有研究报道,低水平的OCN与中年女性通过磁共振成像观察到的脑微结构变化有关[96],有氧运动和联合运动均可增加小鼠和人血清OCN水平[97]。据此可以推测,OCN可能是调节运动促进大脑健康的因素之一,运动诱导的OCN可能会在运动预防焦虑和抑郁、改善与年龄相关的认知衰退、防治阿尔茨海默病(AD)中具有潜在的治疗调节作用[86]。
研究[86]表明,在正常情况下,循环血液中至少50%的LCN2由成骨细胞释放。LCN2具有多种生理调节功能,其中包括调节中性粒细胞对病原体的反应、肾小管细胞氧化应激、胰岛素释放和能量代谢,以维持葡萄糖稳态。LCN2还可以穿过BBB,与下丘脑神经元中的黑皮质素4受体结合以抑制食物摄入[87]。另外,目前已经证明SOST与低密度脂蛋白受体相关蛋白5和6(LRP5/6)结合并抑制Wnt信号传导,而Wnt信号可调节突触可塑性和记忆,并与AD等神经退行性疾病的发病机制有关[86]。Dkk-1在小鼠海马中的过度表达会导致学习和记忆受损,Dkk-1蛋白表达增加可能会导致脑缺血、癫痫和神经退行性病变过程中的脑细胞死亡[86],而长期运动会降低Dkk-1的血清水平[98],进而对脑的结构和功能产生有益影响。
尽管上述证据表明,运动诱导的骨因子能与中枢神经系统进行“对话”,但骨骼和神经系统之间的“对话”是双向交流的,除脑可以接受骨因子的调节外,骨骼也可以直接接受周围神经系统的调节,间接接受中枢神经系统的调节。研究[86]表明,中枢神经系统对骨骼的调节机制主要是通过下丘脑-垂体释放激素来介导的。例如:促卵泡激素(FSH)和促甲状腺激素(TSH)可以直接调节骨重塑;催乳素(PRL)可通过抑制成骨细胞增殖和骨矿化调节骨骼稳态;促肾上腺皮质激素(ACTH)可通过刺激成骨细胞增殖促进骨形成;生长激素(GH)可通过刺激调节骨骼发育IGF-1和直接作用于骨细胞来间接刺激骨生成,而抗利尿激素(ADH)和催产素(OT)可以通过相反的方式调节骨代谢;褪黑激素通过促进成骨细胞分化和生成来调节骨稳态;下丘脑弓状核(ARC)产生的神经肽Y(NPY)可通过外周位点的特异性效应调节骨稳态[86]。
3.3.4 骨骼—胰腺“对话”
目前已证实,至少有2种骨因子(OCN和LCN2)与葡萄糖和能量代谢有关。OCN可刺激胰腺β细胞产生和分泌胰岛素,而LCN2主要通过激活大脑中抑制食欲的信号来影响能量代谢。此外,还有研究[34]表明,SOST可抑制Wnt/β-连环蛋白信号通路,在胰岛素抵抗、炎症因子减少和代谢紊乱中发挥核心作用。
OCN可分为羧化完全骨钙素(cOCN)和羧化不全骨钙素(uOCN)。其中,uOCN可进入循环系统激活包括胰腺、脑和睾丸等多组织生物学功能[99]。多项临床研究[29]表明,运动后uOCN增加,其效应包括增加胰岛素分泌和敏感性以及葡萄糖摄取。横断面研究[97]表明,抗阻训练可引起uOCN增加,同时降低HbA1c、胰岛素抵抗和血糖。
3.3.5 骨骼—肾脏“对话”
骨源性FGF-23是血清磷酸盐水平的重要调节剂,它可以通过控制磷酸钠转运蛋白的表达和插入肾脏的近端小管膜增加磷酸盐的排泄[86],并可通过与肾脏中的FGFR1和共受体Klotho的复合物结合,抑制磷酸盐再吸收并抑制1,25(OH)2D3的产生[87],还可通过下调1α-羟化酶(维生素D激活酶)调节肾脏中的磷酸盐排泄和肠道磷酸盐的摄取[90]。
3.3.6 骨骼—血管组织“对话”
骨骼在很大程度上是一种机械敏感器官。在骨稳态和再生过程中,成骨细胞和软骨细胞释放的血管内皮生长因子A(VEGFA)可促进内皮细胞(ECs)的增殖、存活和迁移。内皮细胞是表达VEGF受体2(VEGFR2)的主要细胞群。血小板衍生的生长因子-BB(PDGF-BB)是破骨细胞前体分泌的血管生成因子,可以诱导H型血管形成,从而刺激骨形成[87]。研究[100]表明,机械负荷刺激后这些因子在血浆中质量浓度升高。此外,运动后释放的成骨因子IGF-1、FGF-23和Follistatin相关蛋白1(FSTL1)也可改善血管系统的内皮功能,并与心血管疾病的改善有关[4]。
3.4 肝脏—器官(组织)“对话”
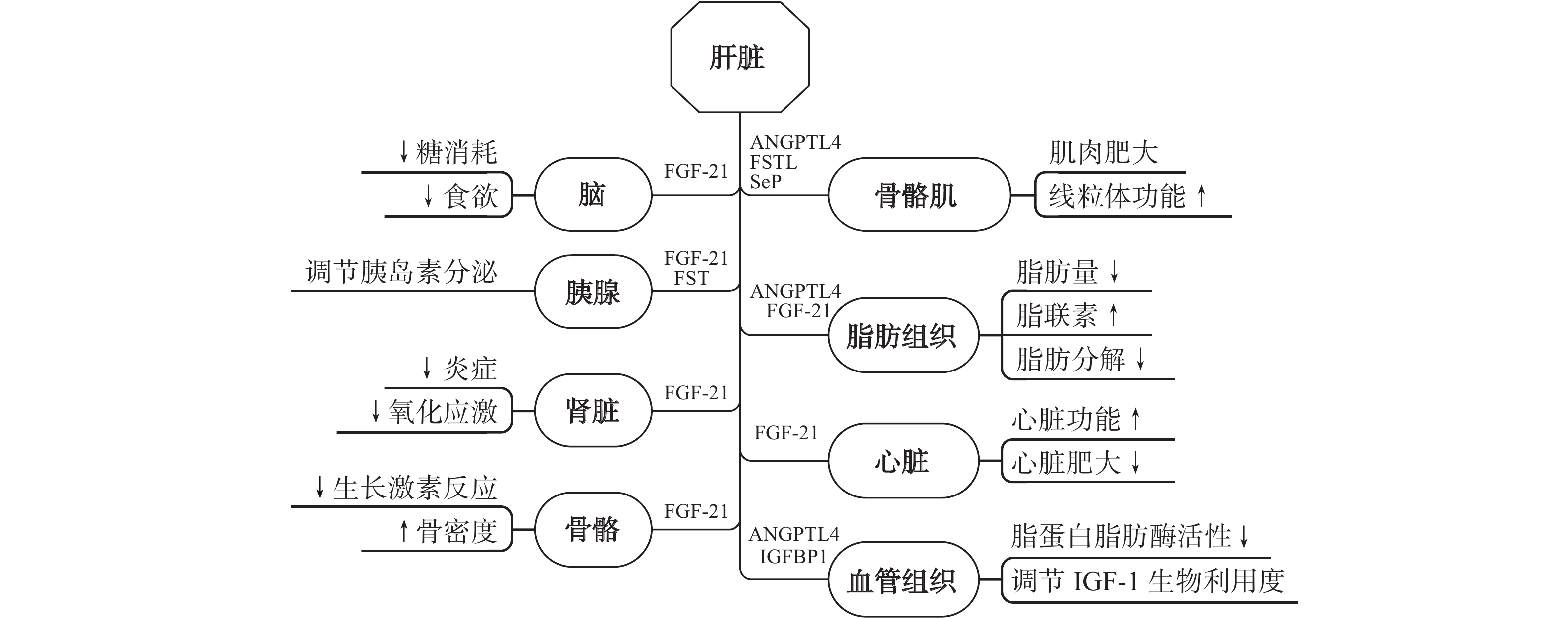
肝脏是机体能量代谢的中心器官,介于能量储存和利用之间,因此在生理(运动、禁食、食物摄入)和病理生理(代谢综合征、糖尿病、肥胖、恶病质)条件下都会受到挑战。运动期间肝脏受胰高血糖素与胰岛素比率变化的影响,会释放多种肝因子(FST、SeP、Fetuin-A、ANGPTL4、FGF-21、IGF-1、IGFBP1等),直接或被包裹在外泌体中释放到血液[101],并被血液循环携带至肝外组织或器官,通过提高胰岛素敏感性、增加葡萄糖摄取、降低血浆甘油三酯浓度、调节胆固醇稳态,改善炎症和线粒体功能,重新平衡自身和其他器官,在调节能量平衡中发挥作用,以维持糖脂代谢稳态。见图5。
3.4.1 肝脏—肝脏“自对话”
肝因子可以自分泌方式作用于肝脏自身。运动可通过促进脂肪分解增加FFA的释放,并增加胰高血糖素与胰岛素的比例,从而导致肝脏cAMP水平升高。在肝脏中,过氧化物酶体增殖物激活受体(PPAR)等转录因子和其他转录因子被激活,导致肝因子NGPTL4、FGF-21和FST转录活性的产生和释放增加。通过PPAR的脂肪酸信号传导可能有助于肝脏中FGF-21和ANGPTL4的转录调节,其效应包括增加肝脂肪氧化、减少肝脂肪生成[101]。
研究发现,运动对肝脏FGF-21表达有直接影响[102],有氧运动可增加FGF-21 mRNA在肝脏中的表达[103],自主跑轮运动可减轻小鼠肝脏炎症、降低高胰岛素血症和肝脏脂肪酸水平[104]。这些研究表明,肝脏在运动期间可以自分泌的方式对自身的代谢进行调节。
3.4.2 肝脏—脑“对话”
在生理学上,由FGF-21受体(FGFR1c、FGFR2c或FGFR3c)和单通道跨膜蛋白β-Klotho组成的复合物可通过FGF-21信号作用于下丘脑背侧调节昼夜节律行为的脑迷走神经复合体[105]。FGF-21可以进入大脑并激活下丘脑-垂体-肾上腺轴释放皮质酮,进而刺激肝脏糖异生,通过下丘脑室旁核中的FGF-21受体发出信号调节单糖摄入和对甜食的偏好[106]。FGF-21还被证明可以通过改善海马突触可塑性和大脑FGF-21信号传导来预防肥胖大鼠的认知功能下降[107]。在病理学上,IGF-1可能在酒精性肝病(ALD)并发的抑郁症中起作用[47]。
在下丘脑中,FGF-21发出的信号可以调节昼夜节律行为和葡萄糖的摄入。另有证据表明,运动诱发的FGF-21释放对神经元具有直接保护作用[43]。还有文献[108]报道,啮齿动物运动训练后中枢和外周IGF-1水平也有所增加,进而促使海马中的BDNF、突触可塑性标志物(如突触素和突触后密度蛋白)表达,并对健康大鼠的空间和厌恶性记忆产生积极影响。
3.4.3 肝脏—脂肪组织“对话”
肝源性FGF-21在脂肪组织中能对能量消耗和全身葡萄糖代谢产生深远影响。血管生成素样蛋白3、4或8(ANGPTL3/4/8)可促进人类肝脂肪变性,并作用于脂蛋白脂肪酶(LPL)以调节血浆脂质水平[109]。此外,肝脏在脂质过载的情况下,还可通过直接分泌miRNA调节脂肪组织代谢[110]。
运动或体力活动可以通过影响肝因子释放防治代谢紊乱和脂肪生成。目前已观察到FGF-21、Fetuin-A、ANGPTL4和FST参与肝因子和脂肪之间的“对话”机制[111] 。研究表明,运动诱导的FGF-21可能会增加脂肪组织褐变[101],改善全身胰岛素敏感性,控制血糖,增加脂肪组织脂肪分解及能量消耗[112],还可在运动调节脂肪组织Adiponectin释放、防止血管炎症和动脉粥样硬化斑块形成方面发挥积极作用[113]。
ANGPTL4可在人和小鼠的脂肪组织和肝脏中高度表达。它可通过抑制脂蛋白脂肪酶活性调节脂质代谢,从而减少甘油三酯衍生的脂肪酸进入组织并刺激脂肪组织的脂肪分解[114],同时它也是支持血管生成的重要细胞因子[60]。运动诱导的ANGPTL4可作为肝脏衍生的信号传递到外周组织,可在脂质分配、FFA摄取或释放,以及改善葡萄糖代谢中发挥作用,并可与降低T2DM风险和改善葡萄糖稳态联系起来[115]。Ingerslev等[116]报告,单腿运动可使受试者脂肪组织和肝脏中的ANGPTL4 mRNA表达增加,进而在代谢性疾病中发挥调节脂质代谢的作用。还有文献[117]报道,在运动期间血浆ANGPT4水平仅略微增加,而在运动后增加更为明显,并与运动强度和持续时间相关。因此,ANGPTL4可能有助于运动后脂肪组织的脂肪分解,但这种作用会随着时间的推移而消散[118]。
3.4.4 肝脏—胰腺“对话”
肝脏和胰腺在葡萄糖代谢和体内平衡中起互补作用,这种互补作用在很大程度上依赖于肝脏和胰腺之间的“对话”。研究[119-121]表明,作为能量储存以及葡萄糖和脂质代谢的重要器官和全身能量稳态的关键调节器官,肝脏可以通过与多个组织的相互作用感知和应对营养过剩和缺乏,在胰岛素抵抗和T2DM发生发展中具有核心作用。肝脏分泌的ANGPTL8可控制胰腺β细胞增殖和质量增加[119];肝细胞衍生的Kisspeptin1(KISS-1)在胰高血糖素的控制下,能转运到胰腺并与胰腺β细胞中大量表达的KISS-1受体相结合,从而抑制cAMP的产生和胰岛素分泌[120]。FGF-21能够诱导胰岛素敏感性和体质量减轻[47];ANGPTL4能抑制胰脂肪酶,进而减少脂肪的吸收,还可作用于WAT,刺激脂肪分解并降低脂蛋白脂肪酶(LPL)的活性 ,减少脂质在WAT中的积累[16]。
研究[121]表明,运动诱导的肝因子FGF-21的增加可通过胰高血糖素的机制引起全身FGF-21水平增加。在T2DM动物模型中,爬梯运动后FGF-21水平显著增加[122]。Lee等[123]报告,12周的运动可降低血糖异常患者的Fetuin-A水平,并改善葡萄糖代谢。Fetuin-A水平的降低可以预测巨噬细胞和脂肪组织中与炎症TLR4(Toll-like receptors 4)信号传导相关的基因表达的改变。基于这一证据,通过运动下调TLR4导致的Fetuin-A降低可能是肥胖、NAFLD、NASH和T2DM患者运动诱导抗炎作用的潜在机制。此外,运动诱导的FST可以调节胰腺的胰岛素和胰高血糖素分泌[101]。长时间的耐力运动促进胰高血糖素与胰岛素的比例和FFA的增加,通过激活ATF4/cAMP/ PPAR-α和cAMP信号通路,触发FGF-21、FST和ANGPTL4的产生和释放[111]。这表明,运动诱导的肝因子产生和释放对改善胰腺功能和糖脂代谢具有重要意义。
3.4.5 肝脏—骨骼肌“对话”
肝源性FST作为一种多功能分子,可以作为肝脏与胰腺、骨骼肌或脂肪组织联系的纽带。运动可以触发肝因子的分泌,包括FGF-21、FST、ANGPTL4和热休克蛋白72(HSP72)等。FST与Myostatin、胰岛素、IGF以及睾酮协同作用在调节肌肉肥大中意义非凡[124],而ANGPTL4可调节肌肉中的脂肪酸摄取[101]。研究[111]表明,单次耐力运动可以显著增加肝脏FGF-21 mRNA的表达。荟萃分析[125]表明,无论体质量如何,在急性运动后循环FGF-21质量浓度都会暂时增加。此外,在10周内进行有氧运动会增加肝脏和骨骼肌中HSP72的表达,从而改善T2DM大鼠的全身胰岛素抵抗和脂质代谢[126]。
此外,运动诱导的肝因子还可与骨骼、肾脏、心脏、血管组织、肠、眼、皮肤等器官或组织进行“对话”。然而,目前尚缺乏令人信服的证据,限于篇幅不再赘述。
4. 结论与展望
随着对运动在人类健康和疾病发生发展中作用的关注,运动诱导的细胞因子作为调控身体代谢稳态的新机制,已成为当代体育科学和运动医学研究的热点。然而,迄今为止,人们对运动因子及其与器官(组织)之间“对话”作用的认识还十分有限。最初认为,骨骼肌作为一种具有内分泌功能的器官,可响应运动而产生和释放肌因子进入血液循环,对全身其他器官产生影响。但根据近年来文献报道可知,骨骼、脂肪组织、肝脏也可被视为内分泌器官或组织,响应运动分泌骨因子、脂因子、肝因子,与肌因子一起构成复杂的“运动因子网络”,通过“对话”或“交互作用”机制对代谢信号转导途径进行调控,以维持身体的代谢稳态。运动因子、器官(组织)“对话”概念的提出进一步拓宽了人们对运动健康促进机制的认识,可能会为运动生理学研究开辟一条全新的路径。
运动作为一种“多效药”和“复方药”,可同时影响身体多个器官,而身体不同器官(组织)也会同时对运动作出响应,其机制除经典的神经—内分泌—免疫网络调控外,运动诱导的肌因子、骨因子、脂因子、肝因子等运动因子在器官(组织)之间“多层次”“多路径”的“对话”作用不可小觑。了解运动因子如何从骨骼肌、骨骼、脂肪组织和肝脏分泌和释放,以及它们如何作用于远端靶器官,将有助于建立运动、新陈代谢和健康之间的联系,可以为运动裨益健康提供新的证据。然而,身体内的细胞因子数以千计,许多新的运动因子仍有待确定。本文描述的运动因子可能只是“冰山一角”,但就这些运动因子而言,仍有一些问题需要进一步阐明:①运动因子释放的确切机制;②运动诱导运动因子释放的量效关系;③急性运动、慢性运动、耐力运动、抗阻运动与运动因子释放的关系;④基线健康水平对运动因子释放的影响;⑤运动因子“对话”的精确调控机制;⑥运动因子的协同作用。相信随着研究的深入,运动因子复杂“对话”的本质必将浮出水面,以进一步揭开运动裨益健康的神秘面纱。
-
表 1 运动诱导的肌因子及其功能
Table 1 Exercise-induced myokines and their functions
肌因子 主要功能 “对话”的器官或组织 运动类型 IL-6* 诱导肌肉肥大、葡萄糖摄取、糖原分解和脂肪分解;增加脂肪细胞中的脂肪分解和 FFA 氧化,诱导脂肪细胞褐变 肝、脂肪组织、胰腺、骨骼 耐力运动、抗阻运动 Irisin 刺激葡萄糖摄取和脂质代谢,诱导肌肉肥大;增强成骨细胞分化,诱导脂肪细胞褐变和脂肪分解,刺激糖异生并减少肝脏中的糖异生 脑、骨骼、心脏、血管组织、肾脏 抗阻运动 肌肉生长抑制素(Myostatin)* 促进肌肉蛋白降解,诱导肌肉结构基因和生肌因子下调,减轻肥胖和胰岛素抵抗,诱导能量消耗和脂肪细胞褐变 脂肪组织、肝脏、骨骼、肌肉组织 耐力运动、抗阻运动 IL-15 诱导肌肉肥大和葡萄糖摄取;增强脂肪细胞中的 FFA 氧化和脂肪分解;增强线粒体活性;有助于骨骼形成 脂肪组织、骨骼 抗阻运动、耐力运动 BDNF 增强 FFA 氧化和葡萄糖摄取;诱导脂肪细胞褐变;提高学习记忆力,调节骨骼肌代谢 脑、脂肪组织 抗阻运动、有氧运动 β-氨基异丁酸(BAIBA) 增加线粒体功能,增强抗炎作用,减少脂肪堆积,改善葡萄糖/脂质代谢紊乱,诱导脂肪细胞褐变,保持骨细胞活力 脂肪组织、肝脏、脑 耐力运动 CTRP15 靶向脂肪组织,增强葡萄糖摄取并刺激脂肪酸氧化 心脏、肝脏、脂肪组织 耐力运动 镍纹样蛋白(METRNL) 刺激能量消耗,增强葡萄糖耐量,增加米色脂肪细胞产热,提升抗炎细胞因子水平 脂肪组织 抗阻运动 核心蛋白聚糖(Decorin) 抑制血管生成和肿瘤发生,参与骨骼肌肥大 骨骼肌、骨骼 耐力运动 胰岛素样生长因子1(IGF-1) 促进骨骼发育和肌肉生长,增强神经精神功能 骨骼肌、骨骼、脑 急性运动、有氧运动 注:*表示除由骨骼肌分泌外,也可由脂肪组织分泌,又称为“脂肪肌因子”。 表 2 运动诱导的脂因子及其功能
Table 2 Exercise-induced adipokines and their functions
脂因子 主要功能 “对话”的器官或组织 运动类型 瘦素(Ieptin) 参与调节进食行为和能量平衡,刺激脂肪酸氧化,调节脂肪细胞的大小和体积,参与白色脂肪组织(WAT)褐变 脑、骨骼肌 有氧运动、耐力运动 抵抗素(Resistin) 促进氧化应激,改变胰岛素受体底物1和Akt1功能,减少基础和胰岛素刺激的葡萄糖摄取、氧化和糖原合成 血管组织、胰腺 抗阻运动 脂联素(Adiponectin) 防止胰岛素抵抗,调节免疫反应,调节巨噬细胞增殖和极化 免疫器官、肝、胰腺、骨骼肌 抗阻运动、耐力运动 内脂素(Visfatin) 胰岛素模拟物,促炎/免疫调节 骨、骨骼肌 耐力运动 爱帕琳(Apelin) 控制血压和心脏收缩力,减轻心脏肥大,增加葡萄糖摄取,增强认知功能,防治肌减少症 骨骼肌、心、胰腺 耐力运动、抗阻运动 锌-α2-糖蛋白(ZAG) 刺激脂肪组织分解并抑制脂肪生成,参与WAT褐变 皮下脂肪 有氧运动、耐力运动 转化生长因子-β2(TGF-β2) 调节葡萄糖和脂肪酸代谢,增加脂肪酸摄取和氧化,并刺激骨骼肌、心脏和棕色脂肪组织(BAT)的葡萄糖摄取 骨骼肌、心、肾 耐力运动 表 3 运动诱导的骨因子及其功能
Table 3 Exercise-induced osteokines and their functions
骨因子 主要功能 “对话”的器官或组织 运动类型 骨钙素(OCN) 促进糖原分解,增加脂肪酸的吸收和分解,改善胰岛素敏感性,减少脂肪积累,增加能量消耗 骨骼肌、脂肪组织、肝脏、胰腺 急性运动 硬化蛋白(SOST) 抑制Wnt/β-连环蛋白信号通路,在胰岛素抵抗、炎症因子减少和代谢紊乱中发挥核心作用,防止骨量和肌肉丢失 骨骼肌 抗阻运动 运载蛋白2(LCN2) 促进胰岛素分泌,调节食欲和葡萄糖代谢 胰腺、脑 耐力运动 成纤维细胞生长因子23(FGF-23) 通过下调1α-羟化酶调节肾中的磷酸盐排泄和肠道磷酸盐的吸收,参与炎症、红细胞生成,与肿瘤诱导的骨软化和骨质疏松症有关 骨骼肌、肾脏 急性运动、慢性运动 表 4 运动诱导的肝因子及其功能
Table 4 Exercise-induced hepatokines and functions
肝因子 主要功能 “对话”的器官或组织 运动类型 卵泡抑素(Follistatin,FST) 刺激葡萄糖摄取,促进内皮细胞功能,刺激血运重建,增强β细胞功能,增加心肌细胞数量和血管生成 心脏、胰腺、骨骼肌 力量训练、耐力运动 硒蛋白P(SeP) 解毒、抗炎、抗氧化,对神经细胞有保护作用,减少肥胖 肾脏、脑、脂肪组织 抗阻运动 胎球蛋白甲A(Fetuin-A) 诱导胰岛素抵抗,抑制脂肪细胞产生脂联素,诱导胰腺β细胞毒性,促进炎性因子活化,结合游离脂肪酸 脂肪组织、胰腺 有氧运动 FGF-21 与能量稳态、葡萄糖和脂质代谢以及胰岛素敏感性调节密切相关,可降低葡萄糖和甘油三酯水平,增强胰岛素敏感性和脂肪分解反应 脂肪组织、骨骼肌 有氧运动、耐力运动 血管生成素样蛋白4(ANGPTL4) 诱导甘油三酯脂肪酶刺激脂肪分解,抑制胰脂肪酶,减少膳食脂肪的吸收,抑制内脏脂肪组织中的脂质积累 脂肪组织、骨骼肌 有氧运动、抗阻运动 -
[1] 乔玉成.神经—内分泌—免疫网络在健身运动中的整合调控作用[J]. 体育科学,2002,22(4):115-120 doi: 10.3969/j.issn.1000-677X.2002.04.036 [2] SAFDAR A,SALEEM A,TARNOPOLSKY M A. The potential of endurance exercise-derived exosomes to treat metabolic diseases[J]. Nature Reviews Endocrinology,2016,12(9):504-517 doi: 10.1038/nrendo.2016.76
[3] 张星,李嘉,高峰.运动裨益心血管健康:从分子机制到临床应用[J]. 中国科学:生命科学,2022,52(2):174-189 [4] MAGLIULO L,BONDI D,PINI N,et al. The wonder exerkines—novel insights:A critical state-of-the-art review[J]. Molecular and Cellular Biochemistry,2022,477(1):105-113 doi: 10.1007/s11010-021-04264-5
[5] SEVERINSEN M C K,PEDERSEN B K. Muscle-organ crosstalk:The emerging roles of myokines[J]. Endocrine Reviews,2020,41(4):594-609 doi: 10.1210/endrev/bnaa016
[6] SAFDAR A,TARNOPOLSKY M A. Exosomes as mediators of the systemic adaptations to endurance exercise[J]. Cold Spring Harbor Perspectives in Medicine,2018,8(3):a029827 doi: 10.1101/cshperspect.a029827
[7] WHITHAM M,PARKER B L,FRIEDRICHSEN M,et al. Extracellular vesicles provide a means for tissue crosstalk during exercise[J]. Cell Metabolism,2018,27(1):237-251 doi: 10.1016/j.cmet.2017.12.001
[8] BRANDT C,PEDERSEN B K. The role of exercise-induced myokines in muscle homeostasis and the defense against chronic diseases[J]. Journal of Biomedicine & Biotechnology,2010,2010:520258
[9] ROMAO J M,JIN W W,HE M L,et al. MicroRNAs in bovine adipogenesis:Genomic context,expression and function[J]. BMC Genomics,2014,15:137 doi: 10.1186/1471-2164-15-137
[10] MELO S F S,BARAUNA V G,NEVES V J,et al. Exercise training restores the cardiac microRNA-1 and-214 levels regulating Ca2+ handling after myocardial infarction[J]. BMC Cardiovascular Disorders,2015,15:166 doi: 10.1186/s12872-015-0156-4
[11] NESCA V,GUAY C,JACOVETTI C,et al. Identification of particular groups of microRNAs that positively or negatively impact on beta cell function in obese models of type 2 diabetes[J]. Diabetologia,2013,56(10):2203-2212 doi: 10.1007/s00125-013-2993-y
[12] JANG C,OH S F,WADA S,et al. A branched-chain amino acid metabolite drives vascular fatty acid transport and causes insulin resistance[J]. Nature Medicine,2016,22(4):421-426 doi: 10.1038/nm.4057
[13] HE W H,MIAO F J P,LIN D C H,et al. Citric acid cycle intermediates as ligands for orphan G-protein-coupled receptors[J]. Nature,2004,429(6988):188-193 doi: 10.1038/nature02488
[14] MURPHY R M,WATT M J,FEBBRAIO M A. Metabolic communication during exercise[J]. Nature Metabolism,2020,2(9):805-816 doi: 10.1038/s42255-020-0258-x
[15] LIANG Y Y,ZHANG L D,LUO X,et al. All roads lead to Rome :A review of the potential mechanisms by which exerkines exhibit neuroprotective effects in Alzheimer's disease[J]. Neural Regeneration Research,2022,17(6):1210-1227 doi: 10.4103/1673-5374.325012
[16] DE OLIVEIRA DOS SANTOS A R,DE OLIVEIRA ZANUSO B,MIOLA V F B,et al. Adipokines,myokines,and hepatokines:Crosstalk and metabolic repercussions[J]. International Journal of Molecular Sciences,2021,22(5):2639 doi: 10.3390/ijms22052639
[17] ALIZADEH PAHLAVANI H. Exercise therapy for people with sarcopenic obesity:Myokines and adipokines as effective actors[J]. Frontiers in Endocrinology,2022,13:811751 doi: 10.3389/fendo.2022.811751
[18] GUO A,LI K,XIAO Q. Sarcopenic obesity:Myokines as potential diagnostic biomarkers and therapeutic targets?[J]. Experimental Gerontology,2020,139:111022 doi: 10.1016/j.exger.2020.111022
[19] BACZEK J,SILKIEWICZ M,WOJSZEL Z B. Myostatin as a biomarker of muscle wasting and other pathologies-state of the art and knowledge gaps[J]. Nutrients,2020,12(8):2401 doi: 10.3390/nu12082401
[20] WHITE T A,LEBRASSEUR N K. Myostatin and sarcopenia:Opportunities and challenges:A mini-review[J]. Gerontology,2014,60(4):289-293 doi: 10.1159/000356740
[21] BAGHERI R,MOGHADAM B H,CHURCH D D,et al. The effects of concurrent training order on body composition and serum concentrations of follistatin,myostatin and GDF11 in sarcopenic elderly men[J]. Experimental Gerontology,2020,133:110869 doi: 10.1016/j.exger.2020.110869
[22] LAURENS C,BERGOUIGNAN A,MORO C. Exercise-released myokines in the control of energy metabolism[J]. Frontiers in Physiology,2020,11:91 doi: 10.3389/fphys.2020.00091
[23] BOSTRÖM P,WU J,JEDRYCHOWSKI M P,et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J]. Nature,2012,481(7382):463-468 doi: 10.1038/nature10777
[24] TOWNSEND L K,KNUTH C M,WRIGHT D C. Cycling our way to fit fat[J]. Physiological Reports,2017,5(7):e13247 doi: 10.14814/phy2.13247
[25] RAO R R,LONG J Z,WHITE J P,et al. Meteorin-like is a hormone that regulates immune-adipose interactions to increase beige fat thermogenesis[J]. Cell,2014,157(6):1279-1291 doi: 10.1016/j.cell.2014.03.065
[26] KAMMOUN H L,FEBBRAIO M A. Come on BAIBA light my fire[J]. Cell Metabolism,2014,19(1):1-2 doi: 10.1016/j.cmet.2013.12.007
[27] THYFAULT J P,BERGOUIGNAN A. Exercise and metabolic health:Beyond skeletal muscle[J]. Diabetologia,2020,63(8):1464-1474 doi: 10.1007/s00125-020-05177-6
[28] LI G B,ZHANG L,WANG D E,et al. Muscle-bone crosstalk and potential therapies for sarco-osteoporosis[J]. Journal of Cellular Biochemistry,2019,120(9):14262-14273 doi: 10.1002/jcb.28946
[29] KIRK B,FEEHAN J,LOMBARDI G,et al. Muscle,bone,and fat crosstalk:The biological role of myokines,osteokines,and adipokines[J]. Current Osteoporosis Reports,2020,18(4):388-400 doi: 10.1007/s11914-020-00599-y
[30] GOMARASCA M,BANFI G,LOMBARDI G. Myokines:The endocrine coupling of skeletal muscle and bone[J]. Advances in Clinical Chemistry,2020,94:155-218
[31] LOMBARDI G,SANCHIS-GOMAR F,PEREGO S,et al. Implications of exercise-induced adipo-myokines in bone metabolism[J]. Endocrine,2016,54(2):284-305 doi: 10.1007/s12020-015-0834-0
[32] KITASE Y,VALLEJO J A,GUTHEIL W,et al. Β-aminoisobutyric acid,l-BAIBA,is a muscle-derived osteocyte survival factor[J]. Cell Reports,2018,22(6):1531-1544 doi: 10.1016/j.celrep.2018.01.041
[33] MAZUR-BIALY A I,KOZLOWSKA K,POCHEC E,et al. Myokine irisin-induced protection against oxidative stress in vitro. Involvement of heme oxygenase-1 and antioxidazing enzymes superoxide dismutase-2 and glutathione peroxidase[J]. Journal of Physiology and Pharmacology:An Official Journal of the Polish Physiological Society,2018,69(1):117-125
[34] CARIATI I,BONANNI R,ONORATO F,et al. Role of physical activity in bone–muscle crosstalk:Biological aspects and clinical implications[J]. Journal of Functional Morphology and Kinesiology,2021,6(2):55 doi: 10.3390/jfmk6020055
[35] COLAIANNI G,CUSCITO C,MONGELLI T,et al. The myokine irisin increases cortical bone mass[J]. PNAS,2015,112(39):12157-12162 doi: 10.1073/pnas.1516622112
[36] LOCATELLI V,BIANCHI V E. Effect of GH/IGF-1 on bone metabolism and osteoporsosis[J]. International Journal of Endocrinology,2014,2014:235060
[37] JOHNSON R W,WHITE J D,WALKER E C,et al. Myokines (muscle-derived cytokines and chemokines) including ciliary neurotrophic factor (CNTF) inhibit osteoblast differentiation[J]. Bone,2014,64:47-56 doi: 10.1016/j.bone.2014.03.053
[38] TANG H,YU R L,LIU S Y,et al. Irisin inhibits hepatic cholesterol synthesis via AMPK-SREBP2 signaling[J]. EBioMedicine,2016,6:139-148 doi: 10.1016/j.ebiom.2016.02.041
[39] LIU T Y,SHI C X,GAO R,et al. Irisin inhibits hepatic gluconeogenesis and increases glycogen synthesis via the PI3K/Akt pathway in type 2 diabetic mice and hepatocytes[J]. Clinical Science,2015,129(10):839-850 doi: 10.1042/CS20150009
[40] SELDIN M M,WONG G W. Regulation of tissue crosstalk by skeletal muscle-derived myonectin and other myokines[J]. Adipocyte,2012,1(4):200-202 doi: 10.4161/adip.20877
[41] LIU M Y,CAO H W,HOU Y T,et al. Liver plays a major role in FGF-21 mediated glucose homeostasis[J]. Cellular Physiology and Biochemistry,2018,45(4):1423-1433 doi: 10.1159/000487568
[42] SHI C X,ZHAO M X,SHU X D,et al. β-aminoisobutyric acid attenuates hepatic endoplasmic reticulum stress and glucose/lipid metabolic disturbance in mice with type 2 diabetes[J]. Scientific Reports,2016,6:21924 doi: 10.1038/srep21924
[43] LEE T H Y,FORMOLO D A,KONG T,et al. Potential exerkines for physical exercise-elicited pro-cognitive effects:Insight from clinical and animal research[J]. International Review of Neurobiology,2019,147:361-395
[44] PEDERSEN B K, SALTIN B. Exercise as medicine - evidence for prescribing exercise as therapy in 26 different chronic diseases[J]. Scandinavian Journal of Medicine & Science in Sports, 2015, 25(Suppl 3): 1-72
[45] MATTSON M P. Energy intake and exercise as determinants of brain health and vulnerability to injury and disease[J]. Cell Metabolism,2012,16(6):706-722 doi: 10.1016/j.cmet.2012.08.012
[46] MAŁKIEWICZ M A,SZARMACH A,SABISZ A,et al. Blood-brain barrier permeability and physical exercise[J]. Journal of Neuroinflammation,2019,16(1):15 doi: 10.1186/s12974-019-1403-x
[47] PEDERSEN B K. Physical activity and muscle– brain crosstalk[J]. Nature Reviews Endocrinology,2019,15(7):383-392 doi: 10.1038/s41574-019-0174-x
[48] LI D J,LI Y H,YUAN H B,et al. The novel exercise-induced hormone irisin protects against neuronal injury via activation of the Akt and ERK1/2 signaling pathways and contributes to the neuroprotection of physical exercise in cerebral ischemia[J]. Metabolism,2017,68:31-42 doi: 10.1016/j.metabol.2016.12.003
[49] TIAN L L,ZHU W L,LIU Y C,et al. Neural stem cells transfected with leukemia inhibitory factor promote neuroprotection in a rat model of cerebral ischemia[J]. Neuroscience Bulletin,2019,35(5):901-908 doi: 10.1007/s12264-019-00405-5
[50] SUTKOWY P,WOŹNIAK A,MILA-KIERZENKOWSKA C,et al. Physical activity vs. redox balance in the brain:Brain health,aging and diseases[J]. Antioxidants,2021,11(1):95 doi: 10.3390/antiox11010095
[51] BARLOW J P,SOLOMON T P. Do skeletal muscle-secreted factors influence the function of pancreatic β-cells?[J]. American Journal of Physiology. Endocrinology and Metabolism,2018,314(4):E297-E307 doi: 10.1152/ajpendo.00353.2017
[52] ELLINGSGAARD H,HAUSELMANN I,SCHULER B,et al. Interleukin-6 enhances insulin secretion by increasing glucagon-like peptide-1 secretion from L cells and alpha cells[J]. Nature Medicine,2011,17(11):1481-1489 doi: 10.1038/nm.2513
[53] HAN S,ENGLANDER E W,GOMEZ G A,et al. Pancreatitis activates pancreatic Apelin-APJ axis in mice[J]. American Journal of Physiology. Gastrointestinal and Liver Physiology,2013,305(2):G139-G150 doi: 10.1152/ajpgi.00370.2012
[54] LI Y X,CHENG K C,ASAKAWA A,et al. Role of musclin in the pathogenesis of hypertension in rat[J]. PLoS One,2013,8(8):e72004 doi: 10.1371/journal.pone.0072004
[55] NATALICCHIO A,MARRANO N,BIONDI G,et al. The myokine irisin is released in response to saturated fatty acids and promotes pancreatic β-cell survival and insulin secretion[J]. Diabetes,2017,66(11):2849-2856 doi: 10.2337/db17-0002
[56] ZHAO C X,QIAO C P,TANG R H,et al. Overcoming insulin insufficiency by forced follistatin expression in β-cells of db/db mice[J]. Molecular Therapy,2015,23(5):866-874 doi: 10.1038/mt.2015.29
[57] ZHOU J,LIU B,LIANG C,et al. Cytokine signaling in skeletal muscle wasting[J]. Trends in Endocrinology & Metabolism,2016,27(5):335-347
[58] ESPOSITO G,SCHIATTARELLA G G,PERRINO C,et al. Dermcidin:A skeletal muscle myokine modulating cardiomyocyte survival and infarct size after coronary artery ligation[J]. Cardiovascular Research,2015,107(4):431-441 doi: 10.1093/cvr/cvv173
[59] PARIKH V N,LIU J,SHANG C,et al. Apelin and APJ orchestrate complex tissue-specific control of cardiomyocyte hypertrophy and contractility in the hypertrophy-heart failure transition[J]. American Journal of Physiology. Heart and Circulatory Physiology,2018,315(2):H348-H356 doi: 10.1152/ajpheart.00693.2017
[60] BABAPOOR-FARROKHRAN S,JEE K,PUCHNER B,et al. Angiopoietin-like 4 is a potent angiogenic factor and a novel therapeutic target for patients with proliferative diabetic retinopathy[J]. PNAS,2015,112(23):E3030-E3039
[61] MIYABE M,OHASHI K,SHIBATA R,et al. Muscle-derived follistatin-like 1 functions to reduce neointimal formation after vascular injury[J]. Cardiovascular Research,2014,103(1):111-120 doi: 10.1093/cvr/cvu105
[62] DEVALLANCE E,BRANYAN K W,LEMASTER K C,et al. Exercise training prevents the perivascular adipose tissue-induced aortic dysfunction with metabolic syndrome[J]. Redox Biology,2019,26:101285 doi: 10.1016/j.redox.2019.101285
[63] CRANE J D,MACNEIL L G,LALLY J S,et al. Exercise-stimulated interleukin-15 is controlled by AMPK and regulates skin metabolism and aging[J]. Aging Cell,2015,14(4):625-634 doi: 10.1111/acel.12341
[64] FUNCKE J B,SCHERER P E. Beyond adiponectin and leptin:Adipose tissue-derived mediators of inter-organ communication[J]. Journal of Lipid Research,2019,60(10):1648-1697 doi: 10.1194/jlr.R094060
[65] LEE T H Y,CHENG K K Y,HOO R L C,et al. The novel perspectives of adipokines on brain health[J]. International Journal of Molecular Sciences,2019,20(22):5638 doi: 10.3390/ijms20225638
[66] ROMACHO T,ELSEN M,RÖHRBORN D,et al. Adipose tissue and its role in organ crosstalk[J]. Acta Physiologica,2014,210(4):733-753 doi: 10.1111/apha.12246
[67] BOA B C S,YUDKIN J S,VAN HINSBERGH V W M,et al. Exercise effects on perivascular adipose tissue:Endocrine and paracrine determinants of vascular function[J]. British Journal of Pharmacology,2017,174(20):3466-3481 doi: 10.1111/bph.13732
[68] MENDEZ-GUTIERREZ A,OSUNA-PRIETO F J,AGUILERA C M,et al. Endocrine mechanisms connecting exercise to brown adipose tissue metabolism:A human perspective[J]. Current Diabetes Reports,2020,20(9):40 doi: 10.1007/s11892-020-01319-7
[69] YU Y,DU H W,WEI S N,et al. Adipocyte-derived exosomal miR-27a induces insulin resistance in skeletal muscle through repression of PPARγ[J]. Theranostics,2018,8(8):2171-2188 doi: 10.7150/thno.22565
[70] ROMERO A,ECKEL J. Organ crosstalk and the modulation of insulin signaling[J]. Cells,2021,10(8):2082 doi: 10.3390/cells10082082
[71] DORAIRAJ V,SULAIMAN S A,ABU N,et al. Extracellular vesicles in the development of the non-alcoholic fatty liver disease:An update[J]. Biomolecules,2020,10(11):1494 doi: 10.3390/biom10111494
[72] KIM Y,KIM O K. Potential roles of adipocyte extracellular vesicle-derived miRNAs in obesity-mediated insulin resistance[J]. Advances in Nutrition,2020,12(2):566-574
[73] BATSIS J A,VILLAREAL D T. Sarcopenic obesity in older adults:Aetiology,epidemiology and treatment strategies[J]. Nature Reviews Endocrinology,2018,14(9):513-537 doi: 10.1038/s41574-018-0062-9
[74] NIMMO M A, LEGGATE M, VIANA J L, et al. The effect of physical activity on mediators of inflammation[J]. Diabetes, Obesity & Metabolism, 2013, 15(Suppl 3): 51-60
[75] VERMA S,BUCHANAN M R,ANDERSON T J. Endothelial function testing as a biomarker of vascular disease[J]. Circulation,2003,108(17):2054-2059 doi: 10.1161/01.CIR.0000089191.72957.ED
[76] SABARATNAM R,SVENNINGSEN P. Adipocyte-endothelium crosstalk in obesity[J]. Frontiers in Endocrinology,2021,12:681290 doi: 10.3389/fendo.2021.681290
[77] LAU D C W,DHILLON B,YAN H Y,et al. Adipokines:Molecular links between obesity and atheroslcerosis[J]. American Journal of Physiology. Heart and Circulatory Physiology,2005,288(5):H2031-H2041 doi: 10.1152/ajpheart.01058.2004
[78] PEI L M,TONTONOZ P. Fat's loss is bone's gain[J]. The Journal of Clinical Investigation,2004,113(6):805-806 doi: 10.1172/JCI21311
[79] AGUIRRE L,NAPOLI N,WATERS D,et al. Increasing adiposity is associated with higher adipokine levels and lower bone mineral density in obese older adults[J]. The Journal of Clinical Endocrinology & Metabolism,2014,99(9):3290-3297
[80] ZHAO L J,JIANG H,PAPASIAN C J,et al. Correlation of obesity and osteoporosis:Effect of fat mass on the determination of osteoporosis[J]. Journal of Bone and Mineral Research,2008,23(1):17-29
[81] BIVER E,SALLIOT C,COMBESCURE C,et al. Influence of adipokines and ghrelin on bone mineral density and fracture risk:A systematic review and meta-analysis[J]. The Journal of Clinical Endocrinology & Metabolism,2011,96(9):2703-2713
[82] MARQUES E A,MOTA J,VIANA J L,et al. Response of bone mineral density,inflammatory cytokines,and biochemical bone markers to a 32-week combined loading exercise programme in older men and women[J]. Archives of Gerontology and Geriatrics,2013,57(2):226-233 doi: 10.1016/j.archger.2013.03.014
[83] YE R S,SCHERER P E. Adiponectin,driver or passenger on the road to insulin sensitivity?[J]. Molecular Metabolism,2013,2(3):133-141 doi: 10.1016/j.molmet.2013.04.001
[84] DELEZIE J,HANDSCHIN C. Endocrine crosstalk between skeletal muscle and the brain[J]. Frontiers in Neurology,2018,9:698 doi: 10.3389/fneur.2018.00698
[85] LEE T H Y,YAU S Y. From obesity to hippocampal neurodegeneration:Pathogenesis and non-pharmacological interventions[J]. International Journal of Molecular Sciences,2020,22(1):201 doi: 10.3390/ijms22010201
[86] GEROSA L,LOMBARDI G. Bone-to-brain:A round trip in the adaptation to mechanical stimuli[J]. Frontiers in Physiology,2021,12:623893 doi: 10.3389/fphys.2021.623893
[87] HAN Y J,YOU X L,XING W H,et al. Paracrine and endocrine actions of bone:The functions of secretory proteins from osteoblasts,osteocytes,and osteoclasts[J]. Bone Research,2018,6:16 doi: 10.1038/s41413-018-0019-6
[88] LU W H,XIAO W F,XIE W Q,et al. The role of osteokines in sarcopenia:Therapeutic directions and application prospects[J]. Frontiers in Cell and Developmental Biology,2021,9:735374 doi: 10.3389/fcell.2021.735374
[89] 贾鹏,徐又佳.骨硬化蛋白在骨重塑中作用的研究进展[J]. 中华创伤杂志,2017,33(4):371-376 doi: 10.3760/cma.j.issn.1001-8050.2017.04.017 [90] HERRMANN M,ENGELKE K,EBERT R,et al. Interactions between muscle and bone:Where physics meets biology[J]. Biomolecules,2020,10(3):432 doi: 10.3390/biom10030432
[91] MERA P,LAUE K,WEI J W,et al. Osteocalcin is necessary and sufficient to maintain muscle mass in older mice[J]. Molecular Metabolism,2016,5(10):1042-1047 doi: 10.1016/j.molmet.2016.07.002
[92] MERA P,LAUE K,FERRON M,et al. Osteocalcin signaling in myofibers is necessary and sufficient for optimum adaptation to exercise[J]. Cell Metabolism,2016,23(6):1078-1092 doi: 10.1016/j.cmet.2016.05.004
[93] KIM J A,ROH E,HONG S H,et al. Association of serum sclerostin levels with low skeletal muscle mass:The Korean Sarcopenic Obesity Study (KSOS)[J]. Bone,2019,128:115053 doi: 10.1016/j.bone.2019.115053
[94] OURY F,KHRIMIAN L,DENNY C A,et al. Maternal and offspring pools of osteocalcin influence brain development and functions[J]. Cell,2013,155(1):228-241 doi: 10.1016/j.cell.2013.08.042
[95] BRADBURN S,MCPHEE J S,BAGLEY L,et al. Association between osteocalcin and cognitive performance in healthy older adults[J]. Age and Ageing,2016,45(6):844-849 doi: 10.1093/ageing/afw137
[96] PUIG J,BLASCO G,DAUNIS-I-ESTADELLA J,et al. Lower serum osteocalcin concentrations are associated with brain microstructural changes and worse cognitive performance[J]. Clinical Endocrinology,2016,84(5):756-763 doi: 10.1111/cen.12954
[97] MOHAMMAD RAHIMI G R,BIJEH N,RASHIDLAMIR A. Effects of exercise training on serum preptin,undercarboxylated osteocalcin and high molecular weight adiponectin in adults with metabolic syndrome[J]. Experimental Physiology,2020,105(3):449-459 doi: 10.1113/EP088036
[98] KIM T H,CHANG J S,PARK K S,et al. Effects of exercise training on circulating levels of Dickkpof-1 and secreted frizzled-related protein-1 in breast cancer survivors:A pilot single-blind randomized controlled trial[J]. PLoS One,2017,12(2):e0171771 doi: 10.1371/journal.pone.0171771
[99] 宗博艺,李世昌,孙朋,等.骨骼源性因子对肌骨“Crosstalk”作用机制的研究进展[J]. 中国骨质疏松杂志,2020,26(1):118-123 doi: 10.3969/j.issn.1006-7108.2020.01.025 [100] LIU C,CUI X,ACKERMANN T M,et al. Osteoblast-derived paracrine factors regulate angiogenesis in response to mechanical stimulation[J]. Integrative Biology:Quantitative Biosciences from Nano to Macro,2016,8(7):785-794 doi: 10.1039/C6IB00070C
[101] SABARATNAM R,WOJTASZEWSKI J F P,HØJLUND K. Factors mediating exercise-induced organ crosstalk[J]. Acta Physiologica,2022,234(2):e13766
[102] HE Z H,TIAN Y,VALENZUELA P L,et al. Myokine/adipokine response to "aerobic" exercise:Is it just a matter of exercise load?[J]. Frontiers in Physiology,2019,10:691 doi: 10.3389/fphys.2019.00691
[103] HANSEN J S,CLEMMESEN J O,SECHER N H,et al. Glucagon-to-insulin ratio is pivotal for splanchnic regulation of FGF-21 in humans[J]. Molecular Metabolism,2015,4(8):551-560 doi: 10.1016/j.molmet.2015.06.001
[104] PORTER J W,ROWLES J L 3rd,FLETCHER J A,et al. Anti-inflammatory effects of exercise training in adipose tissue do not require FGF-21[J]. The Journal of Endocrinology,2017,235(2):97-109 doi: 10.1530/JOE-17-0190
[105] BOOKOUT A L,DE GROOT M H M,OWEN B M,et al. FGF-21 regulates metabolism and circadian behavior by acting on the nervous system[J]. Nature Medicine,2013,19(9):1147-1152 doi: 10.1038/nm.3249
[106] VON HOLSTEIN-RATHLOU S,BONDURANT L D,PELTEKIAN L,et al. FGF21 mediates endocrine control of simple sugar intake and sweet taste preference by the liver[J]. Cell Metabolism,2016,23(2):335-343 doi: 10.1016/j.cmet.2015.12.003
[107] TOWNSEND L K,MACPHERSON R E K,WRIGHT D C. New horizon:Exercise and a focus on tissue-brain crosstalk[J]. The Journal of Clinical Endocrinology & Metabolism,2021,106(8):2147-2163
[108] SEGABINAZI E,GASPERINI N F,FAUSTINO A M,et al. Comparative overview of the effects of aerobic and resistance exercise on anxiety-like behavior,cognitive flexibility,and hippocampal synaptic plasticity parameters in healthy rats[J]. Brazilian Journal of Medical and Biological Research,2020,53(11):e9816 doi: 10.1590/1414-431x20209816
[109] CARBONE C,PIRO G,MERZ V,et al. Angiopoietin-like proteins in angiogenesis,inflammation and cancer[J]. International Journal of Molecular Sciences,2018,19(2):431 doi: 10.3390/ijms19020431
[110] WANG Y Y,WANG Y D,QI X Y,et al. Organokines and exosomes:Integrators of adipose tissue macrophage polarization and recruitment in obesity[J]. Frontiers in Endocrinology,2022,13:839849 doi: 10.3389/fendo.2022.839849
[111] ENNEQUIN G,SIRVENT P,WHITHAM M. Role of exercise-induced hepatokines in metabolic disorders[J]. American Journal of Physiology. Endocrinology and Metabolism,2019,317(1):E11-E24 doi: 10.1152/ajpendo.00433.2018
[112] FISHER F M,MARATOS-FLIER E. Understanding the physiology of FGF-21[J]. Annual Review of Physiology,2016,78:223-241 doi: 10.1146/annurev-physiol-021115-105339
[113] BABAKNEJAD N,NAYERI H,HEMMATI R,et al. An overview of FGF-19 and FGF-21:The therapeutic role in the treatment of the metabolic disorders and obesity[J]. Hormone and Metabolic Research,2018,50(6):441-452 doi: 10.1055/a-0623-2909
[114] ARYAL B,PRICE N L,SUAREZ Y,et al. ANGPTL4 in metabolic and cardiovascular disease[J]. Trends in Molecular Medicine,2019,25(8):723-734 doi: 10.1016/j.molmed.2019.05.010
[115] GUSAROVA V,O'DUSHLAINE C,TESLOVICH T M,et al. Genetic inactivation of ANGPTL4 improves glucose homeostasis and is associated with reduced risk of diabetes[J]. Nature Communications,2018,9:2252 doi: 10.1038/s41467-018-04611-z
[116] INGERSLEV B,HANSEN J S,HOFFMANN C,et al. Angiopoietin-like protein 4 is an exercise-induced hepatokine in humans,regulated by glucagon and cAMP[J]. Molecular Metabolism,2017,6(10):1286-1295 doi: 10.1016/j.molmet.2017.06.018
[117] GÓRECKA M,KRZEMIŃSKI K,BURACZEWSKA M,et al. Effect of mountain ultra-marathon running on plasma angiopoietin-like protein 4 and lipid profile in healthy trained men[J]. European Journal of Applied Physiology,2020,120(1):117-125 doi: 10.1007/s00421-019-04256-w
[118] LUNDSGAARD A M,FRITZEN A M,KIENS B. The importance of fatty acids as nutrients during post-exercise recovery[J]. Nutrients,2020,12(2):280 doi: 10.3390/nu12020280
[119] YI P,PARK J S,MELTON D A. Betatrophin:A hormone that controls pancreatic β cell proliferation[J]. Cell,2013,153(4):747-758 doi: 10.1016/j.cell.2013.04.008
[120] SONG W J,MONDAL P,WOLFE A,et al. Glucagon regulates hepatic kisspeptin to impair insulin secretion[J]. Cell Metabolism,2014,19(4):667-681 doi: 10.1016/j.cmet.2014.03.005
[121] HANSEN J S,PEDERSEN B K,XU G W,et al. Exercise-induced secretion of FGF-21 and follistatin are blocked by pancreatic clamp and impaired in Type 2 Diabetes[J]. The Journal of Clinical Endocrinology & Metabolism,2016,101(7):2816-2825
[122] KIM H J,SONG W. Resistance training increases fibroblast growth factor-21 and irisin levels in the skeletal muscle of Zucker diabetic fatty rats[J]. Journal of Exercise Nutrition & Biochemistry,2017,21(3):50-54
[123] LEE S,NORHEIM F,GULSETH H L,et al. Interaction between plasma fetuin-A and free fatty acids predicts changes in insulin sensitivity in response to long-term exercise[J]. Physiological Reports,2017,5(5):e13183 doi: 10.14814/phy2.13183
[124] WEIGERT C,HOENE M,PLOMGAARD P. Hepatokines:A novel group of exercise factors[J]. Pflügers Archiv-European Journal of Physiology,2019,471(3):383-396
[125] KHALAFI M,ALAMDARI K A,SYMONDS M E,et al. Impact of acute exercise on immediate and following early post-exercise FGF-21 concentration in adults:Systematic review and meta-analysis[J]. Hormones,2021,20(1):23-33 doi: 10.1007/s42000-020-00245-3
[126] TSUZUKI T,KOBAYASHI H,YOSHIHARA T,et al. Attenuation of exercise-induced heat shock protein 72 expression blunts improvements in whole-body insulin resistance in rats with type 2 diabetes[J]. Cell Stress & Chaperones,2017,22(2):263-269
-
期刊类型引用(7)
1. 韩征强,邹青海,孙玉玉,陈海平. 主动健康视域下运动促进健康新模式发展的要素结构、现实瓶颈与纾解策略. 沈阳体育学院学报. 2024(04): 73-80 .  百度学术
百度学术
2. 胡帅,武心茹,邢建强,沈飞,房冬梅. 运动因子对神经元线粒体功能障碍的改善作用及机制. 中国体育科技. 2024(06): 61-72 .  百度学术
百度学术
3. 孙明立,郑锡明. “体卫融合”背景下辽宁省慢病群体运动健康促进策略规划. 内江科技. 2024(09): 34-35+104 .  百度学术
百度学术
4. 李宗祥,马秋萍. 运动诱导代谢物变化在调节骨骼肌胰岛素抵抗中的作用. 体育科研. 2024(06): 79-91 .  百度学术
百度学术
5. 王天娇,卜淑敏,毛俊,蔡杰. 肌因子在抗阻训练诱导的骨骼肌肥大中的作用及研究进展. 中国骨质疏松杂志. 2023(11): 1663-1668 .  百度学术
百度学术
6. 乔玉成. 精准医学视角下慢性病运动干预效果差异的分子遗传学基础. 中国体育科技. 2023(10): 61-69 .  百度学术
百度学术
7. 袁馨梦,项梦奇,孙雯,徐晔,刘宇婷,陆矫,张媛. 骨骼肌-肝脏轴在运动干预非酒精性脂肪性肝病中的作用机制研究进展. 中国运动医学杂志. 2023(10): 807-817 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载: