Physical Exercise: The Time Clue that Mediates the Molecular Clock of Skeletal Muscle Circadian Rhythm
-
摘要:
对体育锻炼介导骨骼肌分子钟的相关文献进行综述,分析骨骼肌分子钟与体育锻炼的关系。发现:体育锻炼可调节骨骼肌的分子钟,并影响昼夜节律的振幅和相位,骨骼肌的运动能力也受到昼夜节律基因振荡中断的影响,运动对骨骼肌时钟基因的表达亦具有特定的昼夜时间效应;体育锻炼介导骨骼肌昼夜节律分子钟的授时途径主要表现在中央时钟的间接介导、骨骼肌收缩直接驱动、细胞反应因子的诱导、应激激素释放的调节等方面;体育锻炼介导骨骼肌昼夜节律分子钟能有效改善骨骼肌萎缩、睡眠障碍、代谢性疾病和心血管疾病。认为: 体育锻炼可在骨骼肌的昼夜节律系统中重新设置时钟,而个性化的定时锻炼亦可作为昼夜节律紊乱相关病理的有效处方,同时将运动和营养干预与分子钟同步也会最大限度地发挥体育锻炼对全身健康的促进作用。
Abstract:Related literature was reviewed to find how exercise induced the expression of skeletal muscle clock genes and the importance of exercise as synchronous stimulation of skeletal muscle circadian rhythm. It is found that physical exercise can mediate skeletal muscle circadian clock, and also influence its range and phase. The motion capability of skeletal muscle will also be affected by the vibration interruption of circadian clock. Clock gene has the function of myogenesis, transcription and metabolism. The potential time-serving pathways of physical exercise mediating skeletal muscle circadian clock are shown in the indirect mediation of central clock, the directly-driven skeletal muscle contraction, induction of cell factors, and the regulation of emergency hormone, etc. Physical exercise mediating skeletal muscle circadian clock can help improve the skeletal muscle atrophy, sleep barrier, metabolic and cardiovascular diseases. It is suggested that physical exercise can reset the clock in the skeletal muscle's circadian system. Furthermore, the individualized timing physical exercise can be used as an effective prescription of preventing disorders; in the meanwhile, the synchronization of physical exercise & nutrition intervention and molecular clock will put the improvement of overall health to the best use.
-
Keywords:
- physical exercise /
- skeletal muscle /
- clock gene /
- circadian rhythm /
- TTFL /
- zeitgeber
-
“时间线索”(Zeitgeber,以下简称“ZT”)一词最早由时间生物学家Aschoff[1]提出,其被定义为一种与生理24 h周期同步的外部时间信号。在生物钟系统的调控下,生物体表现出各种行为和生理的昼夜节律并保持大约24 h的波动[2],该系统主要由位于下丘脑视交叉上核(SCN)的中枢时钟控制,中枢时钟又可通过神经元与内分泌途径调控周围器官组织的外周时钟[3-4]。当内源性时钟系统接收到 ZT提示后就会诱导外源性行为模式(如睡眠/觉醒周期)的改变,日间“太阳光”信号被认为是最有力的授时因子,SCN中的昼夜节律起搏器在日间暴露于明亮光线下进入24 h的自然光暗周期[3],随后,外部时间信号从SCN起搏器通过组织神经/体液途径诱导外周昼夜节律的同步运作[5-6]。此外,非光性ZT,如进食、社会接触和体育锻炼等,亦能够调节生物钟的相位、周期和振幅等,导致昼夜节律的变化[7-8]。
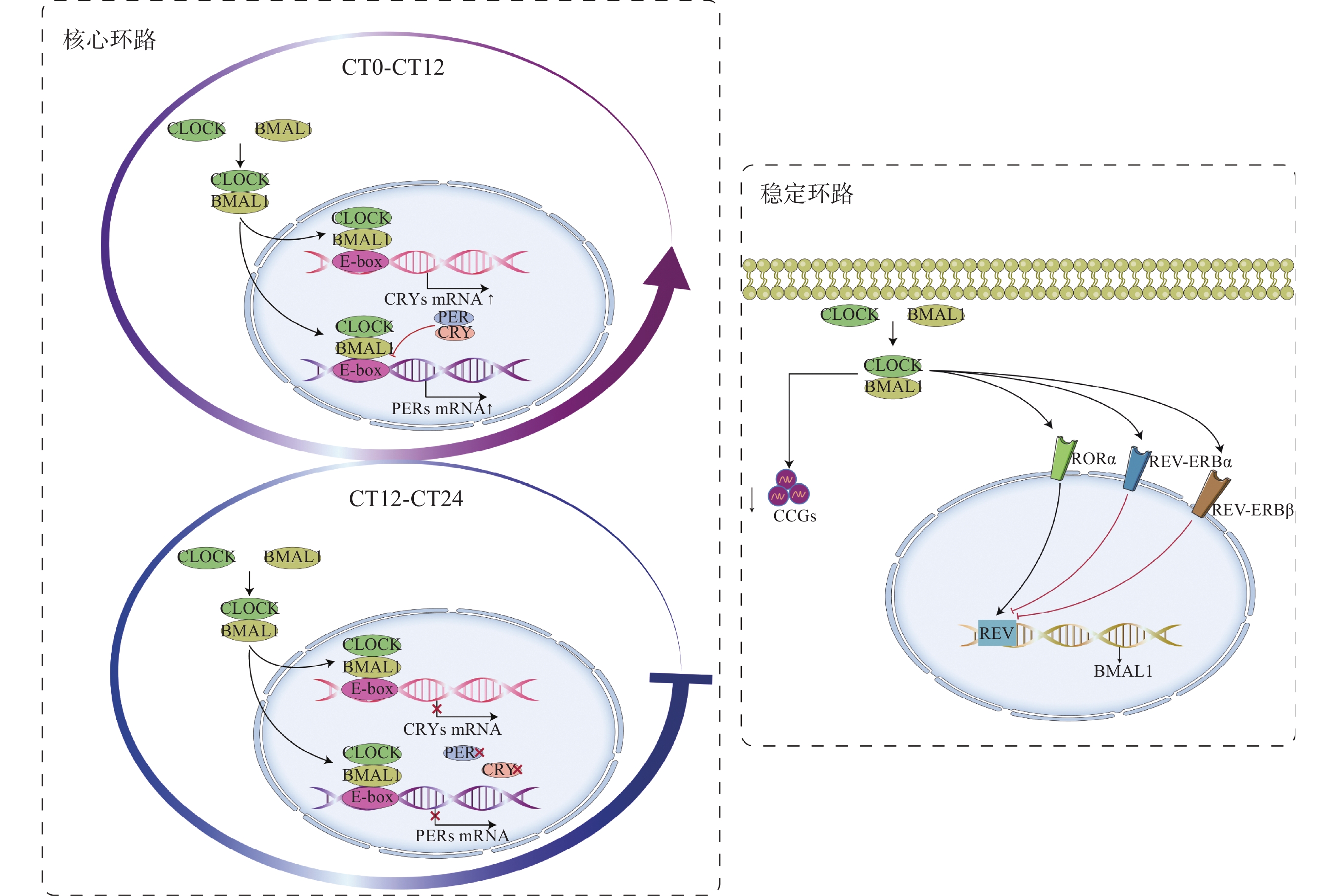
哺乳动物的昼夜节律是一个具有高度组织特异性和自我维持的生物钟,其核心分子机制主要是由多个基因构成的自主调控的转录翻译反馈环路(TTFL)(图1)[9-10]。TTFL主要包括核心环路和稳定环路2个过程。在核心环路中,转录激活因子BMAL1和CLOCK在细胞质bHLH-PAS结构域结合形成异源二聚体,并结合在靶基因的启动子E-box序列上转运入核,促进PERs(PER1、PER2、PER3)和CRYs(CRY1、CRY2)等基因的转录[11],随后PER与CRY蛋白结合形成复合物,在细胞核中不断积蓄并反馈抑制其自身表达[12]。在稳定环路中,BMAL1和CLOCK的二聚体可以促进核受体RORα和REV-ERBα的表达,而RORα和REV-ERBα/β通过REV反应元件序列对BMAL1的转录起到激活和抑制作用[12-13],分子钟的正确定时依赖于转录、翻译以及速率可变的翻译后修饰过程,这也为不同的生理功能信息和ZT修饰时钟提供了许多位点[14]。除计时功能外,分子钟还调控每日的转录程序,据估计,BMAL1和CLOCK可以直接调控4000多个时钟控制基因(CCGs)的表达[15],分子时钟网络与其他控制昼夜节律的转录激活因子一起驱动了CCGs的转录振荡,且在人体各器官组织中重叠十分有限[16]。
骨骼肌作为人体最大的外周组织,参与完成机体诸多复杂的生理功能,如在能量代谢中,其根据能量供应和需求波动实时对底物吸收、储存、利用和释放等过程进行精确调节[12, 17-19]。转录组学研究[20-21]发现,骨骼肌中有超过2300个基因以昼夜节律的方式表达;时钟基因敲除模型也揭示了昼夜节律紊乱对骨骼肌特异性生理功能和全身健康的负面影响,如骨骼肌纤维结构改变、线粒体呼吸减少及糖耐量和胰岛素敏感性受损等[19, 22-24]。已有研究[25-27]强调了外周时钟作为病理条件[肌萎缩、2型糖尿病(T2DM)等]下运动靶点的重要性。作为一种非光性同步器,体育锻炼是依赖细胞、组织和器官相互协调的生理活动过程[12],其可将骨骼肌昼夜节律系统重新校准至中央时钟,并在生物体上施加新的节律,而个性化的定时锻炼亦可作为预防和治疗由轮班工作或夜间生活方式等引起的代谢性疾病,成为昼夜节律紊乱相关病理的有效处方[28-33]。本文对体育锻炼介导骨骼肌分子钟的相关文献进行综述,以期为后续运动系统的节律性研究提供借鉴与参考。
1. 骨骼肌分子钟与体育锻炼的关系
1.1 体育锻炼调节骨骼肌分子钟
体育锻炼可调节骨骼肌的昼夜节律,并影响分子钟的相位和振幅[34]。小鼠骨骼肌昼夜转录组反应主要聚集在“活动期”的中点[35]。Nakao等[36]评估了单侧坐骨神经去神经支配对小鼠腓肠肌时钟基因表达的影响,发现骨骼肌中PER1、NR1D1、Rora、Dbp和Arntl的表达水平随着肌萎缩程度的增加显著降低,而PER2的表达水平则显著增加。Wolff等[7]运用PER2::LUC小鼠(将荧光素酶cDNA敲入PER2基因3′端,形成嵌合蛋白,以荧光强度报告昼夜周期)评估耐力训练对骨骼肌昼夜节律的影响,在4周的跑步机或轮跑运动后观察到小鼠比目鱼肌、趾长伸肌(EDL)、趾短屈肌(FDB)发光节律的显著变化。值得注意的是,训练前检测到小鼠3块肌肉时钟基因相位阶段明显不同,这可能是由于比目鱼肌主要由缓慢氧化肌纤维构成,而EDL和FDB由更多快收缩肌纤维组成,凸显了骨骼肌昼夜节律的复杂性[7]。在关于人类的研究[37]中,15 min功率自行车训练介导了骨骼肌PER和NR1D1蛋白表达的变化,并明显诱导了核心分子钟的相移;而抗阻训练介入后在运动腿和非运动腿的股四头肌活检标本中发现核心时钟基因BMAL1、CRY1和PER2表达的显著性差异[34],这都支持了骨骼肌分子钟机制部分调节运动的转录反应。有趣的是,Yeung等[38]对10名健康、中等体力活动水平男性进行1 h的单侧踢腿训练,在之后2 h、6 h和26 h的髌骨肌腱活检中均未检测到BMAL1、CRY1和PER2 mRNA表达的变化,这可能与髌骨肌腱本身时钟基因表达程度较低及无法排除运动腿对固定腿的系统性影响有关。
1.2 骨骼肌分子钟影响运动能力
骨骼肌的运动能力也受昼夜节律基因振荡中断的影响,相较于野生型小鼠,骨骼肌PER2基因敲除小鼠运动距离减少20%,但其肌肉收缩力量并未改变[39]。此外,Pircher等[40]观察到,REV-ERBα蛋白影响REV-ERBα蛋白无效等位基因在杂合子和纯合子小鼠中肌球蛋白重链同工型的表达。在慢肌纤维中,肌球蛋白重链同工型表达在杂合子、纯合子和野生型小鼠中并无明显不同,而在快肌纤维中则存在显著差异,提示时钟基因可作为骨骼肌收缩特性的调节因子。在关于人类的研究中,Hansen等[41]发现,耐力训练运动员的原代肌管维持了SIRT1 基因的节律性表达,而T2DM患者肌管中呈现出REV-ERBα基因节律性表达的减弱,这也体现了骨骼肌昼夜节律系统的正常运转对维持运动能力的重要性。
1.3 运动昼夜时间相移分子钟的表达
体育锻炼对骨骼肌时钟基因的表达亦具有特定的昼夜时间效应(表1)。自20世纪末开始,学者们就发现体育锻炼可作为昼夜节律的ZT,他们在对啮齿类动物和人类进行的运动干预性研究中发现,不同锻炼时间导致骨骼肌分子钟及相关昼夜节律标记(如睡眠/觉醒周期等)出现不同的相移[42-44],然而这些研究主要以动物“外源性行为”的变化作为运动对骨骼肌时钟相移的指标,且涉及的都是干预周期较长的重复性训练。Kemler等[45]在其最新研究中首次评估了单次运动对骨骼肌时钟基因的相移影响,其分别在光照期中期(开灯后5 h)、光照/黑暗期的结束期(熄灯前1 h)和黑暗期中期(分别对应ZT5、ZT11和ZT17这3个阶段)对PER2::LUC小鼠进行60 min的跑步机运动干预。结果显示,ZT5阶段的运动导致小鼠骨骼肌PER2蛋白含量提前100 min到达峰值,ZT11阶段的锻炼使PER2蛋白表达延迟约62 min,而ZT17阶段的锻炼后骨骼肌时钟基因蛋白表达无明显的相移。这表明单次急性运动可直接诱导骨骼肌时钟基因的相位改变,且骨骼肌时钟基因的相移方向(即提前还是推迟)与其所处的运动昼夜时间有关。虽然作者只研究了核心时钟基因表达的变化,但这有助于进一步揭示择时运动对受时钟基因调控的其他代谢靶点蛋白表达的影响[45]。总之,在“择时运动”的比较中直接测定骨骼肌分子钟的研究还较少,但一些关于其他昼夜节律标记(如褪黑素、温度等)的研究结果大都趋向于这样一个事实:夜间进行的中高强度运动似乎会导致骨骼肌时钟的相位延迟,而清晨进行的体育锻炼多使昼夜节律相位提前[47-50]。
表 1 体育锻炼诱导骨骼肌时钟基因表达Table 1. List of clock gene expression in skeletal muscle induced by physical exercise文献信息 研究对象 实验设计 研究结果 Wolff等[7](2012) 33只PER2::LUC小鼠(23只雄性、10只雌性) 运动组:小鼠分别在光照和黑暗条件下保持12 h,之后在光照条件下进行跑步机和轮跑运动2 h,持续4周;对照组:维持日常活动 相比于对照组,跑步机组和轮跑组小鼠比目鱼肌中PER2::LUC发光节律分别提前了约3 h和2 h,在肺部均提前约2 h,在SCN中未发生相移 Kemler等[45](2020) 30只PER2::LUC小鼠(雌性) 分别在一天中的ZT5、ZT11、ZT17阶段对小鼠进行跑步机干预(60 min/次,3次/d) ZT5阶段的运动诱导了小鼠骨骼肌PER2蛋白表达,相位提前约100 min;ZT11阶段的运动导致相位延迟约62 min;ZT17阶段运动无明显的相移 Yeung等[38](2019) 10名健康、中等体力活动水平男性 运动组:单侧非固定腿训练,踢腿35次/min,共60 min;对照组:另一条腿固定不动 与非运动腿和基线相比,干预后3个时间点(2 h、6 h和26 h)的髌骨肌腱活检中均无法检测到BMAL1、CRY1、PER2或NR1D1蛋白表达的显著差异 Small等[37](2020) 15名年轻健康男性 15 min功率自行车训练(80%VO2max) 急性运动后,骨骼肌PER1和PER2的蛋白表达较运动前显著增加约1.5倍,而NR1D1的蛋白表达有所降低,ARNTL和CRY1的表达较干预前无显著变化 Saracino等[46](2019) 12周龄的雄性REDD1−/−小鼠 运动组A:10 min热身+50 min跑步机训练;运动组B:100 Hz、1A的恒定电流刺激小鼠胫骨前肌,模拟强离心收缩;对照组:维持日常活动 相较于对照组,运动组B小鼠胫骨前肌BMAL1的mRNA表达显著增加,但PER1~3 mRNA水平未改变;运动组A小鼠胫骨前肌PER1的mRNA水平显著增加,PER3和BMAL1的表达未改变 2. 体育锻炼介导骨骼肌昼夜节律分子钟的授时途径
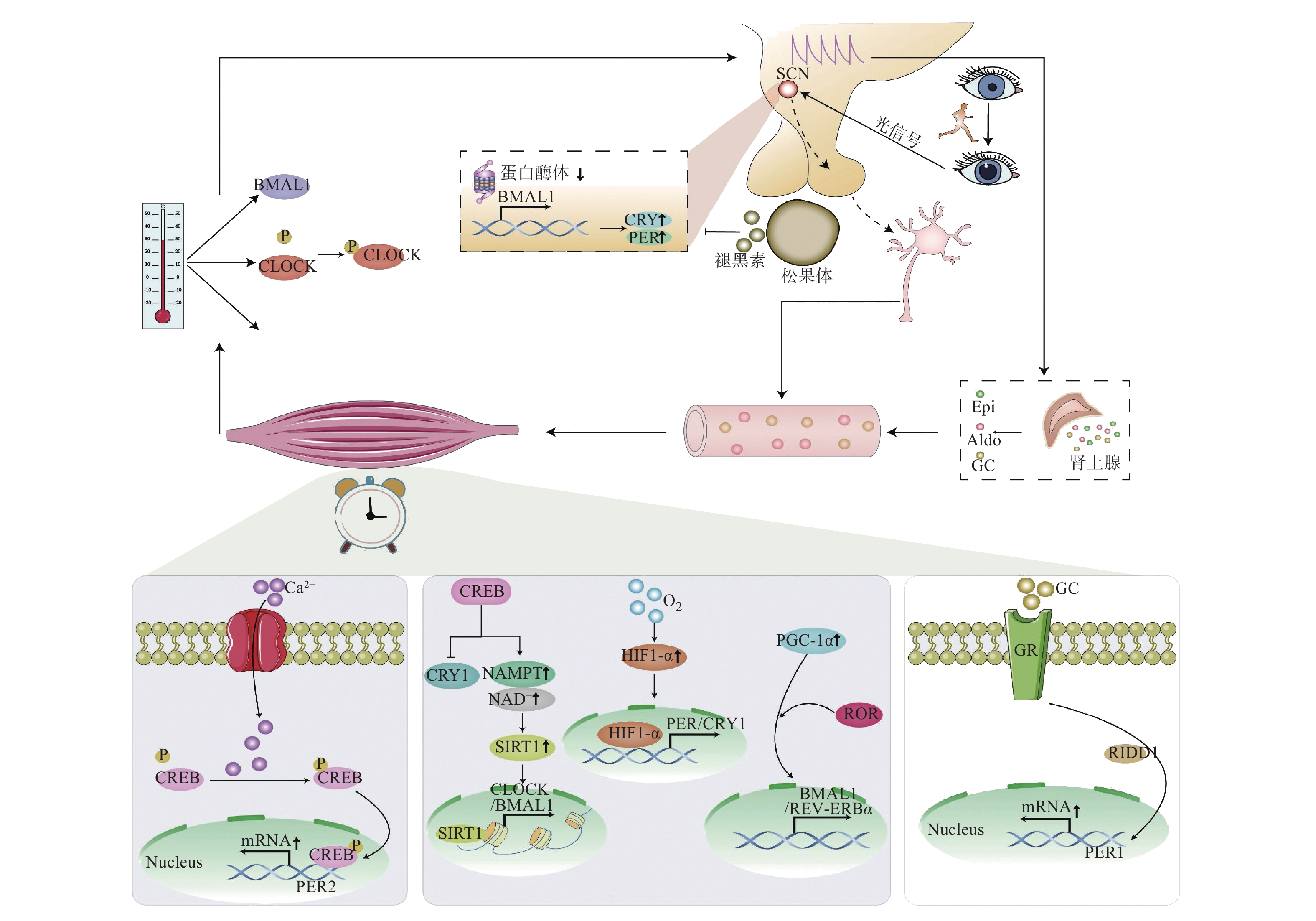
体育锻炼虽然可调节骨骼肌分子钟,但考虑到其是一种极为复杂的生理活动,不仅会引起骨骼肌的收缩,还伴随着交感神经活动、血浆激素和核心温度等的变化[51],故有必要厘清体育锻炼的授时途径(图2)。
2.1 中央时钟的间接介导
在哺乳动物中,位于SCN内的中央时钟通过神经和体液信号调控外周时钟,使二者的时相与外界ZT同步,故体育锻炼可通过作用于中央时钟间接介导骨骼肌的昼夜节律。
骨骼肌是人体最大产热器官,在身体活动过程中,随着物质代谢的加快产热量也增加,故运动诱导核心温度的升高可能是潜在的ZT。然而由于鲜有涉及人类骨骼肌分子钟热敏性的测定[52-53],体育锻炼是否可以通过提高核心温度等直接介导骨骼肌昼夜节律还有待探索。但一些研究发现温度可以影响SCN中神经元的放电速率[52]发现温度可以影响SCN中神经元的放电速率,SCN接受热信号可加快神经将节律投射到外周器官组织的速率,以此间接介导骨骼肌昼夜节律分子钟的变化。另一个假设是,身体活动对分子钟的影响可能归因于运动后夜间血浆褪黑素分泌的增多。褪黑素由松果体分泌,充当着SCN内生物钟与明/暗交替之间的介质,具有明显的昼夜节律[54-55]。近年来部分研究发现,褪黑素可直接作用于SCN并影响昼夜节律的时钟机制[29, 56](其可以通过第三脑室的脑脊液到达SCN及垂体结节部),如向大鼠骨骼肌注射褪黑素诱导了SCN内的BMAL1及REV-ERBα的相移[57]。Vriend等[58]在其假设模型中提出褪黑素分泌的增多可以抑制蛋白酶体,并干扰SCN和垂体结节部中BMAL1转录基因的负反馈环(CRY/PER和REV-ERBα),而褪黑素对蛋白酶体的抑制亦有助于稳定SCN中的BMAL1蛋白本身。然而,一些学者[59-60]研究发现夜间血浆褪黑素的分泌不受身体活动的影响,这可能是由于不同实验中受试者运动时的光照条件和昼夜时间差异导致的。此外,已知SCN通过视网膜–下丘脑束接收来自视网膜中光敏神经节细胞的输入,所以体育锻炼产生的一些眼部效应,如瞳孔增大等,也被认为可以通过增加传递给视网膜–下丘脑束的“光信号”对外周器官组织的昼夜节律产生间接影响[60-61]。
2.2 骨骼肌收缩直接驱动
运动时的全身系统反应和 SCN 的潜在混杂影响使得厘清体育锻炼如何介导骨骼肌昼夜节律变得尤为困难,故学者们试图揭示肌肉收缩是否可以直接诱导时钟基因的表达和相移。Small等[37]对C2C12肌管模型进行1 h的低频电脉冲刺后观察到PER2表达的上调和节律相移,证实了肌肉收缩本身可作为授时因子影响昼夜节律的变化,而骨骼肌收缩驱动 PER2上调可能是由 CRE 结合蛋白(CREB)介导的,因为磷酸化的 CREB能够激活PER2的表达。Ca2+可能是肌肉收缩诱导CREB磷酸化的潜在介质,因为硝苯地平(一种Ca2+通道阻滞剂)的加入减缓了CREB的磷酸化,药理学上通过离子霉素处理增加胞质钙含量模拟收缩对PER2表达的影响亦佐证了这一点,这表明肌肉收缩可以通过Ca2+介导的信号通路直接夹带分子钟对急性运动的反应。值得注意的是,体外模型中只报道了PER2基因表达的变化,故有理由推测以往研究[37, 62-63]报道的骨骼肌中CRY1、PER1和BMAL1等mRNA水平的变化是由体育锻炼引起的其他生理刺激介导的,如能量供应、神经体液因素和温度的改变等,而不是骨骼肌收缩本身,不过这仍需通过实验进一步验证。
2.3 细胞反应因子的诱导
除了肌肉收缩的直接驱动外,运动产生的细胞反应因子也可调节分子钟蛋白的相位、周期和振幅等[64]。运动中随着能量供应的改变可以有效激活骨骼肌内的AMPK,AMPK磷酸化可以促使CRY将营养信号传递给外周器官组织的分子钟系统,其方式是通过破坏CRY1蛋白的稳定性来实现的[65];同时AMPK可上调烟酰胺磷酸核糖基转移酶(NAMPT)的活性及其酶促反应物NAD+的表达,而NAD+的昼夜振荡可周期性地调节去乙酰化酶S1RT1的活性,后者进一步与CLOCK/BMAL1结合调节转录复合物的活性[66]。缺氧诱导因子-α(HIF-α)已被证明是联系机体缺氧信号通路和昼夜节律之间的重要调节节点[67],剧烈运动如无氧运动和高强度间歇训练诱导HIF-α的产生,在缺氧状态下HIF-α可直接结合核心时钟基因启动子调节下游时钟控制基因PER和CRY1来介导骨骼肌分子钟的输出[68];亦有研究[69]表明,下游分化型胚胎软骨细胞表达基因1,2(DEC1/2)受到HIF-α的调控也可抑制BMALL和PER的表达。除了AMPK和HIF-α外,运动诱导骨骼肌过氧化物酶体增殖物激活受体γ共激活因子-1 ( PGC-1α) 的表达上调也是其介导骨骼肌昼夜节律的可能途径, PGC-1α作为机体能量代谢的重要转录辅助激活因子,在耐力运动和抗阻运动中起到增强骨骼肌收缩和促进其适应的作用[70]。Liu等[71]的实验发现,骨骼肌中 PGC-1α缺失的小鼠表现出时钟基因表达的减弱和昼夜节律的紊乱,而PGC-1α可通过共激活ROR家族基因促进BMAL1和REV-ERBα的表达,这提示 PGC-1α可能在TTFL尤其是稳定环路中起到关键作用。
2.4 应激激素释放的调节
体育锻炼后身体应激激素的释放也可调节骨骼肌分子钟。REDD1作为糖皮质激素的靶基因,已被证明参与急性有氧运动后PER1 mRNA的调控[72]。Saracino等[46]研究发现,在运动中阻断REDD1的表达完全抑制了PER1 mRNA 的变化,表明REDD1在驱动骨骼肌PER1的表达方面承担完全中介作用,而跑轮运动前接受载脂蛋白和糖皮质激素受体拮抗剂(RU-486)的小鼠,在有氧训练后观察到骨骼肌中 RU-486 钝化但未阻断PER1的诱导,提示存在其他神经体液因素介导REDD1信号通路。有氧运动还会刺激醛固酮 (Aldo)和肾上腺素(Epi)等肾上腺激素的分泌,肌管模型同样证实了其能通过REDD1信号通路调节骨骼肌昼夜节律[46]。
虽然在有氧运动中REDD1信号通路可调节应激激素诱导的骨骼肌时钟基因的表达,但这些变化与长期训练的适应关系尚不清楚,而这种机制亦可能只适用于有氧训练。研究[46]发现,急性高强度抗阻运动后,由于糖皮质激素信号通路受到抑制,导致激素受体磷酸化,从而进一步降低REDD1的表达;虽然有氧和抗阻运动都会促进骨骼肌肾上腺激素的分泌,但由于二者分子信号通路传导的差异性,后者骨骼肌REDD1的表达并未因此增加[46],故抗阻训练后激素信号通路如何介导骨骼肌时钟基因表达仍需学者持续关注。
可见,由于体育锻炼复杂的全身系统效应,其可以通过多种途径介导骨骼肌昼夜节律,但体育锻炼介导骨骼肌昼夜节律分子钟的授时途径尚未被完全揭示。此外,考虑到不同运动模式下肌肉使用模式和信号通路传导的差异性,其授时途径也可能不同,这些都值得进一步探索。
3. 体育锻炼介导骨骼肌昼夜节律分子钟的应用
适当的昼夜节律是维持健康的先决条件,当骨骼肌内源性时钟与外源性明暗周期失同步时就可能出现肌萎缩、血脂异常、胰岛素抵抗、葡萄糖耐受不良以及睡眠剥夺等病理表现[25,73-75]。作为一种强有力的ZT,体育锻炼已被证明可以在骨骼肌中重新“设置时钟”达到促进健康的目的,而鉴于人体内基础生理节律(如心率、激素、代谢物浓度和骨骼肌氧化能力等)的昼夜振荡对运动反应有直接影响,个性化的定时锻炼亦可作为预防和治疗由轮班工作和夜间生活方式等引起的昼夜节律紊乱相关病理的有效处方。
3.1 骨骼肌萎缩
骨骼肌的质量维持与昼夜节律密切相关,在CLOCK−/−小鼠中发现骨骼肌肌丝结构破坏、肌力水平下降[76-79],骨骼肌BMAL1−/−和CLOCKΔ19小鼠表现出线粒体体积下降、形态异常和呼吸解偶联的增加[14]。这都表明昼夜节律可调节骨骼肌质量结构,但具体途径尚不明确。蛋白质合成和降解及线粒体质量控制可能介导了由昼夜节律紊乱引起的骨骼肌萎缩。运动逆转骨骼肌萎缩涉及多种分子信号通路,如通过AMPK/Sirt1信号通路降低 mTOR活性调节自噬;特定强度的运动还可诱导PI3K/Akt/mTOR蛋白的磷酸化,促进肌肉质量的增长[78-82]。
一般认为,抗阻训练是促进骨骼肌蛋白合成的有效手段[80],运动中AMPK活性的增加可磷酸化激活下游靶蛋白和作用于许多转录因子,调控基因表达,并促进昼夜节律和细胞自噬的启动。运动昼夜时间可能影响骨骼肌蛋白合成和运动能力,如相较于其他时间点,早晨7:00—8:00的肌肉最大自主收缩力更高[81];Küüsmaa等[30]分别在清晨和夜晚对42名男性进行24周的力量训练干预,结果显示,夜间训练组较清晨训练组增加了更多的肌肉量。二者运动周期、实验方案和受试者的个体差异都可能导致结果的不同。从骨骼肌核心时钟与mTORC1和下游信号相互作用的角度看,在大鼠中,骨骼肌蛋白质合成速率和p70S6K活性在光期达到峰值,按照相位差值可以推测人类骨骼肌蛋白合成速率在夜间达到峰值[24];而从皮质醇适应性角度看,清晨进行的抗阻运动似乎更有助于无氧运动能力的提高[82-83]。综上,抗阻运动可能通过作用于骨骼肌昼夜节律系统在肌萎缩等发病机制中发挥作用,但考虑到相关变量的干扰,其诱导的骨骼肌肥大的最佳训练时间仍需进一步探讨。
线粒体质量控制也是维持骨骼肌质量和功能的重要保证[84]。核受体REV-ERBα 参与调节骨骼肌线粒体生物发生和自噬。研究[85]发现,骨骼肌中REV-ERBα的缺失介导了Atrogenes基因表达和自噬标志物LC3-Ⅱ水平的增加,并降低骨骼肌线粒体含量和肌纤维的体积。(高强度运动后)REV-ERBα的过度表达则可通过与相关基因调控区结合抑制自噬,同时增加线粒体氧化能力[82],提示REV-ERBα是骨骼肌分子钟改善线粒体质量的潜在运动靶点。此外,PGC-1α 除了在运动诱导线粒体生物合成中发挥调节作用外,还参与介导骨骼肌昼夜节律TTFL中时钟基因的表达,故PGC-1α蛋白表达的降低也可能有助于阐释昼夜节律紊乱对骨骼肌线粒体功能障碍的影响。对此,已有研究[27]发现,长期耐力训练可以改善CLOCK突变小鼠中PGC-1α的蛋白表达和线粒体含量,进一步佐证了运动可以修复昼夜节律异常引起的骨骼肌功能障碍。值得注意的是,由于线粒体分裂、融合和氧化功能等表现出内在的昼夜节律[86],选择与线粒体动态周期相吻合的“运动时间”可能会放大锻炼对线粒体形态学和动力学等的重塑作用,并影响代谢结果。研究[43]发现,相较于早上7:00,晚上9:00的运动显著增加了小鼠心肌和骨骼肌PGC-1α的mRNA水平,提示运动昼夜时间可能影响骨骼肌线粒体的生物发生。然而,关于运动昼夜时间对骨骼肌线粒体影响的研究十分有限,仍需要进一步考量将运动昼夜时间与线粒体功能峰值相同步是否可以最大化骨骼肌运动能力。
3.2 轮班工作和睡眠障碍
流行病学调查显示,全球大约有15%~30%的人口经历轮班工作[87-88],这些人的“睡眠/觉醒模式”发生改变,内源性生物钟和外源性明暗周期严重失同步,睡眠障碍的风险随之增加。骨骼肌时钟基因可以调节睡眠稳态,BMAL1−/−小鼠表现出非快速眼动期睡眠的增加[89],通过在骨骼肌中特异性恢复BMALL基因,发现其慢波活动(Slow Wave Activity,SWA)和睡眠时长增加[22]。考虑到清晨和傍晚的运动都可提高骨骼肌BMAL1的转录活性,故骨骼肌中BMAL1可能是运动疗法的有效靶点。此外,双敲除CRY1和CRY2基因也可影响小鼠的睡眠及SWA变化[90]。
有氧训练可通过运动后体温的轻度升高、迷走神经功能的改善、皮质醇的适应以及相移效应等改善睡眠障碍。计划性定时锻炼已被发现可改变小鼠骨骼肌中PER1的表达,并加快其进入新光暗周期的速度[42]。Miyazaki等[91]对执行23 h 40 min睡眠/觉醒周期表的人群进行自行车和划船运动干预(2 h/次,2次/d),发现受试者血浆褪黑素的相位随着体育锻炼的进行而提前,相位差异在干预的第6天达到显著性水平。Eastman等[92]研究了连续定时运动是否会延迟夜班工人的体温节律,使其与白天的睡眠时间表相一致,运动组工人在每8次夜班中的前3次进行15 min/h的功率自行车锻炼,结果显示,相较于不运动组,定时运动促使工人的体温节律出现较大的相位延迟,在纳入协变量后发现,其相移幅度与受试者的日常时型(晨时/夜时)存在较强的相关性。尽管这种锻炼方案是否适用于大多数轮班工人还有待商榷,但证实了定时锻炼有助于改善工人紊乱的昼夜节律从而适应轮班工作。
除了相移效应外,一般认为具有高振幅骨骼肌分子钟的个体更能耐受轮班工作和睡眠剥夺,较大的振幅带来更加稳定的生物节律。Atkinson等[93]发现,经常参与体育锻炼的年轻人群主观觉醒、左右握力、次最大心率等的振幅较不积极参与者高1.5~2.5倍;Van Someren等[94]的研究报告了相似的结果。然而,在相关人群的运动干预中对骨骼肌分子钟的直接测定还较少,体育锻炼的相移和增幅(振幅)效应也主要反应在激素、温度和个体的行为过程上,而这些昼夜节律标记或外源性行为的变化是否由骨骼肌分子钟而不是其他器官组织介导(或多大程度上由骨骼肌分子钟介导),仍有待进一步厘清。值得注意的是,作为介导骨骼肌分子钟表达最有力的ZT,日光照射可能对睡眠的改善产生增益效果。研究[95]发现,清晨日光下的暴露可减少办公室工作人员的睡眠潜伏期和负性情绪,将多种强有力的授时因子相同步可能有助于改善睡眠卫生,如日间进行的户外体育锻炼或社交活动。
3.3 代谢性和心血管疾病
骨骼肌是全身代谢的主要贡献者,时钟基因可以预期肌肉细胞底物的代谢转变[19, 23-24, 96-99]。骨骼肌昼夜节律紊乱导致底物利用向脂质优先转移,碳水化合物的氧化降低在全身水平上可能表现为脂质贮存、糖代谢、肝脏免疫力降低及外周胰岛素抵抗和酮血症等[12],因此骨骼肌昼夜节律时钟的正常运转对于维持长期的心脏代谢健康是必要的。
体育锻炼作为治疗心血管疾病和代谢性疾病等的“非药物处方”已被广泛报道,然而更值得探讨的是,外周时钟是否在运动介导的生理益处中发挥作用。研究[25]结果显示,对冠心病(CAD)和T2DM患者进行6个月的运动干预(1个月的住院锻炼+5个月的动态治疗)后,在患者的骨骼肌活检中检测到基因CLOCK表达的时间依赖性效应,而REV-ERBα靶蛋白氨基乙酰丙酸-δ-合成酶-1(ALAS1)基因表达较基线也显著增加。此外,Pastore等[27]发现,8周的慢性自愿跑轮运动改善了时钟突变小鼠骨骼肌糖耐量水平,并降低了其体质量的增加速度。然而,由于这2项研究均未检测到骨骼肌核心时钟基因表达的变化,并不能作为高质量的证据支撑。有学者认为,运动可以通过作用于骨骼肌分子钟及其控制的代谢途径,将底物代谢恢复至碳水化合物和脂质氧化之间的最佳平衡,从而降低心脏代谢疾病的发生风险,不过这仍需进一步验证。
昼夜节律调节是控制骨骼肌新陈代谢的关键,故运动对能量代谢的影响是否具有组织特异性和时间依赖性,这一问题近年来引起了学者们的关注。Sato等[26]结合高通量转录组学和代谢组学分析,观察到小鼠在不同昼夜时间运动条件下骨骼肌代谢应答的不同反应。在活动期和静息期早期,HIF-α 以昼夜节律的方式被选择性激活,导致糖酵解、脂质氧化及氨基酸分解的不同变化和系统能量消耗的适应。这不仅表明运动昼夜时间影响骨骼肌代谢和转录组表达,也提示将底物代谢与运动时间相同步可能有助于调节骨骼肌代谢应答和全身能量平衡[26]。对此,相关研究[32]发现,相较于上午,下午进行的短期高强度间歇训练更有效地改善了T2DM患者的血糖控制能力。此外,定时运动在心血管疾病中兼具潜在的治疗功能,由于人类的血液动力学和交感/副交感神经系统受骨骼肌分子钟的调控,导致个体罹患心血管疾病的风险在晨时更高,为降低高血压患者的动态血压,学者们[33]建议在下午或傍晚进行锻炼。此外,如何将运动昼夜时间与其他心血管疾病风险标志物(肌酸激酶和C反应蛋白等)的昼夜振荡相同步,从而最大限度地维持长期心脏代谢健康,也是需要重点关注的问题。
值得注意的是,诱导骨骼肌昼夜节律变化的环境线索可能与机体“进食状态”有关,BMAL1基因表达因进食而改变,而分子时钟稳定环路中 REV-ERBα 的表达受到“饥饿”的影响,故评估运动昼夜时间和心血管代谢相互作用的一个关键因素是“进食状态”的差异。Reynolds等[32]发现,对于降低T2DM患者血糖,餐后10 min的步行较一天中30 min非特异性时间的步行更有效。Sasaki等[100]发现,午间进食+夜间运动较早上运动+午间/晚间进食降低了高脂饲养小鼠体质量的增加速度。这都提示,作为介导骨骼肌昼夜节律的另一个强有力的ZT,提高对进食模式与运动昼夜时间相互作用的认识对于更好地理解骨骼肌代谢调节至关重要。运动昼夜时间和饮食之间具有显著的交互作用,蛋白质等营养摄入的增加会改变血源性底物含量及其昼夜振荡反应,导致骨骼肌细胞能量储存模式发生改变[101];骨骼肌的能量状态又反作用于不同运动昼夜时间的燃料利用模式,并影响时钟控制基因的表达和分子信号传导的急性调节过程[26,102-104]。虽然普遍认为,运动训练的适应性是由连续运动后编码各种蛋白质的基因转录物瞬时增加的累积引起的[104],但骨骼肌分子钟在其中如何发挥作用仍是一个未知数。
可见,体育锻炼可在昼夜节律紊乱模型中重新设置时钟从而达到促进健康的目的,而理解运动和骨骼肌分子钟相互作用方式只是探索肌肉运动能力的时间调节机制的前提,当该机制被完整阐述时就可以将其代入更多模型中,如机体的衰老与骨骼肌分子钟的周期和振幅有关[105],提示体育锻炼作为昼夜节律起搏器可能为延缓老化提供新的分子路径。此外,尽管定时运动可为骨骼肌相关病理提供靶向干预,但应慎重对待“选择一天中的最佳训练时间以获得最佳健康效益”这样的建议[104],而应将个体的日常时型、基础生理节律及身体健康状况都考虑在内。
4. 结束语
昼夜节律紊乱的相关病理已被证明是外源性行为模式和骨骼肌内源性分子钟失同步的结果。作为一种非光性ZT,身体活动的行为结果在过去常被作为昼夜节律变化的“输出指标”,而最近的体内和体外模型都已证实体育锻炼可以作用于骨骼肌昼夜节律系统并产生特定的增幅和相移效应,这为进一步研究骨骼肌、昼夜节律相关病理和运动之间的复杂关联提供了理论依据。
目前相关研究尚存在一些问题:①运动干预在跨物种间的转化是昼夜节律研究领域的一个常见现象,如将研究结果从夜间小鼠转化到昼间人类中,然而啮齿类动物骨骼肌核心时钟基因的相位和节律与人类差9 h左右(并不是12 h),所以用其推测人类的昼夜节律存在一定的局限性;②很多研究在进行运动干预时,没有控制日光和进食模式等其他ZT,很难界定体育锻炼介导骨骼肌昼夜节律的一些生理效益是其特有的;③体育锻炼是一个综合性变量,除了运动昼夜时间外,运动剂量和运动方式对骨骼肌分子钟的介导机制尚不清楚,这不利于之后为昼夜节律紊乱人群开具运动处方。
体育锻炼已被证明是一种强有力的环境钟,全面阐述骨骼肌的昼夜节律以及体育锻炼对其的夹带效果将有助于为骨骼肌相关病理提供运动靶点。同时,将运动和营养干预与分子钟同步也会最大限度地发挥体育锻炼对全身健康的促进作用。未来研究应深入探究体育锻炼的授时途径、运动剂量,以及其如何与其他ZT产生交互作用,以期为相关疾病和肌肉运动能力的时间调节机制提供参考。
作者贡献声明:刘恒旭:提出论文选题,收集资料,设计论文结构,撰写论文;作者贡献声明:陈佩杰、卢文云:把控论文质量;作者贡献声明:赵虹、尹静:收集相关文献资料;作者贡献声明:罗炯:把控论文质量,指导修改论文。 -
表 1 体育锻炼诱导骨骼肌时钟基因表达
Table 1 List of clock gene expression in skeletal muscle induced by physical exercise
文献信息 研究对象 实验设计 研究结果 Wolff等[7](2012) 33只PER2::LUC小鼠(23只雄性、10只雌性) 运动组:小鼠分别在光照和黑暗条件下保持12 h,之后在光照条件下进行跑步机和轮跑运动2 h,持续4周;对照组:维持日常活动 相比于对照组,跑步机组和轮跑组小鼠比目鱼肌中PER2::LUC发光节律分别提前了约3 h和2 h,在肺部均提前约2 h,在SCN中未发生相移 Kemler等[45](2020) 30只PER2::LUC小鼠(雌性) 分别在一天中的ZT5、ZT11、ZT17阶段对小鼠进行跑步机干预(60 min/次,3次/d) ZT5阶段的运动诱导了小鼠骨骼肌PER2蛋白表达,相位提前约100 min;ZT11阶段的运动导致相位延迟约62 min;ZT17阶段运动无明显的相移 Yeung等[38](2019) 10名健康、中等体力活动水平男性 运动组:单侧非固定腿训练,踢腿35次/min,共60 min;对照组:另一条腿固定不动 与非运动腿和基线相比,干预后3个时间点(2 h、6 h和26 h)的髌骨肌腱活检中均无法检测到BMAL1、CRY1、PER2或NR1D1蛋白表达的显著差异 Small等[37](2020) 15名年轻健康男性 15 min功率自行车训练(80%VO2max) 急性运动后,骨骼肌PER1和PER2的蛋白表达较运动前显著增加约1.5倍,而NR1D1的蛋白表达有所降低,ARNTL和CRY1的表达较干预前无显著变化 Saracino等[46](2019) 12周龄的雄性REDD1−/−小鼠 运动组A:10 min热身+50 min跑步机训练;运动组B:100 Hz、1A的恒定电流刺激小鼠胫骨前肌,模拟强离心收缩;对照组:维持日常活动 相较于对照组,运动组B小鼠胫骨前肌BMAL1的mRNA表达显著增加,但PER1~3 mRNA水平未改变;运动组A小鼠胫骨前肌PER1的mRNA水平显著增加,PER3和BMAL1的表达未改变 -
[1] ASCHOFF J. Die 24-stunden-periodik der maus unter konstanten umgebungsbedingungen[J]. Naturwissenschaften,1951,38(21):506-507 doi: 10.1007/BF00628863
[2] GRECO C M,SASSONE-CORSI P. Circadian blueprint of metabolic pathways in the brain[J]. Nature Reviews Neuroscience,2019,20(2):71-82 doi: 10.1038/s41583-018-0096-y
[3] HONMA K,HONMA S,WADA T. Entrainment of human circadian rhythms by artificial bright light cycles[J]. Experientia,1987,43(5):572-574
[4] 闫银弟,罗旭光,杨艳萍,等.骨骼肌昼夜节律分子钟机制的研究进展[J]. 实用医学杂志,2018,34(7):1213-1215 doi: 10.3969/j.issn.1006-5725.2018.07.041 [5] KALSBEEK A,PALM I F,LA FLEUR S E,et al. SCN outputs and the hypothalamic balance of life[J]. Journal of Biological Rhythms,2006,21(6):458-469
[6] GERY S,KOEFFLER H P. The role of circadian regulation in cancer[J]. Cold Spring Harbor Symposia on Quantitative Biology,2007,72:459-464 doi: 10.1101/sqb.2007.72.004
[7] WOLFF G,ESSER K A. Scheduled exercise phase shifts the circadian clock in skeletal muscle[J]. Medicine & Science in Sports & Exercise,2012,44(9):1663-1670
[8] SCHROEDER A M,TRUONG D,LOH D H,et al. Voluntary scheduled exercise alters diurnal rhythms of behaviour,physiology and gene expression in wild-type and vasoactive intestinal peptide-deficient mice[J]. The Journal of Physiology,2012,590(23):6213-6226
[9] TAKAHASHI J S. Transcriptional architecture of the mammalian circadian clock[J]. Nat Rev Genet,2017,18(3):164-179 doi: 10.1038/nrg.2016.150
[10] BASS J,TAKAHASHI J S. Circadian integration of metabolism and energetics[J]. Science,2010,330(6009):1349-1354 doi: 10.1126/science.1195027
[11] CRNKO S,DU PRÉ B C,SLUIJTER J P G,et al. Circadian rhythms and the molecular clock in cardiovascular biology and disease[J]. Nature Reviews Cardiology,2019,16(7):437-447 doi: 10.1038/s41569-019-0167-4
[12] 黄增浩,康良,胡毓诗,等.骨骼肌时钟基因与生理功能及活动研究进展[J]. 中国运动医学杂志,2020,39(8):644-648 doi: 10.3969/j.issn.1000-6710.2020.08.009 [13] CHA H K,CHUNG S,LIM H Y,et al. Small molecule modulators of the circadian molecular clock with implications for neuropsychiatric diseases[J]. Frontiers in Molecular Neuroscience,2019,11:496 doi: 10.3389/fnmol.2018.00496
[14] HARFMANN B D,SCHRODER E A,ESSER K A. Circadian rhythms,the molecular clock,and skeletal muscle[J]. Journal of Biological Rhythms,2015,30(2):84-94 doi: 10.1177/0748730414561638
[15] KOIKE N,YOO S H,HUANG H C,et al. Transcriptional architecture and chromatin landscape of the core circadian clock in mammals[J]. Science,2012,338(6105):349-354 doi: 10.1126/science.1226339
[16] ZHANG R,LAHENS N F,BALLANCE H I,et al. A circadian gene expression atlas in mammals:Implications for biology and medicine[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(45):16219-16224 doi: 10.1073/pnas.1408886111
[17] 陈远连,宋伦.生物钟对骨骼肌功能调节作用的研究进展[J]. 军事医学,2019,43(4):305-308 [18] 罗敦雄,陈长淦,杨伟镇,等.昼夜节律调控骨骼肌细胞的研究现状[J]. 中国临床药理学杂志,2020,36(4):462-465 [19] PERRIN L,LOIZIDES-MANGOLD U,CHANON S,et al. Transcriptomic analyses reveal rhythmic and CLOCK-driven pathways in human skeletal muscle[J]. Elife,2018,7:e34114 doi: 10.7554/eLife.34114
[20] PIZARRO A,HAYER K,LAHENS N F,et al. CircaDB:A database of mammalian circadian gene expression profiles[J]. Nucleic Acids Research,2013,41:1009-1013
[21] MCCARTHY J J,ANDREWS J L,MCDEARMON E L,et al. Identification of the circadian transcriptome in adult mouse skeletal muscle[J]. Physiological Genomics,2007,31(1):86-95 doi: 10.1152/physiolgenomics.00066.2007
[22] DEBOER T. Sleep homeostasis and the circadian clock: Do the circadian pacemaker and the sleep homeostat influence each other's functioning?[J]. Neurobiology of Sleep and Circadian Rhythms,2018,5:68-77 doi: 10.1016/j.nbscr.2018.02.003
[23] CHO H,ZHAO X,HATORI M,et al. Regulation of circadian behaviour and metabolism by REV-ERB-α and REV-ERB-β[J]. Nature,2012,485(7396):123-127 doi: 10.1038/nature11048
[24] GABRIEL B M,ZIERATH J R. Circadian rhythms and exercise:Re-setting the clock in metabolic disease[J]. Nature Reviews Endocrinology,2019,15(4):197-206 doi: 10.1038/s41574-018-0150-x
[25] STEIDLE-KLOC E,SCHÖNFELDER M,MÜLLER E,et al. Does exercise training impact clock genes in patients with coronary artery disease and type 2 diabetes mellitus?[J]. European Journal of Preventive Cardiology,2016,23(13):1375-1382 doi: 10.1177/2047487316639682
[26] SATO S,BASSE A L,SCHÖNKE M,et al. Time of exercise specifies the impact on muscle metabolic pathways and systemic energy homeostasis[J]. Cell Metabolism,2019,30(1):92-110 doi: 10.1016/j.cmet.2019.03.013
[27] PASTORE S,HOOD D A. Endurance training ameliorates the metabolic and performance characteristics of circadian clock mutant mice[J]. Journal of Applied Physiology,2013,114(8):1076-1084 doi: 10.1152/japplphysiol.01505.2012
[28] HEDEN T D,WINN N C,MARI A,et al. Postdinner resistance exercise improves postprandial risk factors more effectively than predinner resistance exercise in patients with type 2 diabetes[J]. Journal of Applied Physiology,2015,118(5):624-634 doi: 10.1152/japplphysiol.00917.2014
[29] SASAKI H,HATTORI Y,IKEDA Y,et al. Forced rather than voluntary exercise entrains peripheral clocks via a corticosterone/noradrenaline increase in PER2::LUC mice[J]. Scientific Reports,2016,6(1):959-975
[30] KÜÜSMAA M,SCHUMANN M,SEDLIAK M,et al. Effects of morning versus evening combined strength and endurance training on physical performance, muscle hypertrophy,and serum hormone concentrations[J]. Applied Physiology Nutrition & Metabolism,2016,41(12):1285-1294
[31] THOMAS J M,KERN P A,BUSH H M,et al. Circadian rhythm phase shifts caused by timed exercise vary with chronotype[J]. JCI Insight,2020,5(3):e134270 doi: 10.1172/jci.insight.134270
[32] REYNOLDS A N,MANN J I,WILLIAMS S,et al. Advice to walk after meals is more effective for lowering postprandial glycaemia in type 2 diabetes mellitus than advice that does not specify timing:A randomised crossover study[J]. Diabetologia,2016,59(12):2572-2578 doi: 10.1007/s00125-016-4085-2
[33] SCHEER F A J L,HU K,EVONIUK H,et al. Impact of the human circadian system,exercise,and their interaction on cardiovascular function[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(47):20541-20546 doi: 10.1073/pnas.1006749107
[34] ZAMBON A C,MCDEARMON E L,SALOMONIS N,et al. Time-and exercise-dependent gene regulation in human skeletal muscle[J]. Genome Biology,2003,4(10):R61 doi: 10.1186/gb-2003-4-10-r61
[35] MILLER B H,MCDEARMON E L,PANDA S,et al. Circadian and CLOCK-controlled regulation of the mouse transcriptome and cell proliferation[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(9):3342-3347 doi: 10.1073/pnas.0611724104
[36] NAKAO R,YAMAMOTO S,HORIKAWA K,et al. Atypical expression of circadian clock genes in denervated mouse skeletal muscle[J]. Chronobiology International,2015,32(4):486-496 doi: 10.3109/07420528.2014.1003350
[37] SMALL L,ALTNTAŞ A,LAKER R C,et al. Contraction influences Per2 gene expression in skeletal muscle through a calcium-dependent pathway[J]. The Journal of Physiology,2020,598(24):5739-5752 doi: 10.1113/JP280428
[38] YEUNG C C,SCHJERLING P,HEINEMEIER K M,et al. Investigating circadian clock gene expression in human tendon biopsies from acute exercise and immobilization studies[J]. European Journal of Applied Physiology,2019,119(6):1387-1394 doi: 10.1007/s00421-019-04129-2
[39] BAE K,LEE K,SEO Y,et al. Differential effects of two period genes on the physiology and proteomic profiles of mouse anterior tibialis muscles[J]. Molecules and Cells,2006,22(3):275-284
[40] PIRCHER P,CHOMEZ P,YU F,et al. Aberrant expression of myosin isoforms in skeletal muscles from mice lacking the rev-erbAalpha orphan receptor gene[J]. American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2005,288(2):482-490 doi: 10.1152/ajpregu.00690.2003
[41] HANSEN J,TIMMERS S,MOONEN-KORNIPS E,et al. Synchronized human skeletal myotubes of lean, obese and type 2 diabetic patients maintain circadian oscillation of clock genes[J]. Scientific Reports,2016,6(6):1-12
[42] YAMANAKA Y,HONMA S,HONMA K I. Scheduled exposures to a novel environment with a running-wheel differentially accelerate re-entrainment of mice peripheral clocks to new light-dark cycles[J]. Genes to Cells,2008,13(5):497-507 doi: 10.1111/j.1365-2443.2008.01183.x
[43] EDGAR D M,DEMENT W C. Regularly scheduled voluntary exercise synchronizes the mouse circadian clock[J]. The American Journal of Physiology,1991,261(4 Pt 2):928-933
[44] MARCHANT E G,MISTLBERGER R E. Entrainment and phase shifting of circadian rhythms in mice by forced treadmill running[J]. Physiology & Behavior,1996,60(2):657-663
[45] KEMLER D,WOLFF C A,ESSER K A. Time-of-day dependent effects of contractile activity on the phase of the skeletal muscle clock[J]. The Journal of Physiology,2020,598(17):3631-3644
[46] SARACINO P G,ROSSETTI M L,STEINER J L,et al. Hormonal regulation of core clock gene expression in skeletal muscle following acute aerobic exercise[J]. Biochemical and Biophysical Research Communications,2019,508(3):871-876
[47] BUXTON O M,FRANK S A,L'HERMITE-BALÉRIAUX M,et al. Roles of intensity and duration of nocturnal exercise in causing phase delays of human circadian rhythms[J]. The American Journal of Physiology,1997,273(3 Pt 1):536-542
[48] BUXTON O M,LEE C W,L'HERMITE-BALERIAUX M,et al. Exercise elicits phase shifts and acute alterations of melatonin that vary with circadian phase[J]. American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2003,284(3):714-724
[49] MONTARULI A,ROVEDA E,CALOGIURI G,et al. The sportsman readjustment after transcontinental flight:A study on marathon runners[J]. The Journal of Sports Medicine and Physical Fitness,2009,49(4):372-381
[50] YAMANAKA Y,HASHIMOTO S,TAKASU N N,et al. Morning and evening physical exercise differentially regulate the autonomic nervous system during nocturnal sleep in humans[J]. American Journal of Physiology. Regulatory,Integrative & Comparative Physiology,2015,309(9):R1112-R1121
[51] HAWLEY J A,HARGREAVES M,JOYNER M J,et al. Integrative biology of exercise[J]. Cell,2014,159(4):738-749 doi: 10.1016/j.cell.2014.10.029
[52] VAN SOMEREN E J. Thermosensitivity of the circadian timing system[J]. Sleep & Biological Rhythms,2003,1(1):55-64
[53] WEINERT D,WATERHOUSE J. The circadian rhythm of core temperature:Effects of physical activity and aging[J]. Physiology & Behavior,2007,90(2-3):246-256
[54] 康杰,刘畅.生物节律与运动表现[J]. 体育科研,2020,41(2):1-17 doi: 10.12064/ssr.20200201 [55] 董毅.生物节律与运动[J]. 中国体育科技,2019,55(4):22-30 [56] VON GALL C,WEAVER D R,MOEK J,et al. Melatonin plays a crucial role in the regulation of rhythmic clock gene expression in the mouse pars tuberalis[J]. Annals of the New York Academy of Sciences,2005,1040:508-511
[57] AGEZ L,LAURENT V,PÉVET P,et al. Melatonin affects nuclear orphan receptors mRNA in the rat suprachiasmatic nuclei[J]. Neuroscience,2007,144(2):522-530 doi: 10.1016/j.neuroscience.2006.09.030
[58] VRIEND J,REITER R J. Melatonin feedback on clock genes:A theory involving the proteasome[J]. Journal of Pineal Research,2015,58(1):1-11 doi: 10.1111/jpi.12189
[59] BESSOT N. Effects of physical activity on circadian rhythms in the elderly[M]//JAZWINSKI S M, BELANCIO V P, HILL S M. Circadian rhythms and their impact on aging. Cham: Springer, 2017: 323-335
[60] ATKINSON G,DRUST B,REILLY T,et al. The relevance of melatonin to sports medicine and science[J]. Sports Medicine (Auckland, N. Z.),2003,33(11):809-831 doi: 10.2165/00007256-200333110-00003
[61] HARBIN G,DURST L,HARBIN D. Evaluation of oculomotor response in relationship to sports performance[J]. Medicine & Science in Sports & Exercise,1989,21(3):258-262
[62] TISCHKAU S A,MITCHELL J W,TYAN S H,et al. Ca2+/cAMP response element-binding protein (CREB)-dependent activation of Per1 is required for light-induced signaling in the suprachiasmatic nucleus circadian clock[J]. Journal of Biological Chemistry,2003,278(2):718-723 doi: 10.1074/jbc.M209241200
[63] PULIVARTHY S R,TANAKA N,WELSH D K,et al. Reciprocity between phase shifts and amplitude changes in the mammalian circadian clock[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(51):20356-20361 doi: 10.1073/pnas.0708877104
[64] WOLFF C A,ESSER K A. Exercise timing and circadian rhythms[J]. Current Opinion in Physiology,2019,10:64-69 doi: 10.1016/j.cophys.2019.04.020
[65] LAMIA K A,SACHDEVA U M,DITACCHIO L,et al. AMPK regulates the circadian clock by cryptochrome phosphorylation and degradation[J]. Science,2009,326(5951):437-440 doi: 10.1126/science.1172156
[66] UM J H,PENDERGAST J S,SPRINGER D A,et al. AMPK regulates circadian rhythms in a tissue- and isoform-specific manner[J]. PLoS One,2011,6(3):e18450 doi: 10.1371/journal.pone.0018450
[67] 陈卓颖,杨盛力,柳湘洁.生物钟与缺氧诱导因子在肿瘤领域的相关性[J]. 临床与病理杂志,2019,39(1):152-158 doi: 10.3978/j.issn.2095-6959.2019.01.024 [68] GHORBEL M T,COULSON J M,MURPHY D. Cross-talk between hypoxic and circadian pathways: Cooperative roles for hypoxia-inducible factor 1α and CLOCK in transcriptional activation of the vasopressin gene[J]. Molecular & Cellular Neuroscience,2003,22(3):396-404
[69] SATO F,BHAWAL U K,YOSHIMURA T,et al. DEC1 and DEC2 crosstalk between circadian rhythm and tumor progression[J]. Journal of Cancer,2016,7(2):153-159 doi: 10.7150/jca.13748
[70] 邓红,徐晓阳,张卫.不同运动方式对肥胖大鼠骨骼肌PGC-1α/FNDC5/PPARγ信号通路的影响[J]. 体育科学,2019,39(3):74-80 [71] LIU C,LI S,LIU T,et al. Transcriptional coactivator PGC-1alpha integrates the mammalian clock and energy metabolism[J]. Nature,2007,447(7143):477-481 doi: 10.1038/nature05767
[72] GORDON B S,STEINER J L,LANG C H,et al. Reduced REDD1 expression contributes to activation of mTORC1 following electrically induced muscle contraction[J]. American Journal of Physiology. Endocrinology and Metabolism,2014,307(8):E703-E711 doi: 10.1152/ajpendo.00250.2014
[73] ZHANG X P,DUBE T J,ESSER K A. Working around the clock:Circadian rhythms and skeletal muscle[J]. Journal of Applied Physiology,2009,107(5):1647-1654 doi: 10.1152/japplphysiol.00725.2009
[74] MARCHEVA B,RAMSEY K M,PEEK C B,et al. Circadian clocks and metabolism[J]. Handbook of Experimental Pharmacology,2013(217):127-155
[75] RUDIC R D,MCNAMARA P,CURTIS A M,et al. BMAL1 and CLOCK,two essential components of the circadian clock,are involved in Glucose homeostasis[J]. PLoS Biology,2004,2(11):e377 doi: 10.1371/journal.pbio.0020377
[76] ANDREWS J L,ZHANG X P,MCCARTHY J J,et al. CLOCK and BMAL1 regulate MyoD and are necessary for maintenance of skeletal muscle phenotype and function[J]. PNAS,2010,107(44):19090-19095
[77] MAYEUF-LOUCHART A,THOREL Q,DELHAYE S,et al. Rev-erb-α regulates atrophy-related genes to control skeletal muscle mass[J]. Scientific Reports,2017,7(1):14383 doi: 10.1038/s41598-017-14596-2
[78] VITALE J A,BONATO M,LA TORRE A,et al. The role of the molecular clock in promoting skeletal muscle growth and protecting against sarcopenia[J]. International Journal of Molecular Sciences,2019,20(17):4318 doi: 10.3390/ijms20174318
[79] SCHIAFFINO S,DYAR K A,CICILIOT S,et al. Mechanisms regulating skeletal muscle growth and atrophy[J]. The FEBS Journal,2013,280(17):4294-4314 doi: 10.1111/febs.12253
[80] PHILLIPS S M,TIPTON K D,AARSLAND A,et al. Mixed muscle protein synthesis and breakdown after resistance exercise in humans[J]. Am J Physiol,1997,273(1):99-107
[81] ZBIDI S,ZINOUBI B,VANDEWALLE H,et al. Diurnal rhythm of muscular strength depends on temporal specificity of self-resistance training[J]. Journal of Strength and Conditioning Research,2016,30(3):717-724
[82] ZHANG H,LIANG L,CHEN N. Do not neglect the role of circadian rhythm in muscle atrophy[J]. Ageing Research Reviews,2020,63:101155
[83] SEDLIAK M,ZEMAN M,BUZGÓ G,et al. Morphological,molecular and hormonal adaptations to early morning versus afternoon resistance training[J]. Chronobiology International,2018,35(4):450-464 doi: 10.1080/07420528.2017.1411360
[84] ROSSETTI M L,STEINER J L,GORDON B S. Increased mitochondrial turnover in the skeletal muscle of fasted,castrated mice is related to the magnitude of autophagy activation and muscle atrophy[J]. Molecular and Cellular Endocrinology,2018,473:178-185
[85] WOLDT E,SEBTI Y,SOLT L A,et al. Rev-erb-α modulates skeletal muscle oxidative capacity by regulating mitochondrial biogenesis and autophagy.[J]. Nature Medicine,2013,19(8):1039-1046 doi: 10.1038/nm.3213
[86] VAN MOORSEL D,HANSEN J,HAVEKES B,et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity[J]. Molecular Metabolism,2016,5(8):635-645 doi: 10.1016/j.molmet.2016.06.012
[87] CHENG P,DRAKE C L. Psychological impact of shift work[J]. Current Sleep Medicine Reports,2018,4(2):104-109 doi: 10.1007/s40675-018-0114-7
[88] ALTERMAN T,LUCKHAUPT S E,DAHLHAMER J M,et al. Prevalence rates of work organization characteristics among workers in the U.S.:Data from the 2010 National Health Interview Survey[J]. American Journal of Industrial Medicine,2013,56(6):647-659 doi: 10.1002/ajim.22108
[89] LAPOSKY A,EASTON A,DUGOVIC C,et al. Deletion of the mammalian circadian clock gene BMAL1/Mop3 alters baseline sleep architecture and the response to sleep deprivation[J]. Sleep,2005,28(4):395-410 doi: 10.1093/sleep/28.4.395
[90] CAO Q,ZHAO X,BAI J W,et al. Circadian clock cryptochrome proteins regulate autoimmunity[J]. Proceedings of the National Academy of Sciences of the United States of America,2017,114(47):12548-12553 doi: 10.1073/pnas.1619119114
[91] MIYAZAKI T,HASHIMOTO S,MASUBUCHI S,et al. Phase-advance shifts of human circadian pacemaker are accelerated by daytime physical exercise[J]. American Journal of Physiology. Regulatory,Integrative and Comparative Physiology,2001,281(1):R197-R205 doi: 10.1152/ajpregu.2001.281.1.R197
[92] EASTMAN C I,HOESE E K,YOUNGSTEDT S D,et al. Phase-shifting human circadian rhythms with exercise during the night shift[J]. Physiology & Behavior,1995,58(6):1287-1291
[93] ATKINSON G,COLDWELLS A,REILLY T,et al. A comparison of circadian rhythms in work performance between physically active and inactive subjects[J]. Ergonomics,1993,36(1-3):273-281 doi: 10.1080/00140139308967882
[94] VAN SOMEREN E J,LIJZENGA C,MIRMIRAN M, et al. Long-term fitness training improves the circadian rest-activity rhythm in healthy elderly males[J]. Journal of Biological Rhythms,1997,12(2):146-156 doi: 10.1177/074873049701200206
[95] FIGUEIRO M G,STEVERSON B,HEERWAGEN J, et al. The impact of daytime light exposures on sleep and mood in office workers[J]. Sleep Health,2017,3(3):204-215
[96] DYAR K A,CICILIOT S,WRIGHT L E,et al. Muscle insulin sensitivity and glucose metabolism are controlled by the intrinsic muscle clock[J]. Molecular Metabolism,2014,3(1):29-41 doi: 10.1016/j.molmet.2013.10.005
[97] WADA T,ICHIHASHI Y,SUZUKI E,et al. Deletion of Bmal1 prevents diet-induced ectopic fat accumulation by controlling oxidative capacity in the skeletal muscle[J]. International Journal of Molecular Sciences,2018,19(9):2813 doi: 10.3390/ijms19092813
[98] DUEZ H,STAELS B. The nuclear receptors Rev-erbs and RORs integrate circadian rhythms and metabolism[J]. Diabetes & Vascular Disease Research,2008,5(2):82-88
[99] YIN L,WU N,LAZAR M A. Nuclear receptor Rev-erbalpha:A heme receptor that coordinates circadian rhythm and metabolism[J]. Nuclear Receptor Signaling,2010,8:1-6
[100] SASAKI H,OHTSU T,IKEDA Y,et al. Combination of meal and exercise timing with a high-fat diet influences energy expenditure and obesity in mice[J]. Chronobiology International,2014,31(9):959-975 doi: 10.3109/07420528.2014.935785
[101] HAWLEY J A,BURKE L M,PHILLIPS S M,et al. Nutritional modulation of training-induced skeletal muscle adaptations[J]. Appl Physiol,2011,110(3):834-845
[102] KROGH A,LINDHARD J. The relative value of fat and carbohydrate as sources of muscular energy:With appendices on the correlation between standard metabolism and the respiratory quotient during rest and work[J]. Biochem J,1920,14(3-4):290-363
[103] WOJTASZEWSKI J F P,MACDONALD C,NIELSEN J N,et al. Regulation of 5'AMP-activated protein kinase activity and substrate utilization in exercising human skeletal muscle[J]. Am J Physiol Endocrinol Metab,2003,284(4):813-822
[104] PARR E B,HEILBRONN L K,HAWLEY J A. A time to eat and a time to exercise[J]. Exercise and Sport Sciences Reviews,2020,48(1):4-10 doi: 10.1249/JES.0000000000000207
[105] ZWIGHAFT Z,AVIRAM R,SHALEV M,et al. Circadian clock control by polyamine levels through a mechanism that declines with age[J]. Cell Metabolism,2015,22(5):874-885 doi: 10.1016/j.cmet.2015.09.011
-
期刊类型引用(11)
1. 吴进,杨宇航,李利强,孙有平. 隐忧与消解:中国儿童青少年身体活动促进的时空社会学审视. 成都体育学院学报. 2024(02): 9-15+25 .  百度学术
百度学术
2. 郑李,朱琳,葛小菲. 基于GT3X的儿童青少年身体活动研究综述. 体育科技文献通报. 2023(04): 182-187 .  百度学术
百度学术
3. 吕和武,王瑞. 论紧凑城市理念下全民健身与全民健康深度融合. 体育文化导刊. 2023(07): 32-39 .  百度学术
百度学术
4. 张健,孙辉,张建华,蔡峰,李婷文,马洁璟. 我国儿童青少年身体活动研究特征的系统性审思及启示(之一). 哈尔滨体育学院学报. 2022(04): 11-21 .  百度学术
百度学术
5. 王厚雷,朱建勇,王竹影,张怡. 城市社区老年人户外体力活动空间特征——基于GPS与加速度计的实证研究. 中国老年学杂志. 2022(14): 3602-3606 .  百度学术
百度学术
6. 张健,孙辉,张建华,蔡峰,李婷文,陈明洁. 特征、热点、问题与启示:中国儿童青少年身体活动研究系统性审思(之二). 哈尔滨体育学院学报. 2022(06): 1-9 .  百度学术
百度学术
7. 田广,郭敏. 基于DEA-Tobit模型的中国大型体育场馆投入产出效率评价及影响因素研究. 成都体育学院学报. 2021(04): 86-92 .  百度学术
百度学术
8. 张曌华,张柳,李红娟. 中国儿童青少年体力活动现状的Meta分析. 中国学校卫生. 2020(02): 173-178 .  百度学术
百度学术
9. 黄馨缘,吴佳昱,吴倩,张莉,余登来,顾春华,王静,林涛. 上海市浦东新区常住居民健康素养与吸烟、饮酒、身体活动的关系. 环境与职业医学. 2019(09): 847-852 .  百度学术
百度学术
10. 程志理,闫士展. 体育学术期刊发展研究报告(2014~2018)——学术热点与演进规律的可视化分析. 体育与科学. 2019(06): 14-25 .  百度学术
百度学术
11. 张丹青,路瑛丽,刘阳. 身体活动和静态生活方式的影响因素——基于我国儿童青少年的系统综述. 体育科学. 2019(12): 62-75 .  百度学术
百度学术
其他类型引用(24)



 下载:
下载: