Exercise Response and Gut Microbiota Metabolism in Patients with Type 2 Diabetes: Relationship Exploration and Mechanism Inference
-
摘要:目的
对比有无运动响应的T2DM患者肠道菌群及其相关粪代谢物特征,探究患者运动响应与肠道菌群代谢间的关系,推断其影响机制。
方法随机招募16名T2DM患者,采用自身前后对照实验设计,进行为期6周的高强度间歇运动干预。提前3周收集受试者HOMA-IR数据并计算典型误差,基于此将受试者分为运动响应组(R组,n=9)与运动不响应组(NR组,n=7),对比2组受试者的肠道菌群特征与粪代谢差异。
结果①干预后R组α多样性出现升高,显著高于NR组。②R组菌群关系更复杂、稳定,其关系网络特征在干预后进一步增强。③2组优势菌群差异显著,R组主要包含克里斯滕森菌、青春双歧杆菌等,NR组主要包含韦荣氏球菌、大芬戈尔德菌等;组内的显著差异仅在R组中出现,主要包含瘤胃球菌、芽孢杆菌等。④R组优势菌群的关联代谢物主要包含花生四烯酸、正缬氨酸等;NR组优势菌群的关联代谢物主要包含L-谷氨酸、2-乙基乙酸等。
结论T2DM患者的运动响应与其肠道微生态联系密切。运动响应者肠道微生态更为稳定,包含更多与糖脂代谢、胰岛素代谢、肠道炎症改善正相关的优势菌群,这些菌群的丰度变化可能是运动响应的重要原因。
Abstract:ObjectivesTo compare the gut microbiota and related fecal metabolites between type 2 diabetes mellitus (T2DM) patients with and without exercise response, explore the relationship between exercise response and gut microbiota metabolism, and infer its influence mechanism.
MethodsSixteen T2DM patients were randomly recruited and a self-control experiment was conducted with a 6-week high-intensity interval exercise intervention. HOMA-IR data was collected three weeks in advance and the typical error was calculated to divide the subjects into an exercise response group (R group, n=9) and a non-exercise response group (NR group, n=7), and the gut microbiota and fecal metabolites of the two groups were compared.
Results① After intervention, the α diversity of the R group increased and was significantly higher than that of the NR group. ② The microbial relationship of the R group was more complex and stable, and its network characteristics were further enhanced after intervention. ③ The dominant microbial populations differed significantly between the two groups, with the R group mainly including Christensenellaceae bacterium and Bifidobacterium adolescentic bacterium, and the NR group mainly including Veillonella bacterium and Finegoldiamagna bacterium. The significant differences within the groups were only observed in the R group, mainly including Ruminococcaceae bacterium and Clostridium bacterium. ④ The associated metabolites of the dominant microbial populations in the R group mainly included arachidonic acid and norvaline, while those in the NR group mainly included L-glutamine and 2-ethylhexanoic acid.
ConclusionsThe exercise response of T2DM patients is closely related to their gut microbiota. The gut microbiota of exercise responders is more stable, containing more dominant microbial populations that are positively correlated with sugar and fat metabolism, insulin metabolism, and improvement of intestinal inflammation. The changes in the abundance of these microbial populations may be an important reason for exercise response.
-
人类进行阶段性运动后机体所出现的变化被称为运动响应。在传统意义上,运动响应被用于反映运动能力指标[1-4]和人体测量学指标[4]改变的异质性。目前,伴随诸多疾病防治中运动疗法的普及,运动疗效的异质性也开始显现,运动疗法对核心临床指标的改善被称为疾病人群的运动响应[5]。
2型糖尿病(T2DM)为临床最常见的慢性疾病之一,患者基数大、并发症多,是危害全球公共卫生安全的重大问题[6-8]。对于T2DM患者,血糖紊乱仅为发病表象,胰岛素代谢紊乱才是致病根源,因此反映胰岛素敏感性的胰岛素抵抗指数(HOMA-IR)常被作为判断病情发展的重要指标[9]。运动疗法则可通过改善胰岛β细胞功能、增加其数量来促进胰岛素分泌和提升胰岛素敏感性[10]。现有证据表明,运动疗法对胰岛素敏感性的改善存在异质性[11],6%~69%的糖尿病或肥胖症患者接受运动干预后胰岛素敏感性并未产生有利变化,被称为运动不响应患者[12]。因此,T2DM运动疗法的疗效问题仍是当前研究的重要靶点。
目前研究大多聚焦运动干预方式的疗效差异,对患者自身的运动响应却鲜有关注,微生物组学技术的发展为其提供了全新的解释途径。诸多研究证明,肠道菌群不仅在运动干预T2DM中发挥了重要中介作用[13-17],还独立影响着T2DM的产生与发展[11, 18]。宿主肠道菌群的传统干预以特定饮食或药物补给为主,但外服的益生菌无法在肠道重新定植,疗效短暂[19]。相比之下,运动则能在增强体质的同时持续调节宿主的肠道微生态,并以此改善胰岛细胞功能和炎症反应,帮助控制T2DM。然而,个体间肠道菌群的组成受饮食、生活习惯、体成分和基因等诸多因素的影响而存在普遍差异[20-21],这或许会影响T2DM患者机体对运动的应答,影响运动疗效,导致异质性的出现。本文比较了同种干预下运动响应者与不响应者肠道微生物的种群特征、关系网络、相关代谢物等要素,试图探究并推断T2DM患者的运动响应与其肠道微生态之间的关系。
1. 研究对象与方法
1.1 研究对象
1.1.1 受试者纳入与剔除标准
受试者为16名T2DM患者。所有受试者均提前签署知情同意书,完成基本信息、运动风险筛查问卷以及《国际体力活动量表短问卷》[22],确保其符合纳入标准。同时制定剔除标准,确保实验过程的安全性和实验结果的可靠性。
纳入标准:①符合中华医学会糖尿病分会T2DM诊断标准[23];②1年内病情稳定且未发生糖尿病急性代谢紊乱;③近1个月内血糖稳定且饮食有所控制;④每周运动不高于2次,单次运动时间不超过15 min;⑤每周吸烟不多于10支,近1个月未饮酒;⑥通过运动风险筛查。
剔除标准:①干预期间出现严重不良反应或意外,如晕厥、骨折等,无法继续训练;②干预期间病情出现加重或其他突发事件,需紧急就医治疗;③未按照研究制定的方案接受干预、检查、随访,或由于资料过少不能满足疗效和安全性评价;④研究期间因其他个人原因主动退出。
1.1.2 受试者基本情况
根据受试者的基本问卷与血液检查结果,统计受试者的基本信息,包含性别、年龄、患病年限、空腹血糖(FPG)、空腹胰岛素(FINS)、HOMA-IR以及服药种类。根据运动干预后HOMA-IR变化对受试者进行分组:根据3周前胰岛素抵抗的重复测试结果计算典型误差(Typical Error,TE
$ ={\mathrm{S}\mathrm{D}}_{\mathrm{d}\mathrm{i}\mathrm{f}\mathrm{f}}/\sqrt{2} $ ),根据公式$ \mathrm{H}\mathrm{O}\mathrm{M}\mathrm{A}\text{-} \mathrm{I}\mathrm{R}=(\mathrm{F}\mathrm{P}\mathrm{G}\times \mathrm{F}\mathrm{I}\mathrm{N}\mathrm{S})/22.5 $ 对受试者干预前后HOMA-IR进行计算,以HOMA-IR降低为响应方向,若受试者干预前后HOMA-IR降低量大于2倍TE则将其归入R组,反之则将其归入NR组[24]。在本文中,$ {\mathrm{S}\mathrm{D}}_{\mathrm{d}\mathrm{i}\mathrm{f}\mathrm{f}} $ (HOMA-IR)=0.28,TE=0.2,参照HOMA-IR降低量获得R组(n=9)和NR组(n=7),2组受试者基本信息如表1所示。表 1 受试者基本信息Table 1. Basic information of participants基本信息 NR组 R组 t P 性别(人数) 男(n=4),女(n=3) 男(n=4),女(n=5) 年龄/岁 56.67±5.27 56.71±4.46 0.02 0.985 患病年限 8.33±3.00 8.14±2.54 −0.13 0.895 FPG/(mmol·L−1) 8.86±2.08 8.61±2.70 0.20 0.846 FINS/(μU·mL−1) 11.04±7.71 8.96±5.33 0.64 0.532 HOMA-IR 4.31±3.21 3.67±3.12 0.40 0.695 用药情况 双胍类药物、
格列奈类药物、
预混胰岛素双胍类药物、
格列奈类药物、
长效胰岛素
类似物、GLP-11.2 研究方法
1.2.1 实验法
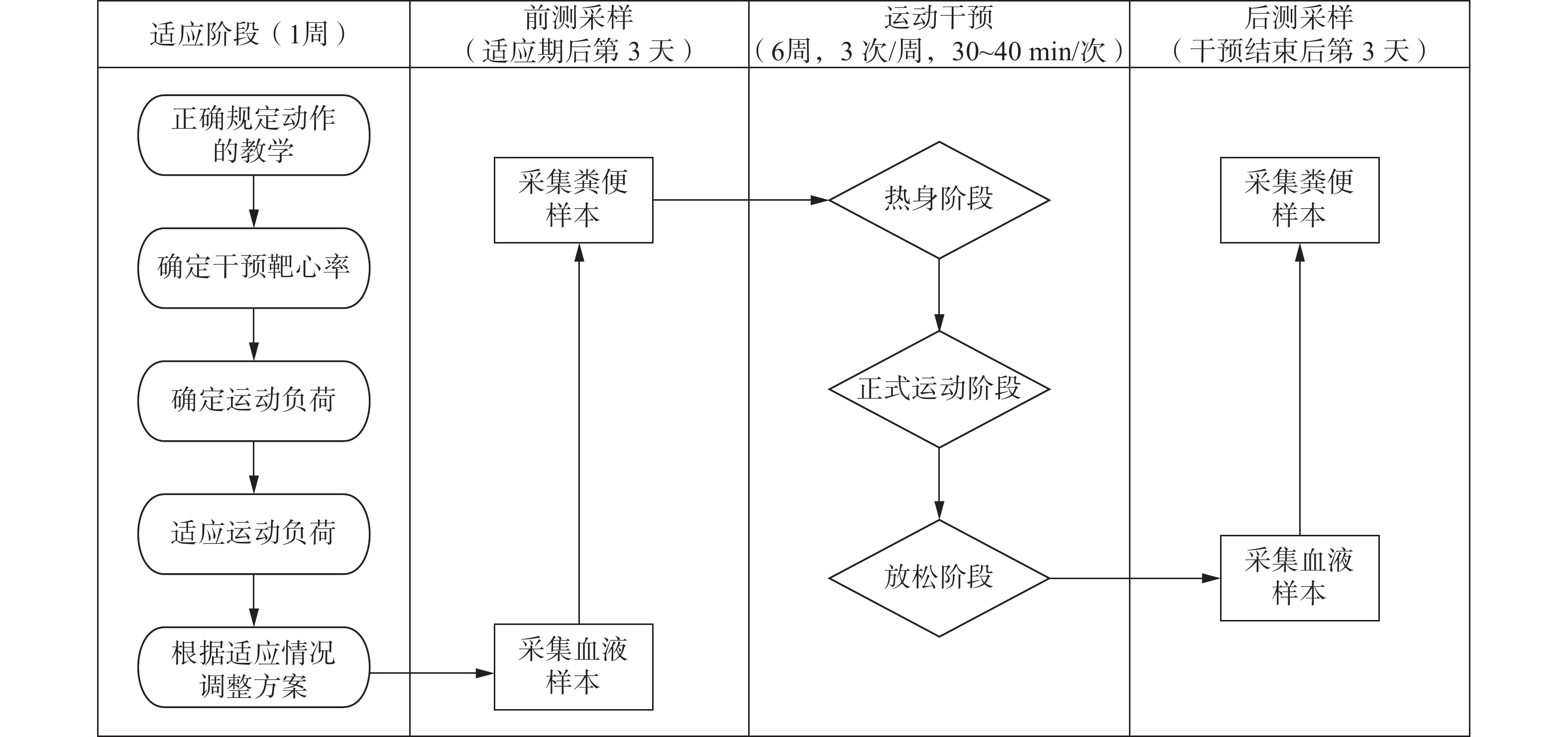
所有受试者均接受6周高强度间歇训练(HIIT)。实验流程主要包含适应阶段与正式干预阶段,在适应阶段结束后第3天清晨进行前测样本收集,包含血液样本与粪便样本。随后进行时长6周、每周3次、每次约35 min的HIIT干预,干预结束后第3天清晨,再次收集受试者血液样本与粪便样本,测定与前测相同的指标。实验期间受试者保持其原有药物服用及饮食起居等生活方式不变,并进行定期线上随访。详细实验流程见图1。
有研究[5, 25]认为,运动强度越大越有利于病情改善。HIIT强度较高、干预效果较好,同时更节省运动时间[26-27]。中长期的HIIT干预在改善T2DM患者血糖控制、心肺功能和降低血管风险方面是安全有效的,效果优于中强度运动,可作为一种有效的T2DM干预手段[28]。《WHO关于身体活动和久坐行为的指南》指出,T2DM患者应尽可能地参与持续性、节律性运动,且以跑跳类运动为宜[29],因此本文以跳绳为主要运动方式。考虑到T2DM患者群体的特殊性且受试者年龄普遍较大,为规避因牵绊导致的训练风险,采用无绳跳绳的方式提升训练安全性。目前针对T2DM患者的HIIT方案总时间大多在8~28 min,训练组数一般在4~8组。通常以心率作为强度监测手段,训练强度通常为70%~95%HRmax,间歇强度通常为50%~60%HRmax,单组训练时间∶间歇时间通常为1∶1、4∶3、2∶1、5∶1等[30-32]。
考虑到患者训练过程中体能的增强,为保证训练强度基本一致,本文训练采用渐进式负荷(表2)。每次干预主要包含8~10 min的准备练习(活动下肢关节,原地踏步热身);16~18 min的正式练习(8组跳绳练习,单组时长90 s,恢复30~45 s,恢复形式随实验阶段变化),全程佩戴心率表监控强度,并在每组训练及间歇结束后询问RPE[33][跳绳心率控制在70%~80% HRmax(HRmax = 220−年龄),RPE为16~19,恢复期心率控制在50%~60%HRmax,RPE为11~15];3~5 min的放松练习(拉伸主要运动肌肉)组成。
表 2 各阶段训练负荷Table 2. Intensity of different stage实验阶段 训练阶段 恢复阶段 1~2周 持续跳绳90 s ×8组 组间主动恢复45 s(原地踏步) 3~4周 持续跳绳90 s×8组 组间被动恢复30 s(原地休息) 5~6周 持续跳绳90 s×8组 组间主动恢复30 s(原地踏步) 1.2.2 指标获取及检测方法
(1)糖代谢指标
糖代谢测试要求受试者提前禁食8 h以上,于次日清晨空腹采集肘部静脉血3~5 mL置于无抗凝剂的试管中,采用葡萄糖氧化酶法检测FPG,采用放射免疫分析法(RIA)检测FINS,并计算HOMA-IR。
(2)肠道菌群及粪便代谢指标
在体检前一天向受试者发放独立密封的粪便采集器、一次性便盆(直径略小于家用马桶)以及无菌保鲜膜,告知受试者于次日清晨排泄前对外阴及肛门区域进行清理,防止尿液或体液污染粪便样本。嘱咐受试者在排便前将无菌保鲜膜贴至无菌便盆表面,随后将其放置于便池或马桶上,进行排便。排便结束后将粪便采集器内小勺插入粪便中段,从新鲜晨便中段内部挖取3~5 g样本放入粪便采集器。随后立即转交实验人员,实验人员将预先准备好的包含受试者及其粪便样本对应信息的标签贴至采集器表面,并用生物冰袋包裹,迅速转移至−80 ℃的冰箱冻存,随后尽快送检。若受试者未能按时采集粪便样本,或粪便样本受到腹泻、肛裂、痔疮破裂等意外情况的污染,则视为不合格样本,不予纳入。
肠道菌群DNA测序流程如下。①DNA 抽提和PCR扩增。根据E.Z.N.A.® soil DNA Kit(Omega Bio-tek, Norcross, GA, 美国)说明书进行微生物群落总 DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度;使用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因V3-V4可变区进行PCR扩增。扩增程序为95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存(PCR仪为ABI GeneAmp® 9700型)。PCR反应体系为5×TransStart FastPfu 缓冲液4 μL,2.5 mMdNTPs 2 μL,上游引物(5 uM) 0.8 μL,下游引物(5 uM)0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,补足至20 μL,每个样本重复3次。②Illumina Miseq测序。将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City, CA, 美国)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™ Fluorometer(Promega, 美国)对回收产物进行检测定量。使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific,美国)进行建库: 接头链接;使用磁珠筛选去除接头自连片段;利用PCR扩增进行文库模板的富集;磁珠回收PCR产物得到最终的文库。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司),原始数据上传至NCBI SRA数据库。③数据处理。使用fastp软件[34](version 0.20.0)对原始测序序列进行质控,使用FLASH软件(version 1.2.7)进行拼接:过滤reads尾部质量值20以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的reads,去除含N碱基的reads;根据PE reads之间的overlap关系,将成对reads拼接(merge)成1条序列,最小overlap长度为10 bp;拼接序列的overlap区允许的最大错配比率为0.2,筛选不符合序列;根据序列首尾两端的barcode和引物区分样品,调整序列方向,barcode允许的错配数为0,最大引物错配数为2。
基于默认参数,使用Qiime2流程中的DADA2插件对质控拼接后的优化序列进行降噪处理[35-36]。DADA2降噪处理后的序列通常被称为ASVs(扩增子序列变体)。为了降低测序深度对后续α多样性和β多样性等分析结果的影响,将每个样本降噪后的序列数抽平到4000条,抽平后每个样本的平均覆盖度(Good's coverage)依然能达到97.90%。基于Sliva 16S rRNA数据库(v138),使用Qiime2中的Naive Bayes(或Vsearch或Blast)分类器对ASVs进行物种分类学分析。
粪便代谢组学分析如下。① 采集受试者粪便样本3~5 g置于−80 ℃的冰箱,待样本收集完全后进行样本前处理,处理流程:精确称取50 mg样本到2 mL离心管里,加入0.5 mL甲醇-水溶液(体积比CH3OH∶H2O =4∶1,含0.02 mg/mL的内标L-2-氯-苯丙氨酸);加入1颗钢珠,在−20 ℃研磨机中研磨(50 Hz,3 min);加入200 μL的氯仿,在研磨机中研磨(50 Hz,3 min),超声提取30 min,20 ℃静置30 min;低温离心15 min(13000 rcf,4 ℃),取上清液装入玻璃衍生瓶中,氮气吹干;向玻璃衍生瓶中加入80 μL的甲氧胺盐酸吡啶溶液(15 mg/mL),涡旋振荡2 min后,于振荡培养箱中37 ℃肟化反应90 min;取出后再加入80 μL的BSTFA(含1%TMCS)衍生试剂,涡旋振荡2 min后,于70 ℃反应60 min;取出样本,室温放置30 min。②完成基本处理后采用气相色谱质谱联用仪进行GC/MS分析、代谢组学分析,处理色谱条件:衍生化后样本用分流模式注入GC/MS系统进行分析,进样量1 μL,分流比10∶1。样品经DB-5MS 毛细管柱(40 m×0.25 mm×0.25 μm,Agilent 122-5532G)分离后进入质谱检测。进样口温度260 ℃,载气为高纯氦气,载气流速1 mL/min,隔垫吹扫流速3 mL/min,溶剂延迟5.5 min。升温程序:初始温度60 ℃,平衡0.5 min,然后以8 ℃/min的速度升至310 ℃并维持6 min;处理质谱条件为:电子轰击离子源(EI),传输线温度为310 ℃,离子源温230 ℃,四极杆温度150 ℃,电子能70 eV。扫描方式为全扫描模式(SCAN),质量扫描范围:50~500 m/z,扫描频率为3.2 scan/s。
1.2.3 数理统计
采用IBM SPSS 26.0 计算典型误差,对运动干预前后糖代谢指标变化进行配对样本t检验。对粪便样本进行16sRNA全基因测序,采用MassHunter workstation Quantitative Analysis(v10.0.707.0)软件进行峰提取、对齐等数据预处理操作,最终得到代谢物鉴定结果及数据矩阵。采用Wilcoxon rank-sum检验分析不同响应组的肠道菌群α多样性,采用Bray_curtis距离算法对有无响应组的肠道菌群β多样性进行PCoA分析;限定LDA>2.5,P<0.05对各组肠道菌群组成进行LEfSe多级物种差异判别分析;结合Spearman相关系数绘制菌群间单因素相关性网络;提取聚类前50的代谢物与各组丰度前50的菌属进行关联分析,随后对各组优势菌属关联代谢物进行ROC分析,提取预测能力前12的关键代谢物。
2. 研究结果
2.1 R组与NR组的糖代谢变化比较
R组与NR组接受干预后糖代谢变化结果(表3)显示,运动干预后2组受试者糖代谢变化存在较大差异:R组FPG、FINS、HOMA-IR均出现了显著降低;NR组FINS和HOMA-IR均出现了显著升高,FPG无显著变化。
表 3 NR组与R组的糖代谢变化Table 3. Glucose metabolism in NR and R group指标 NR组 R组 前测 后测 t P 前测 后测 t P FPG/(mmol·L−1) 8.62±2.70 8.42±3.34 0.37 0.718 8.86±2.08 7.53±1.39 3.66 0.011 FINS
/(U·L−1)8.96±5.33 11.67±8.16 −2.72 0.026 11.04±7.71 7.69±5.13 2.90 0.026 HOMA-IR 3.67±3.12 4.38±3.75 -2.72 0.026 4.31±3.21 2.63±1.82 3.05 0.022 2.2 R组与NR组的肠道菌群特征比较
2.2.1 R组与NR组肠道菌群多样性比较
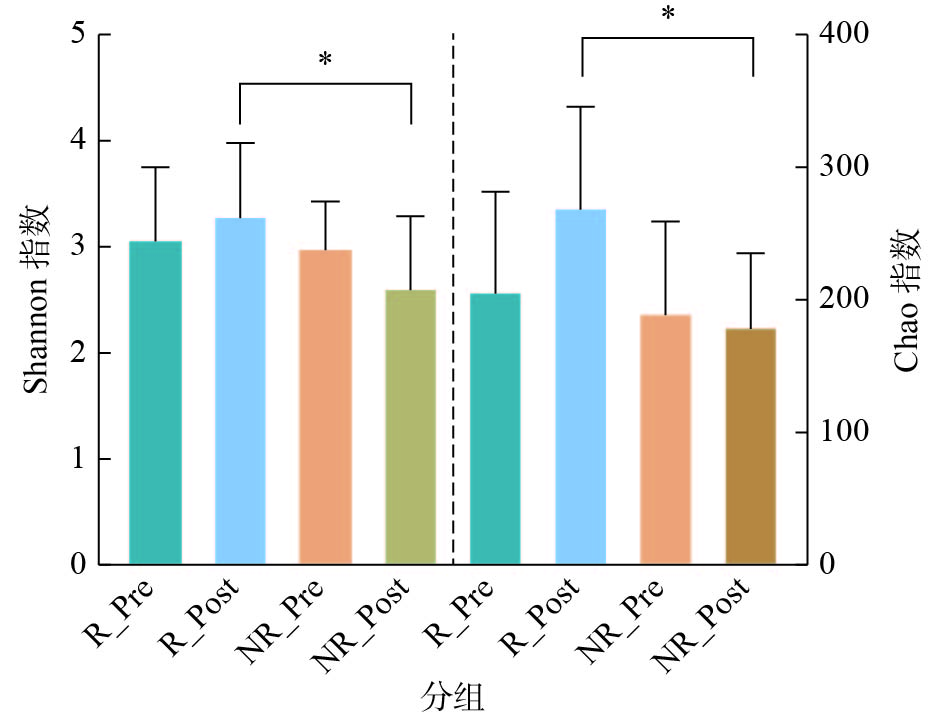
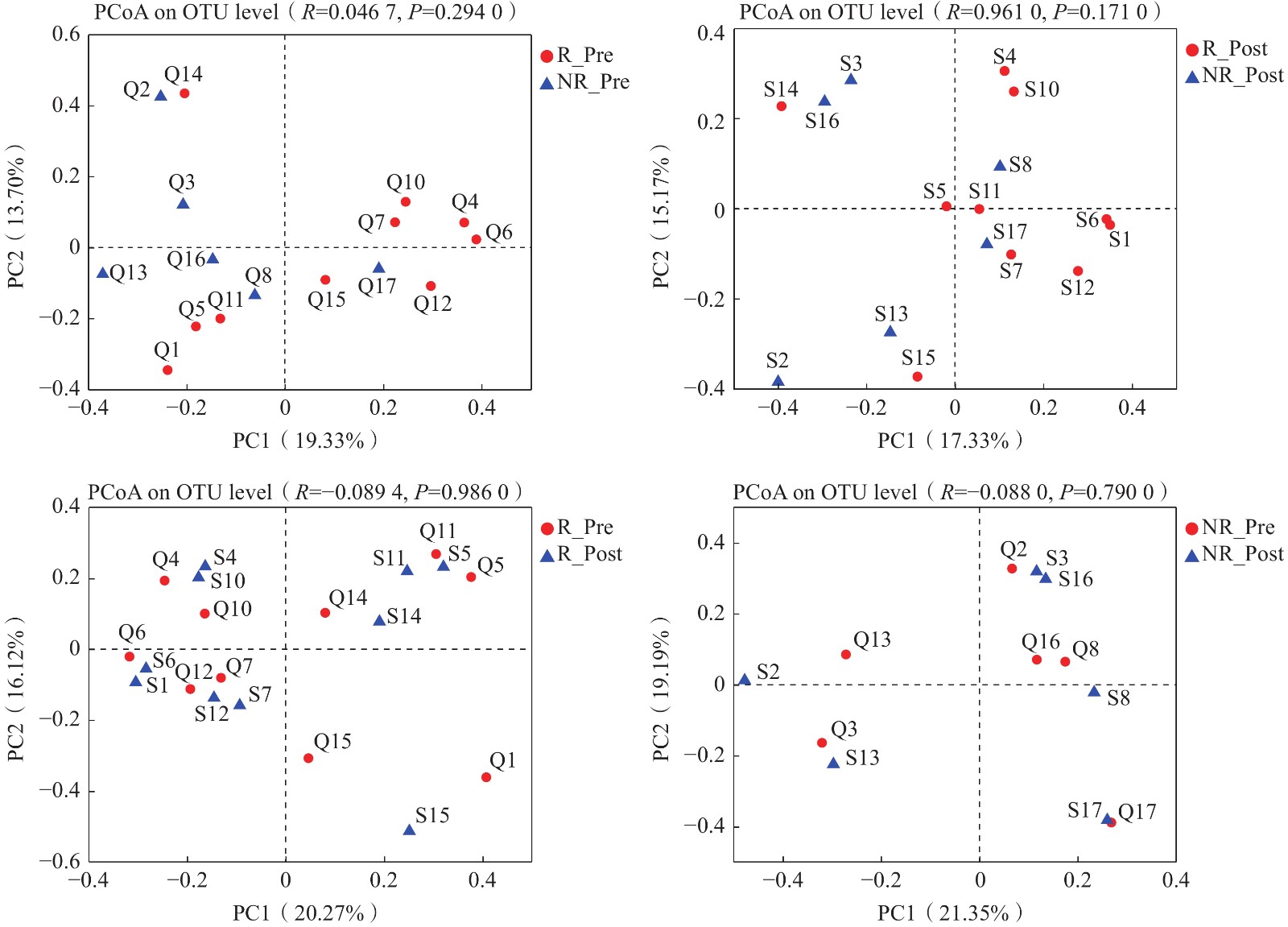
对提取的粪便样本进行全基因组测序,获得了平均每个样本1051118148的碱基对含量,对其进行菌群多样性分析。α多样性分析纳入反映群落内部丰度的Chao指数和多样性的Shannon指数,结果(图2)显示:2组前测样本α多样性均无显著差异,但R组后测样本菌群Shannon指数(3.30±0.68 vs 2.62±0.67,P=0.034)与Chao指数(270.56±75.04 vs 180.46±54.66,P=0.026)均显著高于NR组的;运动干预后R组受试者α多样性比干预前出现了一定提高,NR组则出现了一定下降。采用PCoA分析对2组受试者肠道菌群表型的总体差异进行分析,结果(图3)显示干预前后的组内及组间比较均不存在显著差异(R组干预前后差异,R=−0.09,P=0.99;NR组干预前后差异,R=−0.09,P=0.79;2组前测差异,R=0.05,P=0.29;2组后测差异,R=0.10,P=0.17)。
2.2.2 R组与NR组肠道菌群共存关系网络比较
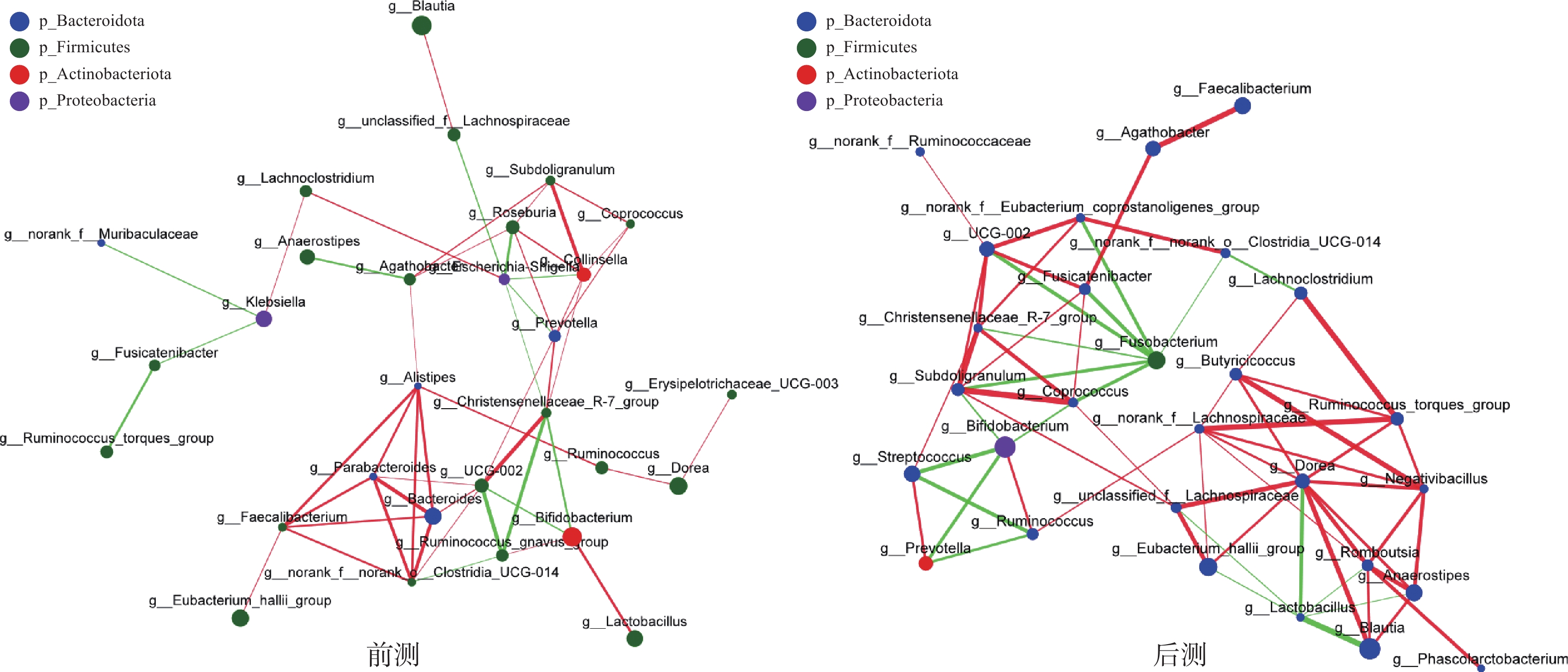
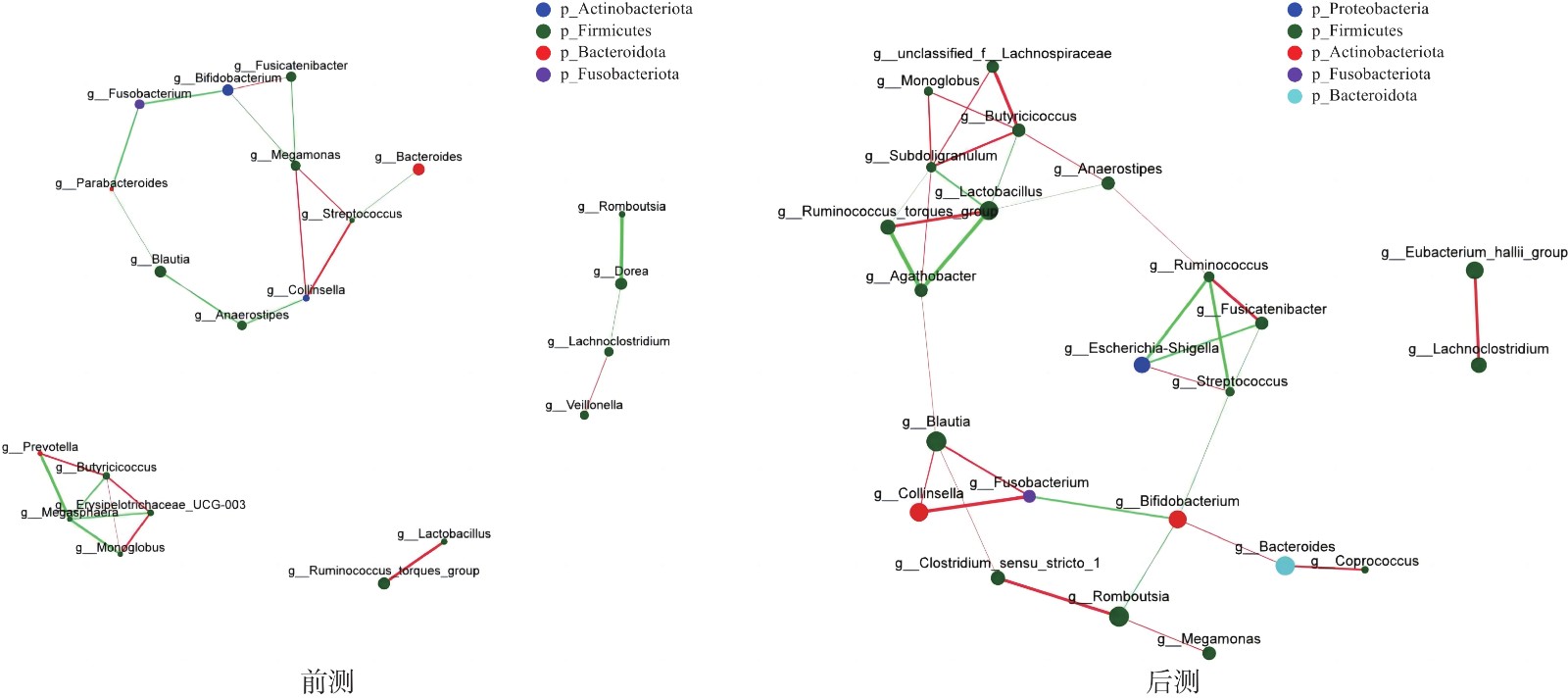
在属水平下提取丰度前30的菌属,绘制关系网络对比2组受试者肠道菌群的共存关系,结果(图4、图5)显示:R组受试者运动干预后菌群网络传递性增强(0.48→0.52),网络直径(10→7)和最短路径长度(3.61→2.84)均缩短,且干预后围绕厚壁菌门下布劳特氏菌属(g_Blautia_hallii_group)、克里斯滕森菌属(g_Christensenellaceae_R-7_group)、毛螺菌属(g_Lachnoclostridium)、瘤胃球菌属(g_Ruminococcus_torques_group)等出现了更多强相关线段;干预前后的NR组菌群都存在非连通部分,网络直径与最短路径长度均无有效值,且运动干预后的菌群网络传递性降低(0.51→0.44)。这表明相较于NR组,运动干预更显著地增强了R组菌群间的共存关系。
2.2.3 R组与NR组肠道菌群差异物种比较
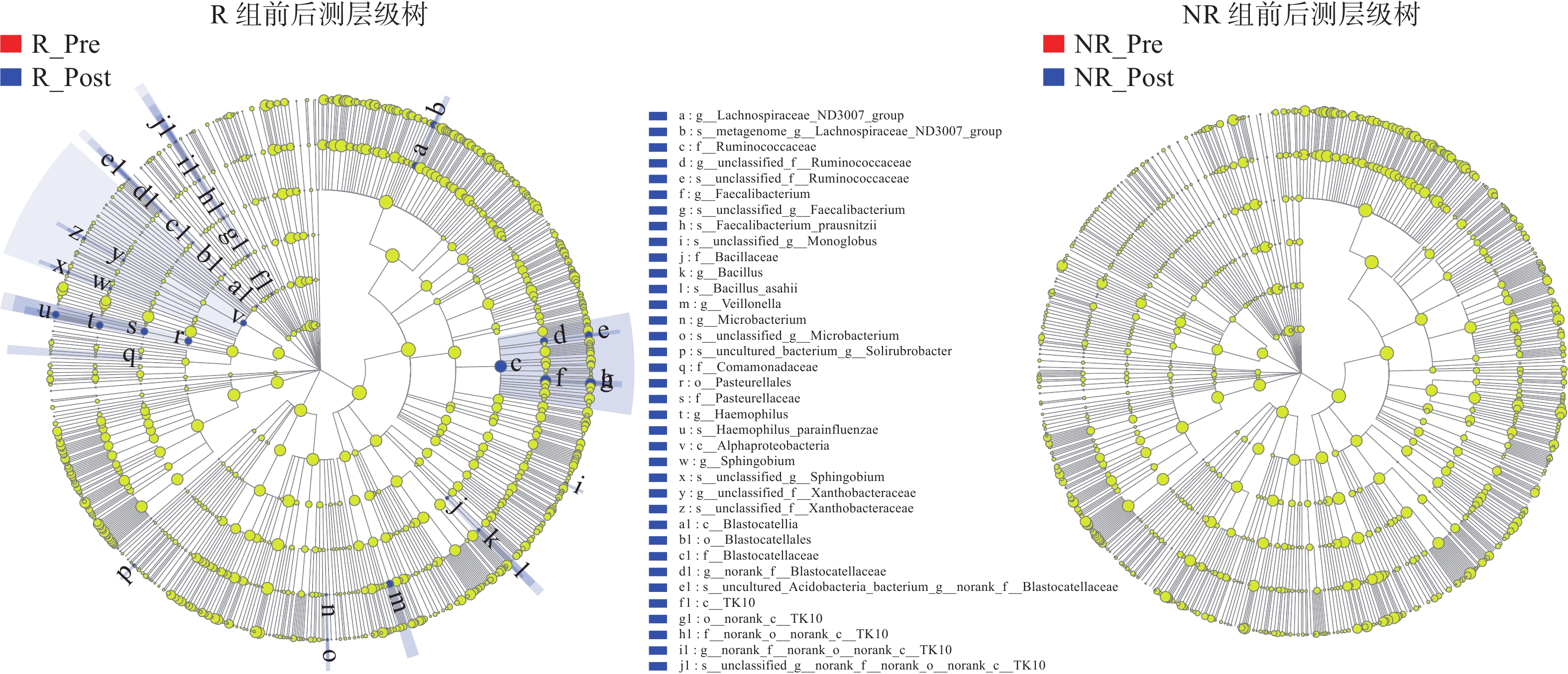
上述分析显示2组受试者菌群关系的差异伴随着物种差异,因此采用LEfSe多级物种差异判别分析筛选2组具有显著差异的菌群,通过LDA估算各菌群丰度对差异影响的大小。LEfSe分析中LDA的选取一般不低于2[37-38],本文选取LDA=2.5的判别阈值,P<0.05的显著性水平对2组菌群从门水平到种水平提取优势差异菌群。结果(图6)显示,运动干预前的样本共定位到28个优势菌群,其中,23种在R组出现了显著富集, 5种在NR组出现了显著富集。干预后共定位到33个优势菌群,其中,31种在R组出现了显著富集,2种在NR组出现了显著富集。组间主要差异菌群见表4。
表 4 组间主要差异菌群Table 4. Major differential gut microbiota after between-group comparison分组 前测 后测 层级 名称 LDA 层级 名称 LDA R组优势 目 克里斯滕森菌目 3.71 目 梭菌目 3.68 RF39菌目 2.94 克里斯滕森菌目 3.76 科 克里斯滕森菌科 3.71 科 克里斯滕森菌科 3.76 红蝽菌科 3.58 梭菌科 3.67 Anaerovoracaceae菌科 3.18 产粪甾醇真细菌科 3.75 属 NK4A214菌属 3.29 UCG-010菌科 2.71 种 粪便罗斯氏菌 4.06 颤螺菌科 4.32 粪球菌属物种 3.33 属 毛螺菌属 3.70 毛螺菌属物种 4.06 NK4A214菌属 3.07 青春双歧杆菌 2.85 UCG-005菌属 2.97 瘤胃球菌 2.84 梭菌属 2.88 克里斯滕森菌属物种 2.52 瘤胃球菌属 2.74 考拉杆菌属物种 2.94 种 粪便罗斯氏菌 3.57 粪球菌属物种 3.28 UCG-002菌属物种 4.11 梭杆菌属物种 2.88 NR组优势 科 Rokubacteriales 2.50 属 大芬戈尔德菌属 2.56 属 韦荣氏球菌属 4.10 种 大芬戈尔德菌属下属菌种 2.56 种 韦荣氏球菌属下属菌种 3.91 土壤红杆菌 2.54 小杆菌 2.65 分别对干预前后2组肠道菌群进行差异菌的组内比较,结果(图7)显示,NR组干预前后不存在差异菌群,R组干预后36种菌群丰度出现了显著上升。组内主要菌群差异见表5。
表 5 R组干预后主要差异菌群Table 5. Major differential gut microbiota after intervention in R group层级 名称 LDA 纲 α变形菌纲 2.60 TK10菌纲 2.56 目 巴斯德氏菌目 2.85 Blastocatellales菌目 3.00 科 瘤胃球菌科 4.46 芽孢杆菌科 2.70 丛毛单胞菌科 2.65 属 毛螺球菌属 2.88 栖粪杆菌属 4.23 芽孢杆菌属 2.69 种 普拉梭菌 4.22 果胶菌属物种 2.76 微杆菌属物种 2.98 土壤红杆菌 2.62 2.3 R组与NR组的菌群代谢物分析
2.3.1 肠道菌群与代谢物关联分析
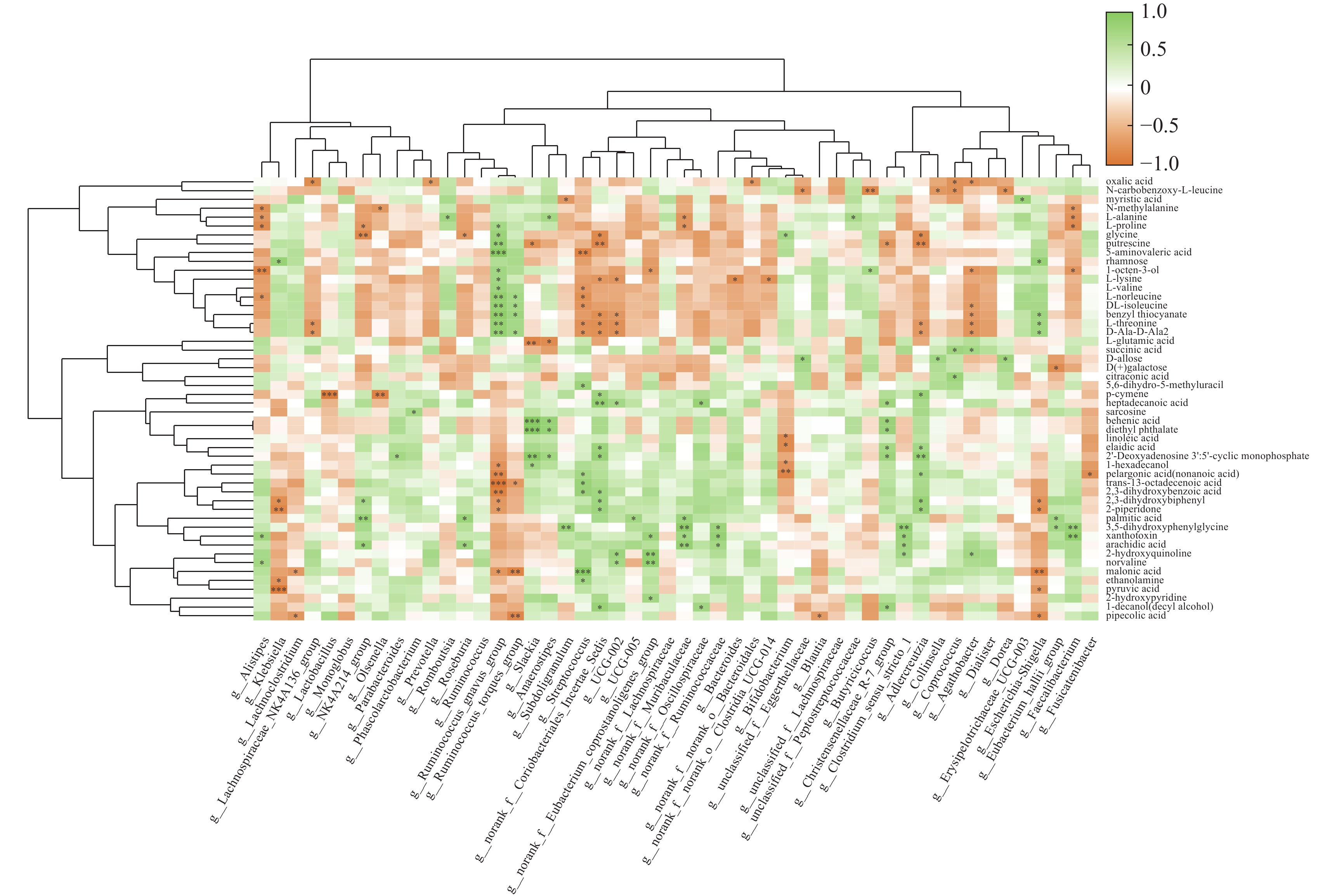
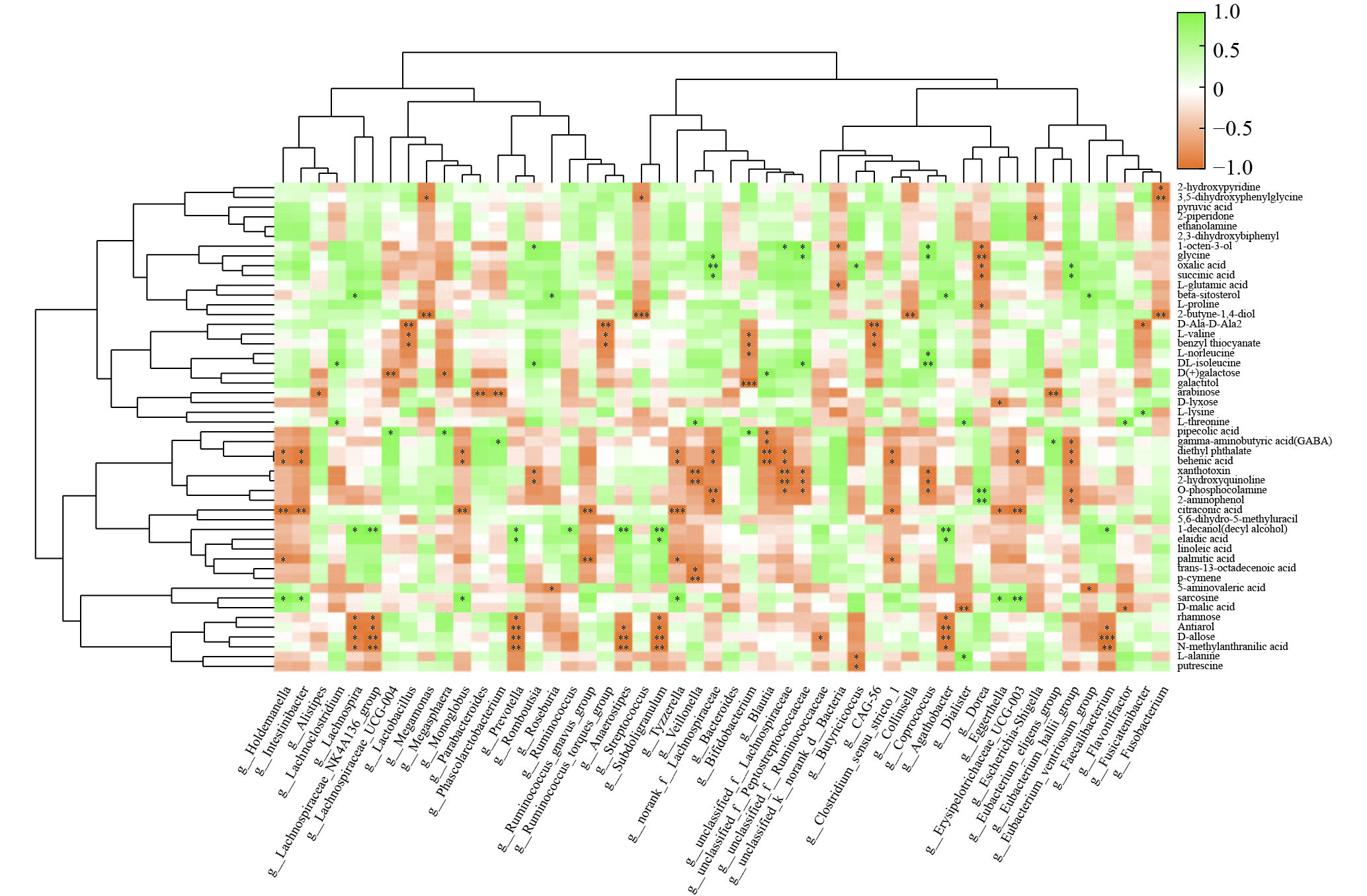
分别对2组干预前后的菌群及粪便代谢物进行层级聚类,取丰度前50的菌属变化与聚类前50的代谢物变化进行关联分析,观测差异菌群诱导的代谢物差异。R组菌群代谢物关联分析结果(图8)显示,与R组优势菌属呈显著正相关的代谢物主要包含与高血糖和胰岛素抵抗密切相关的花生四烯酸(arachidonic acid)、反式13-十八烯酸(trans-13-octadecenoic)、正缬氨酸(norvaline)、L-缬氨酸(L-valine)、2-羟基喹啉(2-hydroxyquinoline)、草酸(oxalic acid)及天然抗氧化剂对伞花烃(p-cymene)等;呈显著负相关的代谢物主要包含与糖尿病视网膜并发症有关的2-哌啶酮(2-piperidone),与脂肪异常代谢有关的5-氨基戊酸(5-Aminovaleric Acid)、肉豆蔻酸(myristic acid),与心血管疾病风险和胰岛素抵抗呈正相关的反油酸(elaidic acid)、糖尿肾病潜在标志物1-十六烷醇(l-hexadecanol)及抗氧化剂柠康酸(citraconic acid)。NR组菌群代谢物关联分析结果(图9)显示,与NR组优势菌属呈显著正相关的代谢物主要包含1-辛烯-3-醇(1-Octen-3-ol)、L-谷氨酸(L-glutamic acid);呈显著负相关的代谢物为肝脏线粒体增加的重要生物标志物2-乙基己酸(2-ethylhexanoic acid)、2-羟基喹啉及黄毒素(xanthotoxin)等。
2.3.2 相关代谢物ROC分析
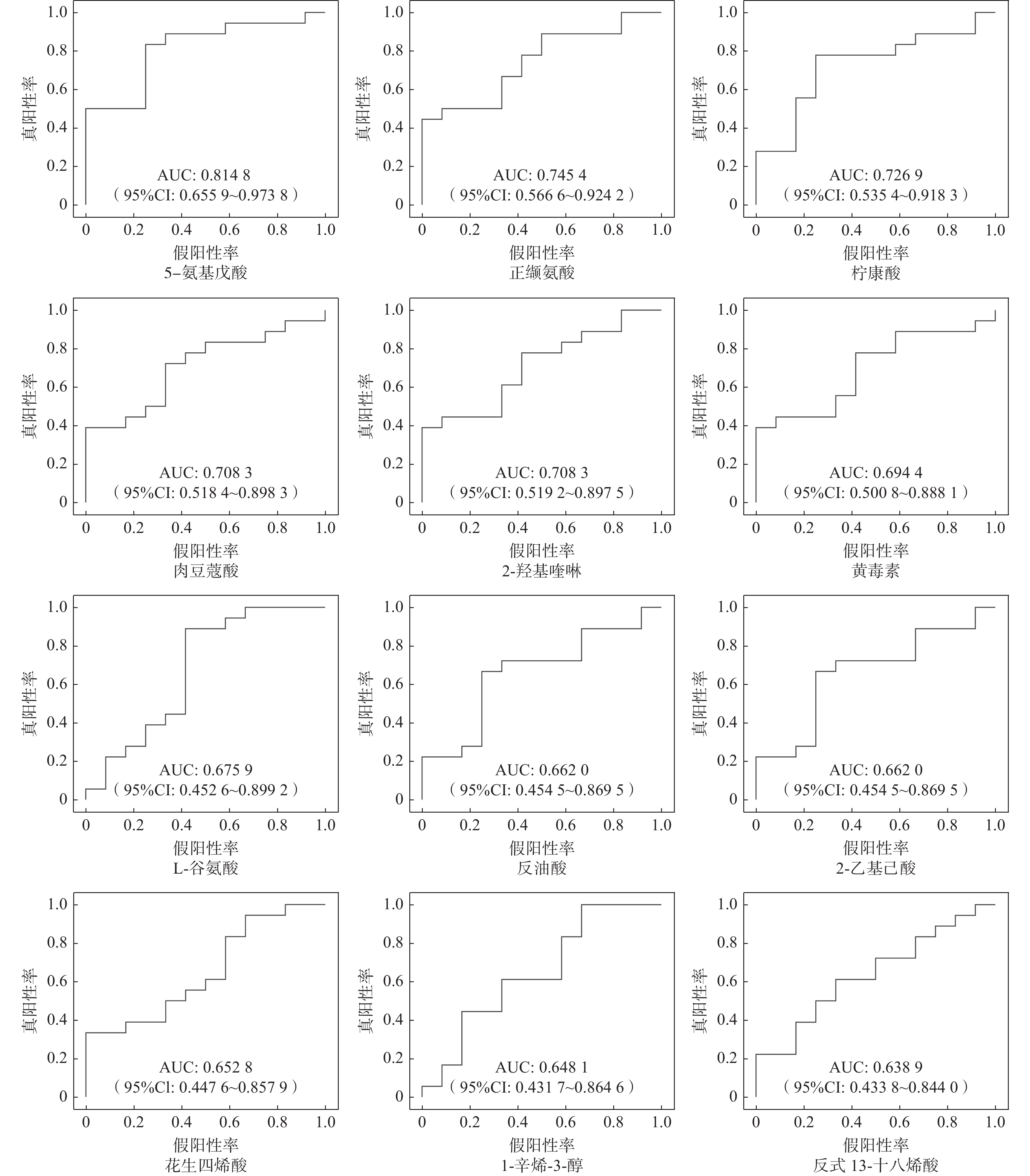
采用监督学习对样本进行线性判别和分组建模,对伴随各组出现变化的代谢物进行ROC分析,通过AUC(Area Under the Curve)衡量该代谢物的变化对运动响应的预测能力,评估其对受试者运动响应的关键程度,一般认为AUC大于0.7表示代谢物预测能力较为理想。结果(图10)显示,共12种代谢物体现出了一定的预测能力,其中:5种有较为理想(AUC>0.7)的预测能力,包括5-氨基戊酸(AUC=0.81)、正缬氨酸(AUC=0.75)、柠康酸(AUC=0.73)、肉豆蔻酸(AUC=0.71)、2-羟基喹啉(AUC=0.71);剩余7种代谢物主要包含黄毒素、L-谷氨酸、反油酸、2-乙基己酸、花生四烯酸、1-辛烯-3-醇、反13-十八烯酸,其AUC区间为0.60~0.70。
3. 分析与讨论
3.1 菌群多样性及共存关系与运动响应的关系
目前国内探讨T2DM患者运动响应与肠道菌群关系的研究十分少见,本文可在一定程度上填补此空白。本文首先以菌群多样性为切入点,探究运动响应与整体群落特征间的关系,结果显示受试者的β多样性均未在运动后出现显著改变,R组菌群的α多样性随胰岛素抵抗的降低出现了升高,这与其他研究[39-40]一致,而NR组α多样性却出现了降低。尽管干预后2组的α多样性出现了显著差异,但干预前并未出现,这提示α多样性并非导致运动响应差异的直接诱因。
有研究[41]报道,代谢疾病与宿主肠道微生态的稳定性密切相关,为此本文从菌群共存关系出发进一步探究。对比干预前后2组的菌群关系网络发现,R组的肠道菌群存在更稳固复杂的共存关系。干预后R组在布劳特氏菌属、克里斯滕森菌属、毛螺菌属等有益菌的外围建立了更强的共存关系,而NR组关系网络的传递性在干预后出现下降。这与2组受试者胰岛素的变化一致,提示肠道内有益菌群间的共存关系可能是影响运动响应的重要因素,运动亦能反过来强化该共存关系。
3.2 肠道菌群组成与运动响应的关系
2组患者肠道菌群组成的差异在前后测中均十分明显。尚未干预前,运动响应者的肠道便出现了诸多益生菌及潜在益生菌的显著富集,这些菌群作用十分广泛,且存在明显共性。以青春双歧杆菌[42]、克里斯滕森菌[43]、粪便罗斯氏菌[44]及毛螺旋杆菌[45-46]为例的优势菌群均对调节血糖、降低胰岛素抵抗具有良好助力。从作用机制上看:上述菌群能从多方面发挥作用,青春双歧杆菌能有效保护胰岛β细胞超微结构,维系其功能[47];克里斯滕森菌能帮助建立健康的葡萄糖代谢循环[48-49];后两者则主要通过直接或间接产生短链脂肪酸(SCFA),改善机体炎症[50-52]。在干预后,运动响应者的肠道菌群的变化主要体现在两方面:首先,原有菌群优势的延续,克里斯滕森菌、粪便罗斯氏菌、毛螺旋杆菌在后测中仍旧显著富集;其次,经过运动干预,普拉梭菌和芽孢杆菌等潜在益生菌出现了显著富集。普拉梭菌是人体丰度最高也是最重要的细菌之一,同时是丁酸的重要生产者,具备良好的抗炎能力[53],且普拉梭菌还可诱导CD4+/CD8α+调节性T细胞在结肠固有层中发挥保护作用,抵御诸多肠道病原体的侵害[54];芽孢杆菌则能抑制肠道致病菌(如金黄色葡萄球菌)的定植[55]、减少炎症诱导因子诱导的一氧化氮合酶(iNOS)[56]。综上,推测运动具有保护和改善运动响应患者肠道微生态的潜力。
相比之下,无论是干预前还是干预后,运动不响应者优势菌群均较为匮乏,甚至出现了韦荣氏球菌[57]和小杆菌[58]等有害菌群的显著富集。二者与肠道炎症[59]、血糖受损[60-61]、肥胖形成、肠胃疾病发生[62]等多个病理过程关系密切。NR组的组内分析也并未检测到前后富集的显著差异,提示运动可能无法改善不响应者的肠道微生态。综上,运动响应者与不响应者在原生肠道菌群方面存在显著差异,尤其体现在相关益生菌与潜在益生菌的富集方面。运动响应患者肠道中存在多种利于T2DM改善的菌群,这可能是其对运动产生有利应答的重要原因,而对于运动不响应者,运动无法有效改善其肠道菌群组成。特定食物和药物的补给或许是解决方案之一。例如:可发酵型膳食纤维(如植物种子类食物)的摄入或在食物中添加阿卡波糖等淀粉抑制剂(可将升血糖淀粉转化为抗性淀粉)可增加肠道内毛螺旋杆菌的丰度[63] ;采用芽孢杆菌发酵的绿茶可减少脂肪消化吸收、增加能耗、降低机体厚壁菌门比例以调节脂代谢[64];青春双歧杆菌与小檗碱联用可改善患者肠道结构与功能,调节菌群组成以叠加降糖效果[65]。
3.3 优势菌群相关代谢物与有无运动响应的关系
菌群与代谢物相互作用,在各种代谢疾病改善中扮演重要角色[66],在ROC分析中,5-氨基戊酸对运动响应最为关键(AUC=0.81),且与R组中多个优势菌属的富集存在显著正相关。多项基于高脂小鼠的实验证实了其对糖代谢改善的良好效果,指出其对高血糖的缓解主要依赖于对C2C12细胞摄取和转运葡萄糖的促进作用[67-68]。同样较为关键的正缬氨酸(AUC=0.75)、肉豆蔻酸(AUC=0.71)则均被证实对脂代谢的改善效果显著,它们仅与运动响应组的优势菌属UCG-002菌属和克里斯滕森菌属显著正相关。正缬氨酸在2项针对高血糖大鼠的实验中显著降低了血液总胆固醇、低密度脂蛋白及氧化应激标志物丙二醛[69-70];肉豆蔻酸能促进褐色脂肪活化和米色脂肪形成,帮助耗能、平衡体脂。花生四烯酸(AUC=0.65)也与UCG-002和NK4A214两个优势菌属显著正相关,作为一种常见的不饱和长链脂肪酸,它有助于增强胰岛素敏感性,响应基础葡萄糖的浓度变化。上述4种代谢物的增加,提示这些优势菌属可能促进了运动响应组在胰岛素敏感性、血糖控制、有益脂肪形成等方面的应答能力,印证了菌群对运动响应的重要作用。
与R组相比,NR组并未呈现完全相反的代谢特征,如NR组出现了1-辛烯-3-醇(AUC=0.65)、L-谷氨酸(AUC=0.68)等有益代谢物。1-辛烯-3-醇对金黄色葡萄球菌、大肠杆菌、三星镰刀菌等有害菌群具有较强的抗菌活性,可有效抑制其生长;L-谷氨酸可通过产生谷胱甘肽抑制氧化应激的产生,降低对胰岛β细胞的损伤、增强外周胰岛素敏感性。尽管1-辛烯-3-醇与R组瘤胃球菌属、毛螺菌属等优势菌属显著正相关,但其并未在运动响应组出现富集。由此可见,2组患者的代谢特征并未出现两极分化,差异明显弱于菌群特征。值得注意的是,肠道菌群和粪便代谢物的关系并非简明单一,个体生活习性的差异和检测手段有限都是重要局限,现有证据仅指出有益代谢间的程度差异可能是运动响应的重要影响因素。
4. 结 论
T2DM患者的运动响应与肠道菌群及其代谢具有密切联系。青春双歧杆菌、克里斯滕森菌、毛螺旋杆菌等有利于糖脂代谢、胰岛素代谢、肠道抗炎的益生菌或潜在益生菌在运动响应者的肠道中显著富集,并建立了稳固的共存关系。这或许是T2DM患者拥有运动响应的重要条件。
运动也能延续或增强运动响应者的肠道微生态优势,主要体现为有益菌群代谢的增强与共存关系的巩固,但无法改善不响应者的肠道微生态,甚至降低了其菌群多样性。因此,对不具有运动响应的患者采用饮食调控和药物干预或许是更好的选择,而是否应避免运动或事先改善其肠道微生态来诱导运动响应值得进一步研究证实。
作者贡献声明:田浩冬:提出论文主题,设计论文框架,撰写论文,参与执行实验;作者贡献声明:黄丽、刘昊为:调研文献,核实数据,修改论文;作者贡献声明:刘诗琪、张壬:设计实验,监督执行实验;作者贡献声明:向秋、张好、王培松:执行实验;作者贡献声明:彭莉:提出论文主题,修改论文,调整论文结构。 -
表 1 受试者基本信息
Table 1 Basic information of participants
基本信息 NR组 R组 t P 性别(人数) 男(n=4),女(n=3) 男(n=4),女(n=5) 年龄/岁 56.67±5.27 56.71±4.46 0.02 0.985 患病年限 8.33±3.00 8.14±2.54 −0.13 0.895 FPG/(mmol·L−1) 8.86±2.08 8.61±2.70 0.20 0.846 FINS/(μU·mL−1) 11.04±7.71 8.96±5.33 0.64 0.532 HOMA-IR 4.31±3.21 3.67±3.12 0.40 0.695 用药情况 双胍类药物、
格列奈类药物、
预混胰岛素双胍类药物、
格列奈类药物、
长效胰岛素
类似物、GLP-1表 2 各阶段训练负荷
Table 2 Intensity of different stage
实验阶段 训练阶段 恢复阶段 1~2周 持续跳绳90 s ×8组 组间主动恢复45 s(原地踏步) 3~4周 持续跳绳90 s×8组 组间被动恢复30 s(原地休息) 5~6周 持续跳绳90 s×8组 组间主动恢复30 s(原地踏步) 表 3 NR组与R组的糖代谢变化
Table 3 Glucose metabolism in NR and R group
指标 NR组 R组 前测 后测 t P 前测 后测 t P FPG/(mmol·L−1) 8.62±2.70 8.42±3.34 0.37 0.718 8.86±2.08 7.53±1.39 3.66 0.011 FINS
/(U·L−1)8.96±5.33 11.67±8.16 −2.72 0.026 11.04±7.71 7.69±5.13 2.90 0.026 HOMA-IR 3.67±3.12 4.38±3.75 -2.72 0.026 4.31±3.21 2.63±1.82 3.05 0.022 表 4 组间主要差异菌群
Table 4 Major differential gut microbiota after between-group comparison
分组 前测 后测 层级 名称 LDA 层级 名称 LDA R组优势 目 克里斯滕森菌目 3.71 目 梭菌目 3.68 RF39菌目 2.94 克里斯滕森菌目 3.76 科 克里斯滕森菌科 3.71 科 克里斯滕森菌科 3.76 红蝽菌科 3.58 梭菌科 3.67 Anaerovoracaceae菌科 3.18 产粪甾醇真细菌科 3.75 属 NK4A214菌属 3.29 UCG-010菌科 2.71 种 粪便罗斯氏菌 4.06 颤螺菌科 4.32 粪球菌属物种 3.33 属 毛螺菌属 3.70 毛螺菌属物种 4.06 NK4A214菌属 3.07 青春双歧杆菌 2.85 UCG-005菌属 2.97 瘤胃球菌 2.84 梭菌属 2.88 克里斯滕森菌属物种 2.52 瘤胃球菌属 2.74 考拉杆菌属物种 2.94 种 粪便罗斯氏菌 3.57 粪球菌属物种 3.28 UCG-002菌属物种 4.11 梭杆菌属物种 2.88 NR组优势 科 Rokubacteriales 2.50 属 大芬戈尔德菌属 2.56 属 韦荣氏球菌属 4.10 种 大芬戈尔德菌属下属菌种 2.56 种 韦荣氏球菌属下属菌种 3.91 土壤红杆菌 2.54 小杆菌 2.65 表 5 R组干预后主要差异菌群
Table 5 Major differential gut microbiota after intervention in R group
层级 名称 LDA 纲 α变形菌纲 2.60 TK10菌纲 2.56 目 巴斯德氏菌目 2.85 Blastocatellales菌目 3.00 科 瘤胃球菌科 4.46 芽孢杆菌科 2.70 丛毛单胞菌科 2.65 属 毛螺球菌属 2.88 栖粪杆菌属 4.23 芽孢杆菌属 2.69 种 普拉梭菌 4.22 果胶菌属物种 2.76 微杆菌属物种 2.98 土壤红杆菌 2.62 -
[1] GURD B J,GILES M D,BONAFIGLIA J T,et al. Incidence of nonresponse and individual patterns of response following sprint interval training[J]. Applied Physiology,Nutrition,and Metabolism,2016,41(3):229-234 doi: 10.1139/apnm-2015-0449
[2] JANAUDIS-FERREIRA T. Exercise training improves exercise capacity and quality of life in people with interstitial lung disease[J]. Journal of Physiotherapy,2017,63(4):257
[3] ASTORINO T A,SCHUBERT M M. Individual responses to completion of short-term and chronic interval training:A retrospective study[J]. PLoS One,2014,9(5):e97638 doi: 10.1371/journal.pone.0097638
[4] DELGADO-FLOODY P,ÁLVAREZ C,LUSA CADORE E,et al. Preventing metabolic syndrome in morbid obesity with resistance training:Reporting interindividual variability[J]. Nutrition,Metabolism and Cardiovascular Diseases,2019,29(12):1368-1381
[5] ÁLVAREZ C,RAMÍREZ-CAMPILLO R,RAMÍREZ-VÉLEZ R,et al. Effects and prevalence of nonresponders after 12 weeks of high-intensity interval or resistance training in women with insulin resistance:A randomized trial[J]. Journal of Applied Physiology,2017,122(4):985-996 doi: 10.1152/japplphysiol.01037.2016
[6] FRIEDRICH N. Metabolomics in diabetes research[J]. The Journal of Endocrinology,2012,215(1):29-42 doi: 10.1530/JOE-12-0120
[7] 徐冰冰,李肖静,张亚伟. 2型糖尿病患者糖尿病慢性并发症现状调查及影响因素[J]. 华南预防医学,2021,47(1):74-76 [8] 《中国老年型糖尿病防治临床指南》编写组. 中国老年2型糖尿病防治临床指南(2022年版)[J]. 中国糖尿病杂志,2022,30(1):2-51 [9] ÁLVAREZ C,RAMÍREZ-CAMPILLO R,RAMÍREZ-VÉLEZ R,et al. Prevalence of non-responders for glucose control markers after 10 weeks of high-intensity interval training in adult women with higher and lower insulin resistance[J]. Frontiers in Physiology,2017,8:479 doi: 10.3389/fphys.2017.00479
[10] 杨坡,张跃耀,阿力木·热合曼,等. 运动改善胰岛β细胞功能障碍的研究进展[J]. 中国细胞生物学学报,2021,43(12):2402-2408 [11] LIU Y,WANG Y,NI Y Q,et al. Gut microbiome fermentation determines the efficacy of exercise for diabetes prevention[J]. Cell Metabolism,2020,31(1):77-91 doi: 10.1016/j.cmet.2019.11.001
[12] BÖHM A,WEIGERT C,STAIGER H,et al. Exercise and diabetes:Relevance and causes for response variability[J]. Endocrine,2016,51(3):390-401 doi: 10.1007/s12020-015-0792-6
[13] 赵翠翠,覃飞,耿雪,等. 肠道菌群:运动干预治疗2型糖尿病的新靶点[J]. 体育科研,2021,42(2):85-91 doi: 10.12064/ssr.20210210 [14] 漆艳娥,杨雪菲,周雪,等. 运动与肠道菌群的相关性[J]. 中国微生态学杂志,2016,28(7):857-860,864 doi: 10.13381/j.cnki.cjm.201607028 [15] American Diabetes Association. 4. Lifestyle management:Standards of medical care in diabetes-2018[J]. Diabetes Care,2018,41(Suppl 1):S38-S50 doi: 10.2337/dc18-S004
[16] TILG H,MOSCHEN A R. Microbiota and diabetes:An evolving relationship[J]. Gut,2014,63(9):1513-1521 doi: 10.1136/gutjnl-2014-306928
[17] ZHANG X Y,SHEN D Q,FANG Z W,et al. Human gut microbiota changes reveal the progression of glucose intolerance[J]. PLoS One,2013,8(8):e71108 doi: 10.1371/journal.pone.0071108
[18] COLLINS H L,DRAZUL-SCHRADER D,SULPIZIO A C,et al. L-Carnitine intake and high trimethylamine N-oxide plasma levels correlate with low aortic lesions in ApoE−/− transgenic mice expressing CETP[J]. Atherosclerosis,2016,244:29-37 doi: 10.1016/j.atherosclerosis.2015.10.108
[19] 梁磊,念馨. 肠道菌群:未来2型糖尿病治疗的新靶点[J]. 实用医学杂志,2022,38(3):261-265 doi: 10.3969/j.issn.1006-5725.2022.03.001 [20] HUTTENHOWER C,GEVERS D,KNIGHT R,et al. Structure,function and diversity of the healthy human microbiome[J]. Nature,2012,486(7402):207-214 doi: 10.1038/nature11234
[21] DAVID L A,MAURICE C F,CARMODY R N,et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature,2014,505(7484):559-563 doi: 10.1038/nature12820
[22] 樊萌语,吕筠,何平平. 国际体力活动问卷中体力活动水平的计算方法[J]. 中华流行病学杂志,2014,35(8):961-964 [23] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 国际内分泌代谢杂志,2021,41(5):482-548 doi: 10.3760/cma.j.cn121383-20210825-08063 [24] HOPKINS W G. Measures of reliability in sports medicine and science[J]. Sports Medicine,2000,30(1):1-15 doi: 10.2165/00007256-200030010-00001
[25] 闫增印,闫平平,秦春莉,等. 连续性及高强度间歇运动对2型糖尿病血糖调控影响的研究进展[J]. 中国全科医学,2021,24(12):1575-1580 [26] MANNUCCI E,BONIFAZI A,MONAMI M. Comparison between different types of exercise training in patients with type 2 diabetes mellitus:A systematic review and network metanalysis of randomized controlled trials[J]. Nutrition,Metabolism and Cardiovascular Diseases,2021,31(7):1985-1992
[27] MONTES-DE-OCA-GARCÍA A,MANZANEDO J G,PONCE-GONZÁLEZ J G. High-intensity interval training (HIIT) as a therapeutic tool in patients with type 2 diabetes mellitus:A narrative review[J]. Retos:Nuevas Tendencias en Educación Física,Deportey Recreación,2019,36(36):633-639
[28] 韩奇,刘佳易,安楠,等. 高强度间歇运动与中等强度持续运动对2型糖尿病患者血糖控制和心血管风险因子干预效果对比的Meta分析[J]. 中国运动医学杂志,2021,40(10):822-830 doi: 10.3969/j.issn.1000-6710.2021.10.009 [29] 刘静,邱芬,邱卓英,等. 世界卫生组织身体活动政策和指南的架构与核心内容研究[J]. 中国康复理论与实践,2021,27(12):1402-1411 doi: 10.3969/j.issn.1006-9771.2021.12.005 [30] 陈玉轩,梁金梅,敖河边,等. 间歇式高强度运动训练管理在2型糖尿病患者中的应用[J]. 中国临床护理,2022,14(7):420-421,425 doi: 10.3969/j.issn.1674-3768.2022.07.006 [31] 冯臣,药家明,周国瑾,等. 高强度间歇训练对2型糖尿病患者运动干预的效果:基于《WHO关于身体活动和久坐行为的指南》和WHO-FICs[J]. 中国康复理论与实践,2022,28(6):646-652 doi: 10.3969/j.issn.1006-9771.2022.06.004 [32] 汪雅静,张超,吕少萍,等. 高强度间歇运动对2型糖尿病患者糖脂代谢指标影响的研究[J]. 中华护理杂志,2019,54(11):1605-1609 [33] 杨圣韬,尹晓峰,高炳宏. 应用主观疲劳量表量化运动负荷的研究进展[J]. 体育科研,2019,40(5):85-94 doi: 10.12064/ssr.20190511 [34] CHEN S F,ZHOU Y Q,CHEN Y R,et al. Fastp:An ultra-fast all-in-one FASTQ preprocessor[J]. Bioinformatics,2018,34(17):i884-i890 doi: 10.1093/bioinformatics/bty560
[35] BOLYEN E,RIDEOUT J R,DILLON M R,et al. Reproducible,interactive,scalable and extensible microbiome data science using QIIME 2[J]. Nature Biotechnology,2019,37(8):852-857 doi: 10.1038/s41587-019-0209-9
[36] CALLAHAN B J,MCMURDIE P J,ROSEN M J,et al. DADA2:High-resolution sample inference from Illumina amplicon data[J]. Nature Methods,2016,13(7):581-583 doi: 10.1038/nmeth.3869
[37] HUHE,CHEN X J,HOU F J,et al. Bacterial and fungal community structures in loess plateau grasslands with different grazing intensities[J]. Frontiers in Microbiology,2017,8:606 doi: 10.3389/fmicb.2017.00606
[38] GUERRERO-PRESTON R,GODOY-VITORINO F,JEDLICKA A,et al. 16S rRNA amplicon sequencing identifies microbiota associated with oral cancer,human papilloma virus infection and surgical treatment[J]. Oncotarget,2016,7(32):51320-51334 doi: 10.18632/oncotarget.9710
[39] ORSSO C E,PENG Y,DEEHAN E C,et al. Composition and functions of the gut microbiome in pediatric obesity:Relationships with markers of insulin resistance[J]. Microorganisms,2021,9(7):1490 doi: 10.3390/microorganisms9071490
[40] CHEN Z L,RADJABZADEH D,CHEN L M,et al. Association of insulin resistance and type 2 diabetes with gut microbial diversity:A microbiome-wide analysis from population studies[J]. JAMA Network Open,2021,4(7):e2118811 doi: 10.1001/jamanetworkopen.2021.18811
[41] CHENG R T,WANG L,LE S L,et al. A randomized controlled trial for response of microbiome network to exercise and diet intervention in patients with nonalcoholic fatty liver disease[J]. Nature Communications,2022,13(1):1-13 doi: 10.1038/s41467-021-27699-2
[42] 刘伯阳,姚淑娟,夏美玲. 青春双歧杆菌对2型糖尿病模型大鼠肠道菌群和脂质代谢的影响[J]. 中国微生态学杂志,2009,21(10):877-879 doi: 10.13381/j.cnki.cjm.2009.10.021 [43] WATERS J L,LEY R E. The human gut bacteria Christensenellaceae are widespread,heritable,and associated with health[J]. BMC Biology,2019,17(1):83 doi: 10.1186/s12915-019-0699-4
[44] NULI R,CAI J X,KADEER A,et al. Integrative analysis toward different glucose tolerance-related gut microbiota and diet[J]. Frontiers in Endocrinology,2019,10:295 doi: 10.3389/fendo.2019.00295
[45] LIU R Q,PENG C,JING D R,et al. Lachnospira is a signature of antihistamine efficacy in chronic spontaneous urticaria[J]. Experimental Dermatology,2022,31(2):242-247 doi: 10.1111/exd.14460
[46] ETXEBERRIA U,HIJONA E,AGUIRRE L,et al. Pterostilbene-induced changes in gut microbiota composition in relation to obesity[J]. Molecular Nutrition & Food Research,2017,61(1):1500906 doi: 10.1002/mnfr.201500906
[47] 刘伯阳,陈永春,张梅,等. 青春双歧杆菌对1型糖尿病小鼠胰岛β细胞的保护作用[J]. 中国微生态学杂志,2009,21(3):205-207 doi: 10.13381/j.cnki.cjm.2009.03.027 [48] ORG E,BLUM Y,KASELA S,et al. Relationships between gut microbiota,plasma metabolites,and metabolic syndrome traits in the METSIM cohort[J]. Genome Biology,2017,18(1):70 doi: 10.1186/s13059-017-1194-2
[49] LIM M Y,YOU H J,YOON H S,et al. The effect of heritability and host genetics on the gut microbiota and metabolic syndrome[J]. Gut,2017,66(6):1031-1038 doi: 10.1136/gutjnl-2015-311326
[50] BUI T P N,MANNERÅS-HOLM L,PUSCHMANN R,et al. Conversion of dietary inositol into propionate and acetate by commensal Anaerostipes associates with host health[J]. Nature Communications,2021,12(1):1-16 doi: 10.1038/s41467-020-20314-w
[51] SORBARA M T,LITTMANN E R,FONTANA E,et al. Functional and genomic variation between human-derived isolates of Lachnospiraceae reveals inter- and intra-species diversity[J]. Cell Host & Microbe,2020,28(1):134-146
[52] MUKHERJEE A,LORDAN C,ROSS R P,et al. Gut microbes from the phylogenetically diverse genus Eubacterium and their various contributions to gut health[J]. Gut Microbes,2020,12(1):1802866 doi: 10.1080/19490976.2020.1802866
[53] HEINKEN A,KHAN M T,PAGLIA G,et al. Functional metabolic map of Faecalibacterium prausnitzii,a beneficial human gut microbe[J]. Journal of Bacteriology,2014,196(18):3289-3302 doi: 10.1128/JB.01780-14
[54] TOUCH S,GODEFROY E,ROLHION N,et al. Human CD4+CD8α+ Tregs induced by Faecalibacterium prausnitzii protect against intestinal inflammation[J]. JCI Insight,2022,7(12):154722 doi: 10.1172/jci.insight.154722
[55] PIEWNGAM P,ZHENG Y,NGUYEN T H,et al. Pathogen elimination by probiotic Bacillus via signalling interference[J]. Nature,2018,562(7728):532-537 doi: 10.1038/s41586-018-0616-y
[56] RHAYAT L,MARESCA M,NICOLETTI C,et al. Effect of Bacillus subtilis strains on intestinal barrier function and inflammatory response[J]. Frontiers in Immunology,2019,10:564 doi: 10.3389/fimmu.2019.00564
[57] 胡珊珊,王烨,毛新民,等. 新疆哈萨克族2型糖尿病患者粪便中韦荣球菌的分离鉴定[J]. 中国微生态学杂志,2016,28(5):512-514 doi: 10.13381/j.cnki.cjm.201605004 [58] AFOUDA P,DUBOURG G,TOMEÏ E,et al. Dialister massiliensis sp. nov.,a new bacterium isolated from the human gut[J]. New Microbes and New Infections,2020,34:100657 doi: 10.1016/j.nmni.2020.100657
[59] MATERA G,MUTO V,VINCI M,et al. Receptor recognition of and immune intracellular pathways for Veillonella parvula lipopolysaccharide[J]. Clinical and Vaccine Immunology:CVI,2009,16(12):1804-1809 doi: 10.1128/CVI.00310-09
[60] QUIROGA R,NISTAL E,ESTÉBANEZ B,et al. Exercise training modulates the gut microbiota profile and impairs inflammatory signaling pathways in obese children[J]. Experimental & Molecular Medicine,2020,52(7):1048-1061
[61] COKER O O,DAI Z W,NIE Y Z,et al. Mucosal microbiome dysbiosis in gastric carcinogenesis[J]. Gut,2018,67(6):1024-1032 doi: 10.1136/gutjnl-2017-314281
[62] 李辉,薛军霞,王永红,等. 韦荣氏球菌调节结直肠癌细胞PI3K通路的分子机制研究[J]. 中国病原生物学杂志,2021,16(2):208-212 doi: 10.13350/j.cjpb.210216 [63] ZHAO L P,ZHANG F,DING X Y,et al. Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes[J]. Science,2018,359(6380):1151-1156 doi: 10.1126/science.aao5774
[64] SEO D B,JEONG H W,KIM Y J,et al. Fermented green tea extract exhibits hypolipidaemic effects through the inhibition of pancreatic lipase and promotion of energy expenditure[J]. The British Journal of Nutrition,2017,117(2):177-186 doi: 10.1017/S0007114516004621
[65] MING J,YU X W,XU X Q,et al. Effectiveness and safety of Bifidobacterium and berberine in human hyperglycemia and their regulatory effect on the gut microbiota:A multi-center,double-blind,randomized,parallel-controlled study[J]. Genome Medicine,2021,13(1):125 doi: 10.1186/s13073-021-00942-7
[66] 马治华,白明生,张自萍. 肠道菌群代谢物在心血管疾病和代谢疾病中的作用[J]. 微生物学杂志,2020,40(4):84-89 doi: 10.3969/j.issn.1005-7021.2020.04.013 [67] KURODA Y,KAMIYA A,ISHII T,et al. 5-Aminolevulinic acid combined with ferrous iron improves glucose tolerance in high-fat diet-fed mice via upregulation of glucose transporter 1[J]. Experimental and Therapeutic Medicine,2021,22(6):1454 doi: 10.3892/etm.2021.10889
[68] HARA T,KODA A,NOZAWA N,et al. Combination of 5-aminolevulinic acid and ferrous ion reduces plasma glucose and hemoglobin A1c levels in Zucker diabetic fatty rats[J]. FEBS Open Bio,2016,6(6):515-528 doi: 10.1002/2211-5463.12048
[69] JAVRUSHYAN H,NADIRYAN E,GRIGORYAN A,et al. Antihyperglycemic activity of L-norvaline and L-arginine in high-fat diet and streptozotocin-treated male rats[J]. Experimental and molecular pathology,2022,126:104763 doi: 10.1016/j.yexmp.2022.104763
[70] OTA U,HARA T,NAKAGAWA H,et al. 5-aminolevulinic acid combined with ferrousion reduces adiposity and improves glucose tolerance in diet-induced obese mice via enhancing mitochondrial function[J]. BMC Pharmacology & Toxicology,2017,18(1):7
-
期刊类型引用(4)
1. 刘昭志,黄丽,田浩冬,李岚,陈晓,陶云飞,彭莉. 运动对大学生肠道菌群影响的系统综述. 中国组织工程研究. 2025(11): 2394-2401 .  百度学术
百度学术
2. 刘昭志,彭莉. 运动、肠道菌群和2型糖尿病关系的研究进展. 微生物学报. 2025(01): 1-16 .  百度学术
百度学术
3. 丁博,张爱新,韩雅洁,王茂叶. 不同运动方式干预对昼夜节律紊乱小鼠认知功能的影响——基于肠道菌群和非靶向代谢组学分析. 上海体育大学学报. 2024(03): 49-64 .  本站查看
本站查看
4. 杨雅楠,于瑶,邢凤梅,蔡逢雨,薛新宏,王晓光,张小丽. 基于计划行为理论的干预对老年肌少症患者疾病认知、运动自我效能及日常生活能力的影响. 现代预防医学. 2024(14): 2615-2619 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载: